Introducción
En el género Phytophthora, existen alrededor de 124 especies descritas (Martin et al., 2014), las cuales tienen la capacidad de infectar cientos de especies de plantas alrededor del mundo (Gallegly y Hong, 2008). En la actualidad, la presencia de especies de Phytophthora en ambientes acuáticos se ha incrementado (Zappia et al., 2014) por ejemplo, en años recientes destaca la presencia de Phytophthora hydropathica principalmente en agua de irrigación (Hulvey et al., 2010; Hüberli et al., 2013; Bienalfp y Balci, 2014; esto es de esperarse, ya que etimológicamente, el nombre de este microorganismo deriva de los vocablos griegos ‘hydro’ que se refiere a su naturaleza acuática y ‘pathica’ a su naturaleza patogénica (Hong et al., 2010). La mayoría de los reportes de P. hydropathica se relacionan con infecciones en plantas ornamentales, tal es el caso de necrosis foliar en azalea (Rhododendron catawbiense), pudrición del cuello en laurel de montaña (Kalmia latifolia) (Hong et al., 2010), así como marchitez y muerte regresiva del laurel silvestre (Viburnum tinus) (Vitale et al., 2014).
Antes de ser descrita formalmente como P. hydropathica, Hong et al. (2008) demostraron que esta especie es capaz de causar ‘damping off’ en plántulas de pepino, mientras que, en plantas de tomate y chile causó infecciones en raíz; además, mencionan que P. hydropathica penetra en frutos de tomate y chile por medio de heridas. En México, la presencia de P. hydropathica se reportó en agua de irrigación en el Valle de Culiacán y se demostró que puede causar necrosis en hojas de tomate y chile (Álvarez et al., 2017).
Para controlar enfermedades causadas por Phytophthora se utiliza principalmente el ingrediente químico metalaxyl, el cual es un fungicida tipo fenilamida que protege de manera sistémica a las plantas, principalmente para el control de oomicetes (Urech et al., 1977). El metalaxyl actúa en sitios específicos del patógeno impidiendo la biosíntesis de proteínas mediante la interferencia en la síntesis del ARN ribosomal (Nunninger et al., 1995); sin embargo, el uso excesivo de este producto puede ocasionar que los patógenos generen resistencia (Damicone, 2004). Un ejemplo es el rápido desarrollo de resistencia en poblaciones de P. infestans, el cual fue detectado en los años 80 en Europa (Davidse et al., 1981) y en los años 90 en EE. UU, Canadá y México (Matuszak et al., 1994; Power et al., 1995).
Los aislados resistentes son igual o más agresivos que los aislados susceptibles, convirtiendo así la resistencia al metalaxyl en una característica agronómica importante en el manejo integrado de las enfermedades causadas por Phytophthora, especialmente en el tizón tardío de papa provocado por P. infestans (Forbes et al., 1998); además, se han utilizado bioensayos in vitro para caracterizar y clasificar aislados de Phytophthora y de otros oomicetes de acuerdo al nivel de susceptibilidad al metalaxyl (Peters et al., 2001; Fontem et al., 2005; Tian et al., 2016).
Los objetivos del presente estudio fueron: 1) determinar el potencial patogénico de aislamientos de P. hydropathica en hojas y frutos de tomate, pepino y calabacita; y 2) determinar la sensibilidad o resistencia de dichos aislamientos a metalaxyl.
Materiales y métodos
Potencial patogénico. Para determinar el potencial patogénico se utilizaron tres cepas representativas de la especie P. hydropathica [13F2 (KX298864), 16-1F2 (KX298868) y 18-2F1 (KX298873). Las cepas se reactivaron en medio papa dextrosa agar (PDA). En los experimentos de patogenicidad se utilizaron tres frutos de tomate (Saladette), pepino (SFPP) y calabaza (Nurizeli), así como tres hojas de calabaza (Nurizeli) y de pepino (SFPP) de 1 mes de edad. Los materiales vegetales se lavaron con agua corriente y se desinfestaron con etanol al 70%. Tanto en hojas como en frutos se realizaron heridas con una aguja de disección estéril y se inocularon colocando discos de 5 mm de diámetro de medio PDA con crecimiento activo de las tres cepas. Las hojas y frutos inoculados se colocaron en cámara húmeda durante 120 h (Orlikowski et al., 2012). Como control se utilizaron frutos y hojas en los que se realizaron heridas y se colocaron discos de medio de cultivo.
Sensibilidad a Metalaxyl. Para evaluar la susceptibilidad de las cepas de P. hydropathica a metalaxyl, se realizó un estudio in vitro, el cual consistió en adicionarle al medio de cultivo PDA 10 mg L-1 de metalaxyl (Shattock, 1988; Rekanovic et al., 2011), se utilizó la fórmula comercial Ridomil Gold 480 EC (480 g de ingrediente activo de metalaxyl), el cual se agregó al medio de cultivo después de esterilizarlo y justo antes de vaciarlo en placas Petri. Del borde de las colonias de cada cepa se tomaron discos de 5 mm de diámetro de medio de cultivo con crecimiento micelial y se colocaron en placas Petri con medio PDA adicionado con metalaxyl y sin metalaxyl (control). El crecimiento in vitro de cada aislado se evaluó después de seis días a 25 ºC (Paez et al., 2001).
El crecimiento se determinó al medir perpendicularmente el diámetro de la colonia. Para determinar el crecimiento relativo se utilizó la fórmula PC= (DMC-5mm/DMCA)100; donde PC= porcentaje de crecimiento, DMC= diámetro de la colonia con metalaxyl y DMCA= diámetro de la colonia sin metalaxyl. Un porcentaje de crecimiento en diámetro de la colonia igual o superior a 60%, se considera al aislado resistente, un crecimiento de la colonia entre 10-60% es catalogado como intermedio y cuando la colonia es menor a 10% es considerada como susceptible (Shattock, 1988; Deahl et al., 1995; Riveros et al., 2003).
Para determinar los valores de la CE50 en cada cepa, se utilizaron cuatro concentraciones de metalaxyl 0.1, 1, 5 y 10 mg L-1; la CE50 se calculó mediante una regresión lineal entre el log10 del crecimiento radial relativo y el log10 de la concentración del fungicida (Páez et al., 2001). Para cada aislado y concentración de metalaxyl se realizaron tres repeticiones.
Diseño de experimentos. En el ensayo con medio de cultivo PDA con 10 mg L-1 de metalaxyl se utilizó un diseño de un factor totalmente al azar, donde el factor fueron los 18 aislados. Se realizó un análisis de varianza y comparaciones de medias mediante la prueba de Tuckey. Para el ensayo in vitro en el cual se determinó la resistencia o sensibilidad de los aislados a metalaxyl, se utilizó un diseño de dos factores totalmente al azar; un factor consistió en los aislados con 18 niveles y el otro factor en la concentración de metalaxyl. La variable de respuesta fue el crecimiento de la colonia de las cepas en milímetros.
Resultados y discusión
Potencial patogénico. En hojas de pepino y de calabacita, los síntomas de enfermedad fueron visibles a las 48 h después de inoculación (hdi). En hojas de pepino, los tres aislados inoculados indujeron síntomas de necrosis con arrugamiento y oscurecimiento de los tejidos afectados (Figura 1). Existieron algunas diferencias entre los tres aislados inoculados, la principal ocurrió en la hoja inoculada con la cepa 18-2F1, en la cual se observaron signos del patógeno (micelio de color blanquecino) (Figura 1B).

Figura 1 Lesión en hojas de pepino ocasionada por P. hydropathica 48 hdi. A) aislado 16-2F1; B) aislado 18-2F1; C) aislado 13-F2; D) hoja control.
En hojas de calabacita, los aislados también causaron síntomas de necrosis (Figura 2). En calabacita no existen reportes de estudios que la consideren como hospedante de P. hydropathica. En contraste, en pepino P. hydropathica se ha reportado causando damping-off en plántulas (Hong et al., 2008).
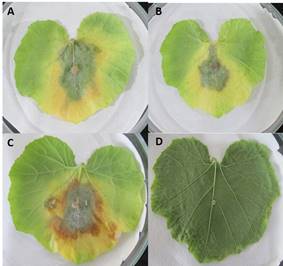
Figura 2 Síntomas en hojas de calabacita provocados por P. hydropathica 48 hdi. A. Aislado 13-F2; B. Aislado 18-2F1; C. Aislado 16-2F1. D. Hoja control.
En frutos de calabacita se presentaron síntomas de necrosis; mientras que, en tomate y pepino hubo síntomas de ablandamiento (Figuras 3, 4 y 5). La cepa 13F2 fue la más agresiva en frutos de pepino y tomate, incluso a las 72 hdi se observaron signos del patógeno (Figuras 3B y 3C) en contraste, la cepa 16-2F1 causó síntomas de necrosis apenas visibles en fruto de calabacita y síntomas de ablandamiento en tomate (Figuras 4A y 4B). La cepa 18-2F1 fue la más agresiva en frutos de calabacita (Figura 5A), en donde al igual que en frutos de tomate, a las 72 hdi se apreciaron signos del patógeno (Figura 5B), estas diferencias observadas entre los distintos aislados se pueden atribuir al diferente grado de virulencia de cada cepa.

Figura 3 Síntomas en frutos causados por P. hydropathica aislado 13-F2 72 hdi. A) calabacita; B) tomate; C) pepino.

Figura 4 Síntomas en frutos provocados por P. hydropathica aislado 16-2F1 72 hdi. A) calabacita; B) tomate; C) pepino.

Figura 5 Síntomas en frutos provocados por P. hydropathica aislado 18-2F1 72 hdi. A) calabacita; B) tomate; C) pepino.
Sensibilidad a Metalaxyl. Las 18 cepas utilizadas en el ensayo presentaron una reducción en su crecimiento al ser expuestos a 10 mg L-1 de metalaxyl en comparación al crecimiento en medio sin metalaxyl (Figura 6); no se encontraron cepas resistentes, esto significa que ningún aislado creció más de 60% en el medio adicionado con 10 mg L-1 de metalaxyl. Siete cepas presentaron una resistencia intermedia y 11 fueron susceptibles de acuerdo a los valores propuestos por Shattock, (1988) (Cuadro 1). De las 11 cepas sensibles, seis de ellas fueron totalmente inhibidas a la concentración de 10 mg L-1 de metalaxyl, estos datos son similares a los obtenidos en ensayos realizados por Riveros et al. (2003), en donde el aislado que utilizaron como control (sensible a metalaxyl) fue inhibido a la concentración de 10 mg L-1. En algunos casos se ha presentado resultados in vitro de sensibilidad en oomicetes los cuales no predicen con precisión la sensibilidad que éstos tendrán a productos químicos en condiciones in vivo (Moorman y Kim, 2004).
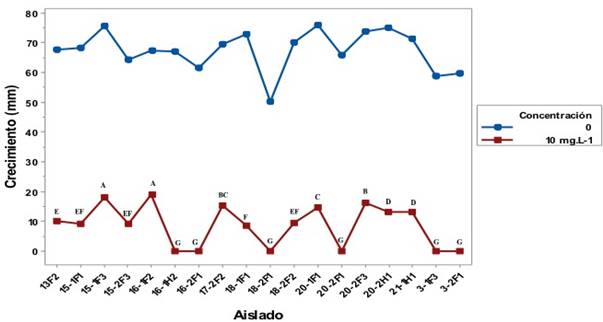
Figura 6 Crecimiento de aislados de P. hydropathica en medio de cultivo con 10 mg L-1 de metalaxyl y en medio de cultivo libre de metalaxyl después de 6 días de incubación. Letras diferentes indican diferencias significativas (Tuckey p< 0.05).
Cuadro 1 Sensibilidad y concentración efectiva de metalaxyl en aislados de P. hydropathica.
| Aislado | Tipo de resistencia | CE50 (μg L-1) | ||
|---|---|---|---|---|
| Resistente | Intermedio | Sensible | ||
| 3-1F3 | ● | <0.000013 | ||
| 3-2F1 | ● | <0.000013 | ||
| 13-F2 | ● | 0.0040 | ||
| 15-1F1 | ● | 0.0054 | ||
| 15-2F3 | ● | 0.0055 | ||
| 15-1F3 | ● | 1 | ||
| 16-1F2 | ● | 0.0034 | ||
| 16-1H2 | ● | <0.000013 | ||
| 16-2F1 | ● | <0.000013 | ||
| 17-2F2 | ● | 0.26 | ||
| 18-1F1 | ● | 0.000086 | ||
| 18-2F1 | ● | 0.017 | ||
| 18-2F2 | ● | 0.079 | ||
| 20-1F1 | ● | 0.14 | ||
| 20-2F1 | ● | 0.000013 | ||
| 20-2F3 | ● | 0.52 | ||
| 20-2H1 | ● | 0.074 | ||
| 21-1H1 | ● | 0.1 | ||
CE50= concentración efectiva a la cual el microorganismo crece 50% respecto al control. R2= 94.5%.
Por ejemplo, en P. infestans no existió una buena correlación entre los resultados obtenidos en discos de tubérculos con los resultados en medio de cultivo (Straub et al., 1979). A pesar de esto, el alto grado de sensibilidad presentado por los aislados de P. hydropathica puede deberse a que dichos aislados no han estado expuestos a este producto químico, ya que no se tienen reportes de esta especie ocasionando daños en cultivos agrícolas en la región.
Las CE50 de las 18 cepas fueron muy bajas, fluctuando en concentraciones menores a 0.000013 μg L-1 y hasta 1 μg L-1 (Cuadro 1), CE50 similares se determinaron en cepas de Phytophthora infestans consideradas sensibles a metalaxyl en donde la concentración más baja fue de 0.02 μg L-1 (Power et al., 1995), mientras que, en un estudio con la especie P. nicotianae se obtuvieron concentraciones máximas de CE50 de 0.04 μg mL-1 para aislados clasificados como sensibles (Hu et al., 2008), también se han encontrado concentraciones más altas de CE50 en aislados clasificados como sensibles, tal es el caso de las obtenidas por Paez et al. (2001) en donde determinaron concentraciones mínimas de 1 000 μg mL-1 para aislados de P. infestans.











 texto en
texto en 


