Introducción
El capulín (Prunus serotina ssp. capuli (Cav.) VcVaugh) ha sido utilizado en el país con múltiples propósitos, entre los cuales destacan: consumo de fruto en fresco, de sus semillas tostadas y forestería (Rzendowski y Calderón, 2005; Fresnedo et al., 2011). McVaugh (1951), clasificó al capulín como una de las cinco subespecies de Prunus serotina Ehnr. con base en sus caracteres morfológicos y zonas de distribución. Avendaño-Gómez (2015); Rzendowski y Calderón (2005); Rohrer (2014) afirman que los capulines son la única subespecie realmente domesticada y que su rango de distribución se extendió por influencia humana a lo que comprende el territorio americano desde el sur de Canadá, hasta el sur de Bolivia entre los 1 200 y 3 200 msnm. Segun Halarewicz et al. (2017), esta especie es ahora una potente invasora en Europa. Fresnedo et al. (2011) estudio la morfología de los capulines del centro-occidente de México y encontró una estructuración de la variación donde los capulines del centro del país parecen ser domesticados como sugiere Avendaño-Gómez (2015).
Muratalla (1984) reportó nuevas perspectivas de uso del capulín al introducir algunas variedades de cerezo dulce injertándolas en colectas de capulín provenientes de Puebla, México. De sus ensayos solo una colecta presentó compatibilidad con el cv Cristobalina de cerezo y la nombró capulín San Martín. De esta experiencia también anoto que el tipo de injerto de hendidura le dio los mejores resultados, ya sea utilizando al capulín como patrón para cerezo o utilizando al capulín como interinjerto. Al buscar un uso de los capulines en Centroamérica, Navarro et al. (1996) en Honduras probó diferentes tipos de injerto y épocas en capulines y distinguió que el injerto tipo inglés simple en octubre le producía un éxito superior a 60% de plantas injertadas.
Como lo señaló Olmstead et al. (2006); Gainza et al. (2015), la producción moderna de cerezos necesita de plantaciones en alta densidad, uso de portainjertos que controlen el vigor y aumenten la precocidad con bajos costos de manejo y económicamente viables para los productores. En la busca de un portainjerto para las nuevas variedades de cerezo de bajo requerimiento de frío, el objetivo de nuestro estudio fué de probar al capulín San Martín como portainjerto del cerezo dada su adaptación a los suelos en México y a la susceptibilidad de los portainjertos tradicionales del cerezo al cáncer (Dibotryon sp.) o tizón de fuego (Phytophtora sp.) principalmente. Lo anterior en el interés de explorar el cultivo del cerezo en el país.
Materiales y métodos
La investigación se llevó a cabo en las instalaciones del Centro Regional Universitario Centro Occidente de la Universidad Autónoma Chapingo (CRUCO) en Morelia, Michoacán. El CRUCO se localiza en la latitud 19° 52’ y la longitud 101° 02’ con una altura de 1 920 msnm.
Material vegetal
Se multiplicaron vía semilla a individuos de una colecta identificada por Muratalla (1984) como San Martín de (Prunus serotina ssp. capuli). Se establecieron 160 árboles de capulín en el campo del CRUCO a una distancia de 1 m entre árboles y 2 m entre hileras. El Cuadro 1 da cuenta de las características del capulín tipo San Martín.
Cuadro 1 Origen, ambiente e identidad taxonómica reportadas para la colecta San Martín de Prunus serotina ssp. capuli que sirvió como portainjerto.
| Clave | Población y estado | Ambiente | Identidad taxonómica reportada |
|
|---|---|---|---|---|
| Ubicación geográfica | Condiciones | |||
| Mex | Chapingo, México | 19º 29’ 58” N 98º 52’ 44” W 2 270 msnm |
C(w0) wb(i)g Colección en huerto frutícola experimental Encino |
Prunus serotina ssp. cpuli (Cav.) Mc Vaugh |
Los árboles de capulín que fueron injertados con cerezo presentaban un año de edad desde su germinación, se seleccionaron plantas que presentaran características homogéneas en cuanto a altura y diámetro presentando aproximadamente 2.5 cm de diámetro y 120 cm de altura, las plantas estaban libres de enfermedades. Se utilizó el método de injertación de hendidura simple recomendado por Muratalla (1984) y se injertaron las variedades Stella, Van, Lapin, Brooks y Bourlat en número igual de repeticiones. Por último, se ató el injerto con una cinta plástica verde de 1 cm de ancho por 20 cm de largo dejando libre la yema para su libre crecimiento (Figura 1).
Variables evaluadas
A continuación, se anotan en el Cuadro 2 las variables que se evaluaron.
Cuadro 2 Variables evaluadas en los injertos Prunus serotina capuli/Prunus avium.
| Órgano | Descriptor morfológico | Abreviación | Unidad de medición |
|---|---|---|---|
| Árbol completo | Altura de la planta | ADP | (m) |
| Tallos y ramas | Diámetro de tallo patrón Diámetro de tallo injerto 1 Diámetro de tallo injerto 2 Número de ramas |
DDTP DDTI 1 DDTI 2 NDR |
(cm) (cm) (cm) Número |
| Hojas | Número de hojas Ancho de hoja Longitud de la hoja |
NDH ADH LDH |
Número (cm) (cm) |
| Porcentaje de prendimiento | PDP | Número | |
Estimación de contenido de ADN nuclear por citometría de flujo
Aislamiento de núcleos celulares
El protocolo de aislamiento de núcleos celulares recomendado por Arumuganathan y Earle (1991) con modificaciones sirvió para analizar las hojas jóvenes de las plantas. En seguida el resumen del protocolo: colocar en una placa Petri una pequeña cantidad de tejido de la planta de estudio y del estándar de referencia empleado (aproximadamente 30 mg de cada tejido). Colocar ambos tejidos uno encima del otro para uniformizar un posible efecto de compuestos citosólicos. Anadir 1 mL del tampón (LB01, tris MgCl2, etc.) a la placa Petri.
Cortar de inmediato ambos tejidos con una cuchilla o bisturí (usar en cada muestra analizada una cuchilla nueva) en rodajas muy finas en el tampón escogido e incubar en hielo durante al menos 15 minutos. Mezclar el homogeneizado pipeteando arriba y abajo varias veces (evitar la formación de burbujas de aire). Filtrar la suspensión a través de una malla de nailon de 42 μg en un tubo de microcentrífuga. Anadir el fluorocromo (en el caso de DAPI se usa normalmente una concentración de 4 μg mL-1, mientras que en el caso de IP y EB es de 50 μg mL-1 junto con 50 μg mL-1 de RNasa), y agitar suavemente. Incubar la muestra en hielo y oscuridad antes de su análisis (de 15 min a 1 h), agitando ocasionalmente los tubos.
Análisis de citometría de flujo
Las muestras fueron analizadas en laboratorio en un citómetro de flujo acústico Attune® configuración de laser de argón azul/violeta a una intensidad de 50 mW a 450 nm/20 mW a 488 nm respectivamente (Life Techologies, San Diego CA, USA). Para esto se utilizó fluorocromo ioduro de propidio (PI Sigma - Aldrich) para teñir los núcleos vegetales aislados y se ocupo como especie de referencia tejido de Hordeum vulgare “Sultan” (5.19 pg de ADN) procedente del banco de germoplasma del Centro Internacional de Maíz y Trigo (CIMMYT)- México. Se realizaron las mediciones a cada individuo para hacer la representación de las taxas evaluadas. En cada análisis realizado se midió al menos 10 000 eventos y un volumen de muestra de 200-300 µL. El coeficiente de variación en cada análisis ha sido inferior a 5. El tamaño de genoma de cada muestra fue estimado de acuerdo con la fórmula:
ADN 2C (pg)= valor G1 muestra X= el tamaño genoma estándar (5.19 pg)/valor G1 del standard.
Resultados y discusión
El capulín P. serotina ssp. capuli y los cultivares de cerezo Stella, Van, Lapin, Brooks y Bourlat no desarrollaron una unión de injerto que pueda considerarse compatible. No existió diferencia notable entre los cultivares de cerezo, de los individuos con prendimiento, dos fueron de la variedad Stella, dos de Brooks y dos de la variedad Lapin. En la Figura 2, se verifica el porcentaje de prendimiento que se obtuvo en general para los injertos de cultivares de cerezo sobre capulín. El prendimiento fue 3.75% de la totalidad de individuos injertados.
Registro del desarrollo de los individuos
En la Figura 3 se observa el desarrollo de los individuos injertados tomando en cuenta las medias de las ocho variables medidas.
La incompatibilidad entre el capulín y el cerezo quedo de manifiesto por el número de individuos con prendimiento (6 individuos que representan 3.75% del total de individuos injertados). Esto no permitió la aplicación de pruebas inferenciales y enseguida se describe el desarrollo de las plantas sobrevivientes lo cual nos permite también tomar elementos para entender la incompatibilidad de la mayoría de plantas. Así, fue importante notar que la altura de planta (AP) presentó un desarrollo ascendente excepto en la segunda quincena de abril donde los individuos presentaron un menor crecimiento, el mismo se reanudó a partir de la primera quincena de mayo y se mantuvo hasta 5 cm por quincena. Al final el crecimiento llegó hasta 81 cm en promedio.
De igual manera el diámetro de tallo patrón(DT) presenta un desarrollo ascendente, pero en la segunda quincena de abril disminuyó. El diámetro de tallo del injerto(DTI) presentó un patrón similar llegando a un desarrollo final de 1.10 cm. En la variable número de hojas (NH) los individuos inicialmente presentaban en promedio alrededor de 7 hojas y al final del periodo llegaron a presentar en promedio 20 hojas. El ancho de hoja (AH) presentó un desarrollo generalmente en promedio de 0.5 cm en cada quincena llegando a un crecimiento final de 5.55 cm. La longitud de hoja (LH) presentó un desarrollo en sus medias generales de 2 cm cada quincena. Las ramas laterales (RL) de los individuos se podían observar a partir de la primera quincena de abril y al final del registro de los individuos, en promedio llegaron a presentar 2 ramas laterales en la segunda quincena de julio.
El registro de los diámetros de los individuos diámetro de tallo patrón (DTP) y diámetro de tallo del cerezo (DTC) en los individuos sobrevivientes describe una progresión modesta pero favorable.
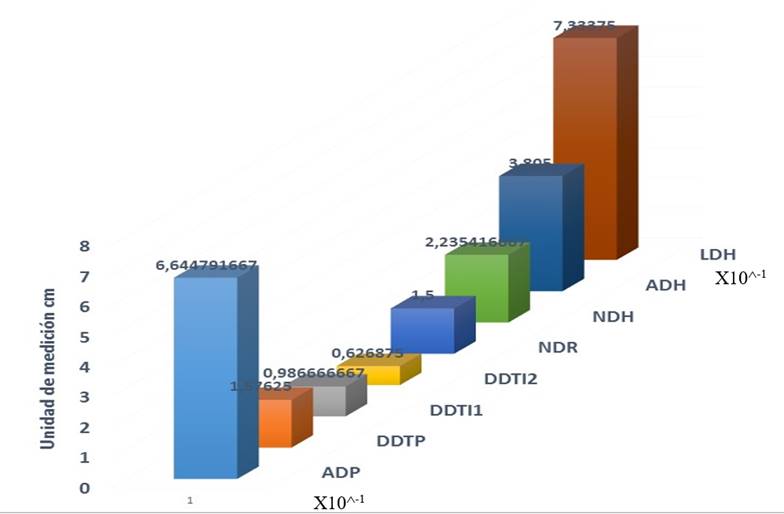
En la Figura 4 se presentan las medias de las variables evaluadas de los individuos que sobrevivieron. La figura refiere a que las variables con mayor desarrollo fueron altura de planta (AP) se llega a obtener un desarrollo superior a 66 cm x 10^-1 en su media general, número de hojas (NH) en el cual los individuos presentaron un máximo de 20 hojas en su registro x 10^-1, ancho de hoja (ADH) variable en la cual los individuos sobrevivientes llegaron a observar un desarrollo en promedio de 3.80 cm y finalmente la variable longitud de hoja (LDH) la media general obtenida por los individuos sobrevivientes presento un desarrollo de 7.33 cm.
Los resultados de este estudio coinciden con lo señalado por Gainza et al. (2015) quien reconoce a la incompatibilidad traslocalizada en Prunus como aquella que durante el primer año de injertación presenta una defoliación, decoloración de la hoja y un subsecuente no desarrollo asociada con un bloqueo de traslocación de carbohidratos principalmente.
En las diferentes especies cultivadas del género Prunus, existen escasos portainjertos de alta gama, esto debido a la incompatibilidad presente entre portainjerto e injerto impidiendo una unión funcional fuerte y duradera. La incompatibilidad en el género Prunus es muy presente en especies como la cereza, almendra, chabacano, durazno y ciruela (Gainza et al., 2015).
Usenik (2006) mencionan que los datos recientes demuestran que varias vías bioquímicas se ven afectadas durante la formación de la unión de un injerto. En Prunus es común el metabolismo de los compuestos fenólicos. Según Olmstead (2006); Gainza et al. (2014), mencionan que pequeñas cantidades de fenoles pueden ser sumamente suficientes para producir disfunciones limitantes a nivel local en la interface entre dos o más células. Mientras tanto por otra parte, los estudios que utilizan cultivos de callos de Prunus avium L. han demostrado que la podaflavina (fenol típico de las especies de Prunus) interfiere con la permeabilidad de los tejidos, lo que resulta con el daño de la membrana. En uniones de injertos incompatibles, existe movilidad de fenoles de la vacuola en el citoplasma, causando estrés que resulta en la disfunción del crecimiento, lo cual probablemente es causada por la inhibición de la vía de lignina (Kueger et al., 2012). Además, concentraciones de catequinas y proantocianidinas estos flavonoides, aumenta bajo estrés y el injerto no es excepción (Pina y Errea, 2005).
Sorce et al. (2002); Koepke y Dhingra (2013); Souza (2015) mencionan que en un trastorno complejo como la incompatibilidad existe un fondo bioquímico también complejo y dependiente de las interacciones genéticas especificas entre las células del patrón e injerto. El éxito de la unión depende primordialmente de la compatibilidad de la unión del injerto para permitir un rápido desarrollo de las conexiones vasculares entre el patrón y el injerto (Olmstead et al., 2006) permitiendo esto a su vez la rápida reanudación patrón e injerto y la regeneración vascular de los tejidos del xilema y floema de ambas partes mediante una diferenciación celular (Gainza, 2014; Souza, 2015).
Tamaños de genoma
A continuación, se presentan los histogramas obtenidos de la estimación de contenido de ADN nuclear de nuestras especies evaluadas permitiéndonos determinar el tamaño de genoma de P. avium L. y P. serotina ssp. capuli (Cav.) McVaugh. Todos los cultivares de cerezo presentaron el mismo valor.
En el ámbito genético Dickson et al. (1992) indican variaciones de ploidía en el capulín que van desde diploides hasta hexaploides. Downey e Iezzoni (2000), mencionan, que Prunus serotina es una especie tetraploide y Pairon y Jaquemond (2005) con base en un análisis con marcadores de ADN tipo microsatelites la determinó como allotetraploide. Diversos autores como Beck et al., (2014); Guzmán et al. (2018) y Pairon y Jacquemart (2005) han revelado una diversidad genética estrecha en la especie. Este es el primer estudio que determina el tamaño del genoma de P. serotina ssp. capuli que coincide con el valor de 1C= 0.5 pg que Dickson et al. (1992) reportaron para la especie P. serotina Ehrn. y con el valor de 1C= 0.35 pg que Arumuganathan y Earle (1991) reportaron para P. avium L. En la Figura 5, se observan los resultados obtenidos del análisis de citometría de flujo donde se puede ver que el cerezo dulce (P. avium L.) presenta un tamaño de genoma menor capulín San Martín (P. serotina ssp. capuli) posiblemente esta diferencia está relacionada con el bajo prendimiento del injerto.
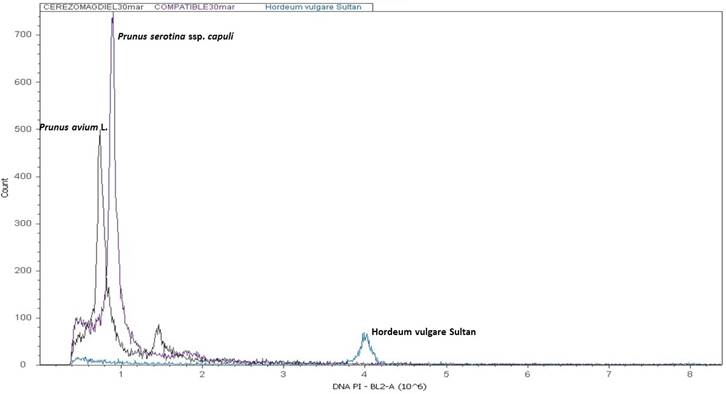
Figura 5 Histograma de la estimación del contenido de ADN por citometría de flujo del cerezo (cv Stella) y el capulín tipo San Martín.
Considerando los factores genéticos y anatómicos que afectan la compatibilidad del capulín y el cerezo, el análisis del tamaño del genoma puede ser importante para entender esta relación. Posiblemente una de las causas de la incompatibilidad del capulín como portainjerto del cerezo pueda estar asociada con los factores genéticos que se traducen en caracteres anatómicos como lo señala Souza et al. (2014) en un estudio similar en Psidium. En este estudio, las diferencias de los tamaños del genoma, puede ligarse a la dificultad de fusión e intercambio celular debido a que el tejido de cada especie continua a reproducirse por mitosis manteniendo su número propio de genoma y dosificaciones genéticas en las vías metabólicas y esto conduce a la no unión de los tejidos. Así, la técnica de citometría de flujo puede ayudar en las primeras etapas de la evaluación de la utilidad frutícola de las otras subespecies de P. serotina Ehrn.
Conclusión
Los cultivares Stella, Van, Lapin, Brooks y Bourlat de Cerezo (Prunus avium L.) presentan una incompatibilidad presumiblemente traslocalizada al ser injertados sobre el capulín (Prunus serotina ssp. capuli (Cav.) McVough) identificado como tipo San Martín. Posiblemente una de las causas de la incompatibilidad del capulín como portainjerto del cerezo pueda estar asociada con los factores genéticos que se traducen en una defoliación, decoloración de la hoja y un subsecuente no desarrollo asociada con un posible bloqueo de traslocación de carbohidratos principalmente. La determinación del tamaño de genoma por citometría de flujo puede ayudar en las primeras etapas de la evaluación de la utilidad frutícola de las otras subespecies de P. serotina Ehrn.











 texto em
texto em