Introducción
Bacillus thuringiensis es el entomopatógeno más usado en el control biológico de plagas agrícolas debido a su alta especificidad insecticida, la cual es conferida por la capacidad que tiene de formar inclusiones parasporales de naturaleza proteica, denominadas proteínas Cry (Schnepf et al., 1998). La nomenclatura de las proteínas Cry se basa en la secuencia de aminoácidos, esto permite clasificar las toxinas estrechamente relacionadas (Crickmore et al., 1998), las proteínas Cry tienen actividad insecticida contra larvas de insectos de los órdenes Lepidóptera, Díptera y Coleóptera (Burges, 1982) y en algunos casos también contra hemípteros (Torres-Quintero et al., 2015), himenópteros (van Frankenhuyzen y Tonon, 2013), ácaros (Erban et al., 2009) y nemátodos de importancia agrícola (Li et al., 2008).
Hay reportes de aislamientos de B. thuringiensis a partir de larvas de insectos enfermas o muertas a causa de patogénesis, del filoplano o de partes internas de las plantas (Monnerat et al., 2009), en este caso presenta la propiedad de utilizar B. thuringiensis contra insectos de difícil control por sus hábitos de alimentación, como chupadores o barrenadores. Por lo que existe el interés en la búsqueda de nuevos aislados, con la finalidad de encontrar cepas que presenten actividad insecticida novedosa o con mayor actividad que los aislados y cepas de referencias conocidas (Saadaoui et al., 2010). B. thuringiensis aislados a partir de suelo fueron significativamente más tóxicos contra Pieris brassicae, Ephestia kuehniella (Senfi et al., 2012), Heliothis armigera y Plutella xylostella (Xavier et al., 2007), que las cepas de referencia.
Cepas de B. thuringiensis nativas de México mostraron alta toxicidad hacia Spodoptera frugiperda al compararse con la cepa estándar comercial HD1 (Vázquez-Ramírez et al., 2015). La cepa LBIT-1200, aislada de suelo mostró mayor actividad toxicidad contra Manduca sexta y Trichoplusia ni en comparación con la cepa HD-73 (Reinoso-Pozo et al., 2016). La caracterización de aislados es importante para determinar si son variedades conocidas o determinar nuevas cepas de B. thuringiensis con características propias, al respecto, diversos reportes presentan caracterización de aislados de B. thuringiensis que incluyen la morfología del cuerpo parasporal (Azizoglu et al., 2011), la actividad insecticida (Alper et al., 2014) y la caracterización molecular (Sauka et al., 2010; Patel et al., 2012).
Recientemente se utiliza la secuenciación de los genes hag que codifican las proteínas responsables de la formación de la flagelina, que es una alternativa a la técnica por serotipificación y permite la relación entre serotipos de B. thuringiensis (Reinoso-Pozo et al., 2016). Con base en estudios previos, el objetivo de este trabajo fue aislar cepas nativas de B. thuringiensis a partir de diferentes tipos de muestras, que presenten potencial para ser usadas en el control biológico de plagas agrícolas de importancia económica en la región sureste de México.
Materiales y métodos
Aislamiento de B. thuringiensis
Se procesaron muestras obtenidas de suelo, larvas de Spodoptera frugiperda J. E. Smith (Lepidóptera: Noctuidae), larvas de Chlosyne lacinia ssp. lacinia Geyer (Lepidóptera: Nymphalidae), adultos de Aidemona azteca Saussure (Ortóptera: Acrididae), hojas de Nerium oleander L. y rastrojo de Zea mays L. Estos materiales fueron obtenidos de diferentes regiones del sureste mexicano, las muestras de suelo fueron colectadas ocho en el estado de Tabasco, ocho en Yucatán, una en Campeche y una en Quintana Roo. Respecto a los demás materiales, se obtuvieron 23 muestras de larvas de C. lacinia, dos muestras de adultos de A. azteca y cuatro muestras de hojas de N. oleander en el municipio de Conkal, seis muestras de larvas de S. frugiperda y cinco muestras de rastrojo de maíz en el municipio de Tekax, ambos en el estado de Yucatán (Cuadro 1). Para el aislamiento de bacterias a partir de suelo se pesaron 5 g de la muestra y se colocaron en un tubo Falcon de 15 mL, el cual fue aforado con agua destilada estéril hasta dicho volumen y la mezcla fue resuspendida mediante agitación vigorosa en Vortex durante 1 min. Se pasteurizó en baño María a 80 °C por 15 min y se enfrió inmediatamente en hielo.
Cuadro 1 Descripción del tipo y número de muestras colectadas, municipio y estado, características de clima y suelo.
| Muestras (numero) | Lugar de colecta | Características del clima* | Tipo de suelo* |
| Suelo (2) | Huimanguillo, Tabasco | Cálido húmedo con lluvias todo el año | Plintosol |
| Suelo (1) | Jalapa, Tabasco | Cálido húmedo con lluvias todo el año | Leptocol |
| Suelo (1) | Teapa, Tabasco | Cálido húmedo con lluvias todo el año | Luvisol |
| Suelo (1) | Cunduacán, Tabasco | Cálido húmedo con lluvias en verano | Phaeosem |
| Suelo (1) | Cárdenas, Tabasco | Cálido húmedo con lluvias en verano | Vertisol |
| Suelo (1) | Paraíso, Tabasco | Cálido húmedo con lluvias en verano | Gleysol |
| Suelo (1) | Centro, Tabasco | Cálido húmedo con lluvias en verano | Solonchak |
| Suelo (1) | Baca, Yucatán | Cálido subhúmedo con lluvias en verano | Phaeosem |
| Suelo (2) | Conkal, Yucatán | Cálido subhúmedo con lluvias en verano | Histosol |
| Suelo (1) | Dzidzantun, Yucatán | Semiseco muy cálido y cálido | Histosol |
| Suelo (1) | Acanceh, Yucatán | Cálido subhúmedo con lluvias en verano | Histosol |
| Suelo (1) | Chabihau, Yucatán | Semiseco muy cálido y cálido | Lixisol |
| Suelo (1) | Tekax, Yucatán | Cálido subhúmedo con lluvias en verano | Solonchak |
| Suelo (1) | DB, Yucatán | Semiseco muy cálido y cálido | Lixisol |
| Suelo (1) | BJ, Quintana Roo | Cálido subhúmedo con lluvias en verano | Leptosol |
| Suelo (1) | Calakmul, Campeche | Cálido subhúmedo con lluvias en verano | Phaeosem |
| Rastrojo maíz (5) | Tekax, Yucatán | Cálido subhúmedo con lluvias en verano | Solonchak |
| N. oleander (4) | Conkal, Yucatán | Cálido subhúmedo con lluvias en verano | Histosol |
| S. frugiperda (10) | Tekax, Yucatán | Cálido subhúmedo con lluvias en verano | Solonchak |
| C. lacinia (23) | Conkal, Yucatán | Cálido subhúmedo con lluvias en verano | Histosol |
| A. azteca (2) | Conkal, Yucatán | Cálido subhúmedo con lluvias en verano | Histosol |
*= INEGI (2017a, b, c, d); DB= Dzilam de Bravo; BJ= Benito Juárez.
Se tomaron 5 mL de la suspensión y se adicionó a un matraz que contenía 50 mL de caldo nutritivo (BD Bioxon®) y 0.25 M de acetato de sodio (Fermont) (para inhibir la germinación de las esporas de B. thuringiensis), se incubó durante 4 h a 200 rpm y a 29 °C. Luego se tomó 1 mL del cultivo y se diluyó en 1 mL de agua destilada estéril. Esta muestra se sometió nuevamente al proceso de pasteurización, el cual es recomendado para inactivar el crecimiento de otros microorganismos en el medio de cultivo (Travers et al., 1987). Al final del segundo proceso de pasteurización, se tomó una alícuota de 100 µL y se distribuyó uniformemente en una caja de Petri con agar nutritivo. Las cajas de Petri se incubaron a 30 °C durante 24 h para favorecer la germinación de las esporas de B. thuringiensis y el desarrollo de las colonias bacterianas.
Para el aislamiento bacteriano a partir de larvas e insectos adultos se procesaron de 3 a 5 individuos por muestra dependiendo del tamaño de éstos, la cuales fueron maceradas directamente en el tubo con ayuda de una varilla de cristal y posteriormente se aforó con agua destilada estéril hasta 15 mL, se agito vigorosamente (Aldebis et al., 1994). En el caso de los aislamientos a partir de hojas de plantas se pesaron 2 g de la muestra, se desinfectó en solución de 2% hipoclorito de sodio, durante 10 min y se aplicó doble lavado con agua destilada, la muestra se maceró finamente en un mortero y se le adicionaron 15 mL de agua destilada estéril, la solución se transfirió a un tubo Falcon de 15 mL (Monnerat et al., 2009). En ambos casos se realizó un proceso de pasteurización y se continuó con el proceso descrito para la obtención de aislados a partir de muestras de suelo.
Se seleccionaron colonias individuales de acuerdo a las características típicas reportadas para Bacillus (Sneath, 1986). Posteriormente se realizaron pruebas para verificar tinción de Gram positiva y reacción de catalasa positiva. Los aislados seleccionados se cultivaron individualmente en agar nutritivo (Bioxon®) y se conservaron a 4 °C para estudios posteriores.
Caracterización morfológica del cuerpo parasporal
La presencia y morfología parasporal de los aislados seleccionados se realizó mediante la observación directa de los cristales bajo microscopio óptico DM500 (Leica Microsystems, Suiza) (1000X), se confirmó la morfología mediante frotis directo en contraste de fases y tinción con azul de Coomassie (Sharif y Alaeddinoĝlu, 1988).
Extracción de ADN genómico
La extracción de ADN total se realizó de acuerdo al método modificado reportado por Rosso y Delécluse (1997). Se obtuvo un cultivo bacteriano de 2 mL en medio Luria-Bertani® (Invitrogen) a 28 °C con agitación constante a 250 rpm durante toda la noche, se centrifugó a 8 000 rpm por 5 min, se eliminó el sobrenadante y el paquete celular se resuspendió en 500 µL de buffer J (1.0 M TrisHCl, 0.1 M EDTA y 0.15 M NaCl, pH 8). Nuevamente se centrifugó bajo las mismas condiciones anteriores, se resuspendió paquete celular en 300 µL de buffer J conteniendo 40 mg mL de lisozima (Sigma Aldrich Química) y se incubó a 37 °C durante 1 h. Posteriormente se le adicionaron 20 µL de SDS al 10%, se homogenizó suavemente y se incubó a 70 °C por 20 min. Se adicionaron 5 µL de RNAsa (Promega) (10 mg mL), 10 µL de proteinasa K (10 mg mL) (Thermo Fisher Scientific) y se incubó a 60 °C durante 90 min.
Se adicionaron 50 µL de NaCl 5M (Baker, J. T.) y se incubó en hielo agitándolo constantemente. Se centrifugó a 13 000 rpm por 20 min, se recuperó el sobrenadante, se precipitó con el mismo volumen de isopropanol (Sigma) y se incubó a -70 °C durante 30 min. Posteriormente se centrifugó bajo las condiciones anteriores y se eliminó el sobrenadante, se lavó la pastilla con 200 µL de etanol (Fermont) al 70% y se dejó secar a temperatura ambiente, el ADN se resuspendió en 20 µL de agua destilada estéril y se conservó a -20 °C hasta su uso.
Amplificación de genes cry y hag
Para determinar la presencia de genes cry en los aislados, se realizó la amplificación por PCR con los iniciadores universales del bloque 1 (5’ TATGCWCAAGCWGCCAATYTWCATYT3’) y bloque 5 (5’ GGRATAAATTCAATTYKRTCWA 3’) (Sigma Aldrich Química) de acuerdo a Noguera e Ibarra (2010).
Se determinó la presencia del gen hag de la flagelina en los aislados nativos mediante una PCR con los iniciadores específicos Bthag-F1 (5’-AGTACATGCGCCAAAACCAAG) y Bthag-R1 (5’-GTTTGCTTGAGAAAGCATGCT) (Sigma Aldrich Química) de acuerdo a Xu y Coté (2006). Los productos de PCR fueron verificado por medio de electroforesis en gel de agarosa (Invitrogen) al 0.8%, y visualizado en un fotodocumentador Biorad Molecular Imager Gel Doc XR (Bio-Rad®).
Perfil de proteínas
Se obtuvo el perfil de proteínas mediante electroforesis en SDS-PAGE del complejo espora-cristal de los aislados de acuerdo a la metodología reportada (Laemmli 1970). Para lo cual, se inoculó cada aislado en 5 mL de medio LB y se incubó en un agitador orbital a 30 °C con 200 rpm durante 72 h. El complejo espora-cristal se centrifugó a 10 000 rpm durante 10 min y se lavó con agua destilada estéril, esta operación se repitió tres veces. Se recuperó la pastilla y se conservó a 4 °C. Se preparó una mezcla con 5 µL de buffer de carga con 5% de β-mercaptoetanol (Sigma Aldrich Química), 3 µL de muestra del complejo espora-cristal y 2 µL de agua, se incubó a 95 °C durante 10 min.
Para la electroforesis se preparó un gel separador al 12% y el compactador al 4% de poliacrilamida (Sigma Aldrich Química), los componentes utilizados fueron poliacrilamida al 30%, buffer Tris-HCL pH 8.8 (Sigma Aldrich Química), buffer Tris-HCL pH 6.8, SDS al 10%, agua destilada estéril, TEMED (Invitrogen®) y persulfato de amonio (Sigma Aldrich Química) al 10%, se preparó un volumen de 5 mL para cada gel y las concentraciones fueron calculadas de acuerdo a las instrucciones en el manual del fabricante. Se realizó la electroforesis en una cámara de electroforesis vertical modular Enduro™ (Bio-Rad), se utilizó el marcador de peso molecular de proteínas Page RulerTM Plus Prestained Protein Ladder (Bio-Rad®).
La electroforesis se realizó en dos fases, la de compactación a 40 V y 100 A durante 1 h y la fase de separación se llevó a cabo a 90 V y 100 A durante 3 h. Posteriormente el gel fue teñido con una solución de colorante azul de Coomassie G-250 al 0.1% durante 1 h y se destiñó en metanol/ácido acético. Se estimó el peso molecular de las bandas de proteínas presentes en cada muestra según el marcador de peso molecular utilizado. Los perfiles de proteínas observados fueron comparados con el perfil de la cepa de referencia B. thuringiensis subsp. kurstaki HD1.
Detección de actividad insecticida
Se realizó un ensayo preliminar a una alta concentración con los aislados obtenidos para determinar la actividad insecticida contra Manduca sexta, ya que diversos estudios reportan dosis letales bajas para diversos insectos lepidópteros que van desde 1 a 164 ng cm-2 (Uribe et al., 2003; Sharma et al., 2010). Se obtuvo el liofilizado del complejo espora-cristal en una liofilizadora Labconco Lyph-Lock 4.5 (Labconco®), se utilizó una concentración final de 10 µg cm-2. Se pesó la muestra y se diluyó en 200 µL de Tween 80 (Sigma Aldrich Química) (0.02%), se adicionó a la caja de Petri con la dieta artificial (Yamamoto, 1969) para el insecto y se distribuyó uniformemente en toda la superficie de la dieta, se dejó secar la superficie durante 45 min y se colocaron 20 larvas neonatas para cada aislado con dos repeticiones y se registró la mortalidad a las 96 h, como control negativo se utilizó 0.02% de Tween 80.
Resultados y discusión
Aislamiento de B. thuringiensis
Se procesaron 62 muestras representativas de diversos materiales colectados, entre los cuales se incluyó 18 muestras de suelo, 10 de Spodoptera frigiperda, 23 de Chlosyne lacinia ssp. lacinia, dos de Aidemona azteca, cuatro de hojas de Nerium oleander y cinco muestras de rastrojo de Zea mays. Se seleccionaron en total 210 colonias, de las cuales sólo en 27 se observó la presencia de estructuras en los esporangios, entre las cuales se observaron cuerpos esféricos, amorfos, bipiramidales, cúbicos, ovoides y algunos adheridos a las esporas. La prueba de tinción con azul de Coomassie (Figura 1) permitió confirmar sólo en tres aislados la presencia de cristales parasporales, los cuales fueron designados con las claves ITCBT34, ITCBT61 e ITCBT62 (Cuadro 2). Estos aislados seleccionados fueron utilizados en las pruebas posteriores.

Figura 1 Morfología del cuerpo parasporal mediante tinción con azul de Coomassie. A= ITCBT34. B= ITCBT61. C= ITCBT62; b) célula vegetativa; c) cristal parasporal; y e) espora.
Cuadro 2 Características de los aislados nativos de Bacillus thuringiensis.
| Aislado | Hábitat | Lugar de colecta | Localización del sitio (GPS) | Morfología parasporal | Genes cry | Genes hag |
| ITCBT34 | Suelo | Huimanguillo, Tabasco | 17°53’26.31”, 93°26’32.48” | Ovoide | + | + |
| ITCBT61 | Chlosyne lacinia ssp. lacinia. | Conkal, Yucatán | 21°4’45.85” 89°29’59.46” | Bipiramidal | + | + |
| ITCBT62 | Chlosyne lacinia ssp. lacinia. | Conkal, Yucatán | 21° 4’16.55” 89°30’24.16” | Bipiramidal | + | + |
Estudios previos han reportado la obtención de aislados nativos de B. thuringiensis a partir de hábitats como suelo (Adbullah et al., 2014), plantas (Alper et al., 2014) e insectos (Alquisira-Ramírez et al., 2014). En esta diversidad de ambientes es posible encontrar aislados que presentan cristales bipiramidales, esféricos, cúbicos (Cicero et al., 2009, Azizoglu et al., 2011) e irregularres (Assaeedi et al., 2011). En relación al sureste de México, hay reportes de aislamientos de B. thuringiensis sólo a partir de suelos en los estados de Tabasco (Bravo et al., 1998) y Yucatán (Ornelas-Pérez et al., 2016).
En el presente trabajo los aislados seleccionados que fueron confirmados como B. thuringiensis presentaron cristales ovales, muestra obtenida de suelo, y bipiramidales de muestras de larvas de Chlosyne lacinia (Cuadro 2). El índice de aislamiento de B. thuringiensis obtenido fue de 0.11. Este resultado se encuentra dentro de los valores reportados previamente, ya que es posible encontrar reportes con índices de 0.04 a 1 (Rosas-García et al., 2008; Alper et al., 2014).
Amplificación de genes cry
Los tres aislados mostraron la presencia de genes cry, presentaron bandas de amplificación con tamaños aproximados de 1400 pb (ITCBT61), 1500 pb (ITCBT62), 1650 pb (ITCBT34) y 1300 pb en la cepa de referencia (HD1) (Figura 2a). El uso de iniciadores universales es común para determinar la presencia de genes cry (Patel et al., 2012; Reinoso-Pozo et al., 2016). De acuerdo a la morfología bipiramidal de los cristales parasporales de los aislados ITCBT61 e ITCBT62, es probable que las bandas de amplificación estén correlacionadas con genes tipo cry1 y cry2, los cuales codifican proteínas tóxicas principalmente hacia larvas de Lepidópteras (Sun et al., 2007; Sauka y Benintende, 2008). Por otro lado, el fragmento amplificado en el aislado ITCBT34 muestra un tamaño de banda diferentes (Figura 2a), por lo que podría tratarse de otro tipo de gen cry.
Determinación de genes hag
Los tres aislados presentaron productos de amplificación del gen hag por PCR (Figura 2b). Los aislados ITCBT61 e ITCBT62 presentaron una banda de tamaño aproximado de 700 pb, similar a la banda que mostró la cepa de referencia HD1. El aislado ITCBT34 presentó una banda de tamaño diferente de aproximadamente 1000 pb. Los fragmentos amplificados de los genes hag reportados en B. thuringiensis muestran polimorfismo con bandas con tamaños de 700 bp hasta 1.9 kb (Xu y Coté, 2006). El tamaño del fragmento del gen hag del aislado ITCBT34 refuerza que se trata de una aislado diferentes a los otros dos (ITCBT61 e ITCBT62) y a la cepa de referencia HD1. La determinación de la presencia de los genes de la flagelina es un método que está adquiriendo uso como alternativa a la serotipificación en B. thuringiensis (Hendriksen y Hansen, 2006: Reinoso-Pozo et al., 2016).
Perfil de proteínas
Mediante el análisis del SDS-PAGE se determinó el perfil de proteínas de los tres aislados en estudio. Los perfiles observados fueron diferentes entre los aislados y únicamente el aislado ITCBT61 coincidió con el perfil de la cepa de referencia HD1. En el caso del aislado ITCBT62, se observó la presencia de una banda de 45 kDa y la ausencia de una banda de 130 kDa que está presente en el aislado ITCBT61 y la cepa HD1, el ITCBT34 presentó un perfil de bandas diferentes de 100, 85, 70 y 50 kDa (Figura 3).
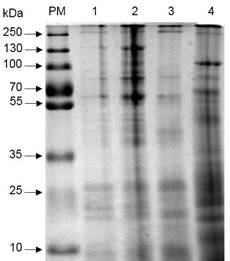
Figura 3 SDS-PAGE del perfil de proteínas presentado por los aislados nativos de B. thuringiensis. PM= marcador de peso molecular PageRuler™ Plus Prestained Protein Ladder (Thermo Scientific), carril 1: HD1, carril 2: ITCBT61, carril 3: ITCBT62, carril 4= ITCBT34.
Se reportan principalmente bandas de 130 y 65 kDa para la cepa HD1, las cuales son producto de proteínas codificadas por los genes cry1 y cry2 (Alper et al., 2014), por lo que las bandas de 130 y 65 kDa de peso molecular que presentaron los aislados nativos, pueden pertenecer al grupo de las proteínas Cry1 y Cry2. El perfil de proteínas que se ha observado en otros trabajos varía, pero el rango de peso molecular de las bandas es de 130 a 44 kDa (Silva et al., 2010; Barathi et al., 2012). Estudios previos han reportado la presencia de proteínas de tamaños similares a los obtenidos en el presente trabajo, las cuales mostraron toxicidad principalmente contra plagas del orden Lepidoptera (Valicente et al., 2010; Li y Bouwer, 2012).
Actividad insecticida
La prueba de actividad insecticida se realizó con una concentración de 10 µg cm-2, los tres aislados presentaron actividad insecticida contra larvas de Manduca sexta. A las 96 h se observó 100% de mortalidad de larvas (Cuadro 3). Las larvas expuestas a los aislados presentaron síntomas de necrosamiento general y licuado interno, características típicas de la toxicidad causado por las proteínas Cry de B. thuringiensis (Silva et al., 2010) (Figura 4).
Cuadro 3 Bioensayo cualitativo de actividad insecticida de los aislados nativos de Bacillus thuringiensis contra Manduca sexta a las 96 h, con una concentración de 10 µg cm-2.
| Aislado | Promedio * | Mortalidad (%) |
| ITCBT34 | 20 | 100 ±0 |
| ITCBT61 | 20 | 100 ±0 |
| ITCBT62 | 20 | 100 ±0 |
| Testigo ** | 20 | 0 ±0 |
*= Promedio del número de larvas muertas de dos repeticiones, con 20 larvas cada una. **= Tween 80 (0.02 %).

Figura 4 Ensayo cualitativo de aislados nativos de B. thuringiensis contra larvas neonatas de Manduca sexta a una concentración de 10 µgcm-2. A) testigo negativo (Tween 80), B)= ITCBT34, C)= ITCBT61 y D)= ITCBT62.
La actividad observada en los aislados ITCBT61 e ITCBT62 responde a lo esperado, ya que ambos aislados presentan morfología parasporal bipiramidal y perfil de proteínas típica de las proteínas Cry1 y Cry2, las cuales tienen actividad insecticida contra larvas de Lepidóptera. El aislado ITCBT34 también tuvo actividad hacia estas larvas. Este resultado no es común, ya que este aislado presentó morfología del cuerpo parasporal y perfil de proteínas muy diferente al tipo de proteínas que actúan sobre larvas de Lepidóptera. Dicha actividad puede estar relacionada a la presencia de genes tipo cry2, los cuales fueron reportados en aislados de B. thuringiensis con cristales de morfología únicamente oval (Arrieta y Espinoza, 2006). La presencia de genes cry1 y cry2 y la actividad contra larvas de Lepidóptera es característico de B. thuringiensis, y es reportado con frecuencia en trabajos sobre búsqueda y caracterización de aislados nativos. En esos trabajos se utilizaron diversas especies de Lepidóptera como Cadra cautella y Thaumetopoea wilkinsoni (Yilmaz et al., 2013), Spodoptera littoralis (Assaeedi et al., 2011), Heliothis armígera y Plutella xylostella (Xavier et al., 2007) e incluso contra larvas de Coleóptera como Carpophilus hemipterus (Alper et al., 2014).
Conclusiones
En general se observó similitud en las pruebas entre los aislados nativos del presente trabajo y la cepa de referencia B. thuringiensis svar. kurstaki HD1, como morfología bipiramidal y tamaño en la amplificación de los genes hag en los aislados ITCBT61 e ITCBT62, además del perfil de proteínas y amplificación de genes cry en el aislado ITCBT61. Esto muestra que los aislados ITCBT61 e ITCBT62 están altamente relacionados con la cepa B. thuringiensis svar. kurstaki HD1. Respecto al aislado ITCBT34, en los resultados de todas las pruebas realizadas no se observó ninguna similitud con la cepa HD1, indicando con ello que este aislado pertenece a una variedad diferente. Finalmente, el resultado de la prueba de toxicidad muestra que los tres aislamientos presentan potencial para el control de plagas del orden Lepidópteros.











 texto em
texto em 



