Introducción
La revolución verde surgió en la década de 1940, durante la cual se lograron importantes incrementos en el rendimiento de los cultivos, usando una combinación de variedades mejoradas, cantidades elevadas de fertilizantes y pesticidas, así como sistemas de riego (Ahrens et al., 2008, Duchemin et al., 2015). Este proceso se inició en el Valle del Yaqui, región agrícola con aproximadamente 225 000 hectáreas de campos irrigados ubicada en el estado de Sonora, entre las montañas de la Sierra Madre y el Golfo de California.
El clima en el Valle del Yaqui es semiárido, con tasas de precipitación variables con un promedio de 317 mm por año y una temperatura promedio en el ciclo otoño-invierno de 21 °C y de 30 °C en el ciclo primavera-verano (Luers et al., 2003). Los principales cultivos producidos son trigo (173 495 ha), soya (48 695 ha), maíz (21 082), cártamo (17 923) y sorgo (10 327) (SIAP, 2016). Al igual que muchas otras regiones agrícolas pos revolución verde en el mundo, el Valle del Yaqui tiene que afrontar los impactos del uso intensivo de fertilizantes, la creciente competencia por el agua en otros sectores, las condiciones económicas y políticas actuales (McCullough y Matson, 2016).
Por otra parte, además del uso excesivo de agroquímicos, el manejo agronómico (principalmente el uso intensivo de maquinaria agrícola, y la poca o nula cobertura vegetal) ha generado suelos con bajo contenido de materia orgánica (< 1.5%), altos niveles de erosión por eventos eólicos debido a su clima seco (> 200 t ha-1 año-1), suelos salinos o alcalinos, y con baja eficiencia de aprovechamiento de los fertilizantes aplicados (Ibarra-Villareal et al., 2016). Por lo cual son necesarias nuevas tecnologías que estén orientadas a mantener la sostenibilidad del sistema agrícola mediante explotación racional de los recursos naturales y la aplicación de medidas adecuadas para preservar el ambiente (Shankar Singh et al., 2011).
Una de estas tecnologías es la aplicación de biofertilizantes a base de microorganismos promotores del crecimiento vegetal (MPCV), los cuales tienen efectos benéficos sobre el crecimiento y salud de plantas (Nihorimbere et al., 2011). Los MPCV pueden facilitar el crecimiento y desarrollo de las plantas por medio de mecanismos directos e indirectos. La estimulación directa puede involucrar el suministro de sustancias sintetizadas por la propia bacteria y la ayuda para la toma de nutrientes del ambiente, los cuales pueden ser nitrógeno, fitohormonas, hierro y fósforo (Verma et al., 2010), mientras que la estimulación indirecta incluye la prevención o eliminación de fitopatógenos por la producción de sustancias inhibitorias o por el incremento de la resistencia de la planta (Saleem et al., 2007). Es muy común que un solo MPCV muestre más de un modo de acción, así como también es común que en la rizósfera, los MCV que tienen un solo modo de acción actúen sinérgicamente para estimular el crecimiento de la planta hospedera (Vessey, 2003).
A diferencia de los efectos adversos del continuo uso de fertilizantes químicos, cuando los MPCV son aplicados al suelo mejoran su estructura sin dejar residuos tóxicos. De esta manera, los inoculantes microbianos o biofertilizantes son un componente importante en la agricultura sustentable (Shankar Singh et al., 2011). Sin embargo, problemas de variabilidad en la eficiencia de colonización, desempeño en el campo y competencia en la rizósfera pueden ser temas controversiales. Esta variabilidad depende considerablemente de los microorganismos, tipo de suelo, especies de plantas, y condiciones ambientales. Por ello, para el uso de MPCV como biofertilizantes se requiere la identificación y selección de microorganismos competentes en la rizósfera con atributos de promoción de crecimiento (Armenta-Bojórquez et al., 2010; Babalola, 2010).
El objetivo del presente trabajo fue caracterizar metabólicamente la microbiota edáfica asociada al cultivo de maíz en el Valle del Yaqui, con la finalidad de identificar microorganismos nativos con potencial agrobiotecnológico.
Materiales y métodos
Muestreo de suelo y asilamiento de microorganismos
Se muestreo suelo en cinco sitios (27° 25’ 38.3” latitud norte 110° 06’ 27.8” longitud oeste, 27° 22’ 30.3” latitud norte 109° 55’ 56.4” longitud oeste, 27° 19’ 29.7” latitud norte 110° 10’ 18.2” longitud oeste, 27° 15’ 43.7” latitud norte 110° 01’ 06.1” longitud oeste, 27° 08’ 50.4” latitud norte 109° 53’ 39.5” longitud oeste) donde se cultiva maíz en el Valle del Yaqui, Sonora (Figura 1). En cada sitio se colectó una muestra compuesta de 10 kg de suelo para el análisis microbiológico. El aislamiento de los microorganismos se realizó mediante la técnica de diluciones seriales en medios de cultivos enriquecidos, agar nutritivo suplementado con 80 µg ml-1 de cicloheximida para aislamiento de bacterias y agar papa dextrosa suplementado con 80 µg ml-1 de carbenicilina el aislamiento de hongos y actinomicetos. Los cultivos fueron incubados a 28 ±2° C durante 7 días, determinando a las 72 h las unidades formadoras de colonias (UFC) por gramo de peso seco de suelo (gss). Los aislamientos se realizaron por triplicado (de los Santos-Villalobos et al., 2013).
Caracterización metabólica de los aislados obtenidos
Producción de índoles. Se inocularon 1×105 UFC de cada aislado en 100 ml de caldo nutritivo suplementado con 100 ppm de triptófano. Estos cultivos fueron incubados a 28 °C durante 3 días a 100 rpm. Después, 1 ml de cultivo se centrifugó a 13 000 rpm por 3 min, al sobrenadante obtenido se le agregaron 2 ml de reactivo de Salkowski. Dicha reacción fue incubada en oscuridad durante 20 min a temperatura ambiente (Glickmann y Dessaux, 1995). La cuantificación de índoles se determinó a 540 nm en un espectrofotómetro. Este ensayo se llevó a cabo con tres réplicas independientes.
Producción de sideróforos. La técnica del cromo azurol S (CAS agar) reportada por Schwyn y Neilands (1987) fue utilizada para determinar la producción de sideróforos por las cepas en estudio. Cada aislado fue inoculado en el centro de una caja Petri conteniendo el medio de cultivo CAS y se incubaron a 28 ±2 °C durante 7 días. La capacidad para producir sideróforos es representada por un halo transparente alrededor del microorganismo, se determinó la eficiencia de producción (EP), relacionado las medidas de los diámetros de el halo (DH) y la colonia (DC), EP= (DH-DC/DC)*100. Los experimentos de producción de sideróforos se llevarán a cabo por duplicado.
Solubilización de fosfatos. La capacidad de los microorganismos aislados para solubilizar fosfato fue determinada utilizando el medio PVK (Pikovskaya, 1948) el cual contiene fosfato tricálcico insoluble. Dicho medio fue suplementado con azul de bromofenol para facilitar la observación de los halos de solubilización. Cada aislado se inoculo en el centro de una caja Petri con medio PVK y se incubaron a 28 ±2 °C durante 7 días (Nautiyal, 1999). Se determinó la eficiencia de solubilización (ES), relacionado las medidas de los diámetros de el halo (DH) y la colonia (DC), ES= (DH-DC/DC)*100. Estos ensayos se realizaron por duplicado.
Actividad ACC (1-aminociclopropano-1-carboxilato) desaminasa. La actividad de ACC desaminasa se determinó de acuerdo a Penrose y Glick (2003). Para ello se preparó un pre-inoculo de cada microorganismo en caldo con sales mínimas DF (Dworkin y Foster). Posteriormente, el cultivo se sembró en cajas Petri adicionadas con ACC (3 mM). Las placas se incubaron a 30 °C durante 3 días. Como control la misma cepa se creció en medio mínimo DF con presencia de fuente de nitrógeno (NH4)2SO4, la capacidad de una cepa para utilizar ACC se determinó si esta presentó crecimiento en medio DF con AA como única fuente de nitrógeno. Estos experimentos se realizaron con tres réplicas independientes.
Actividad hemolítica. Se determinó de acuerdo a la técnica seguida por Figueroa et al., 2016, con modificaciones. Los microorganismos se sembraron en agar nutritivo y se incubaron a 28 °C por 24 h y posteriormente se transfirieron a cajas con agar sangre, donde se sembraron por picadura. Por último, las cajas se incubaron a 28 °C por 24 h para monitorear la apariencia de la actividad hemolítica, clasificándose como alpha hemolíticas (hemolisis parcial), betta hemolíticas (hemolisis completa) y gamma hemolíticas (sin actividad hemolítica). Las evaluaciones se hicieron por duplicado.
Ensayos de promoción de crecimiento vegetal en maíz
Se seleccionaron cepas bacterianas promisorias en base a sus características metabólicas y se realizaron ensayos de promoción de crecimiento vegetal con plantas de maíz en invernadero. Las semillas de maíz fueron inoculadas al momento de sembrarse con 1×106 UFC g-1 de sustrato de cada una de las cepas seleccionadas y en consorcio, los ensayos se realizaron en macetas de 2.5 L una mezcla formada por dos partes de suelo agrícola del Valle del Yaqui (textura arcillosa), una parte de turba y una parte de perlita. Las características fisiológicas (altura, diámetro del tallo, peso fresco aéreo y peso fresco de raíz, biomasa total, número de hojas) fueron cuantificadas a las 6 semanas después de la siembra (Parra-Cota et al., 2014).
Se realizaron dos ensayos en distintas épocas del año: En el primer ensayo (verano) se evaluaron 6 cepas aisladas del Valle del Yaqui (11B20, 13B41, 52B4, 22A67, 53A2 y 22B45) mientras que en el segundo ensayo (otoño) se evaluaron cuatro cepas (53A2, 52B4, 13B41, 41B1). En ambos ensayos se utilizaron semillas del híbrido H-431 (Ortega et al., 1993), que se destaca por su resistencia a enfermedades, altas temperaturas, adaptación a diferentes fechas y áreas ecológicas de siembra entre otros factores.
Análisis estadístico
Se empleó un diseño completamente al azar con 5 o 7 tratamientos incluidos el testigo (plantas no inoculadas) dependiendo del número de cepas a evaluar en cada experimento. Consistiendo cada unidad experimental de cinco plantas, se realizaron dos repeticiones por tratamiento. Todos los análisis estadísticos de los datos fisiológicos fueron realizados usando el programa estadístico JMP8 (SAS Institute Inc., Cary, NC). Los datos fueron analizados mediante análisis de varianza (Anova) y prueba Tukey con un nivel de α= 0.05. En todas las figuras se muestran los valores promedios y las barras verticales representan desviación entandar.
Resultados y discusión
A partir de las muestras de suelo se determinó la población total cultivable en cada sitio. El sitio E, localizado al sur del Valle (Figura 1), presentó mayor población mientras que el sitio C presentó la menor población, con 6×106 UFC gss-1 y 1.9×106 UFC gss-1, respectivamente (Figura 2). Posteriormente, al realizar el aislamiento de los microorganismos, se encontró que no existe una relación directa entre la población y el número de aislamientos, ya que todos los sitios a excepción del sitio D, presentaron un número muy similar de microorganismos aislados (Cuadro 1). Se aislaron un total de 216 microorganismos en los cinco sitios.
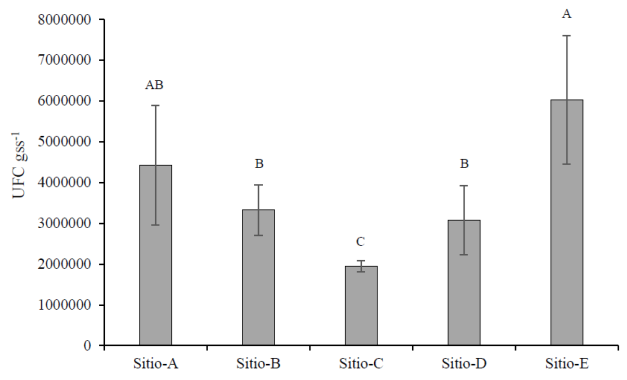
Figura 2 Población de microorganismos por sitio en el Valle del Yaqui. Letras diferentes indican diferencias estadísticamente significativas (α= 0.05).
Cuadro 1 Microorganismos aislados en cada sitio muestreado en el Valle del Yaqui.
| Sitio | Bacterias | Actinomicetos | Hongos | Total |
| A | 25 | 14 | 9 | 48 |
| B | 24 | 20 | 1 | 45 |
| C | 17 | 28 | 0 | 45 |
| D | 16 | 3 | 4 | 23 |
| E | 11 | 44 | 0 | 55 |
| Total | 93 | 109 | 14 | 216 |
En base a sus características micro y macroscópicas, los aislados se clasificaron en bacterias (proteobacterias y firmicutes), actinomicetos y hongos. El número de aislados bacterianos y actinomicetos fue mayor que los aislados fúngicos, lo cual puede ser un indicativo de las condiciones edafoclimáticas de los sitios de muestreo, debido a que los suelos del Valle del Yaqui tienen por lo general un contenido de materia orgánica menor al 1.5% (Lobell et al., 2002), además de que se muestreo durante el mes de julio, cuando las temperaturas son muy elevadas (22-41 °C) disminuyendo la humedad del suelo.
Caracterización metabólica
Para caracterizar metabólicamente los microorganismos aislados se determinó la capacidad de sintetizar índoles, solubilizar fosfatos y producir sideróforos.
En los ensayos para determinar la producción de índoles se encontró que 207 aislados (96%) tuvieron la capacidad de producir índoles, 80% de las cepas tuvo una producción de 1 a 4 ppm, mientras que cinco cepas tuvieron una producción mayor a 6 ppm, siendo la cepa bacteriana 22B45 la principal productora con una síntesis de 11.47 ppm (Figura 3A, Cuadro 2). Arruda et al. (2013) realizaron el aislamiento y caracterización de 292 bacterias de la rizósfera de maíz, encontrando también que un alto porcentaje (98%) de sus aislados tenía la capacidad de sintetizar índoles. Se ha reportado que las auxinas producidas por bacterias aumentan el área y la longitud de la superficie de la raíz y por lo tanto, proporciona a la planta un mayor acceso a los nutrientes del suelo (Glick, 2012).

Figura 3 Capacidades metabólicas de los microorganismos aislados; a) síntesis de índoles; b) producción de sideróforos; y c) solubilización de fosfatos.
Cuadro 2 Microorganismos con las mejores capacidades metabólicas evaluadas.
| ID CEPA | Microorganismo | Índoles (ppm) | Sideróforos (IEP) | Fosfatos (IES) |
| 22B45 | Bacteria | 11.47 | 28.6 | 42.9 |
| 23A300 | Actinomiceto | 8.54 | 20.5 | 0 |
| 43B3 | Actinomiceto | 7.86 | 38.8 | 30.5 |
| 11B20 | Actinomiceto | 7.05 | 37.5 | 0 |
| 51B3 | Actinomiceto | 6.25 | 24.3 | 29.9 |
| 43B1 | Actinomiceto | 5.88 | 39.3 | 15.6 |
| 23A800 | Actinomiceto | 5.47 | 20 | 29.2 |
| 13B400 | Actinomiceto | 5.42 | 108.3 | 47.2 |
| 53A2 | Bacteria | 2.52 | 333.3 | 0 |
| 31B5 | Bacteria | 2.7 | 300 | 0 |
| 22A50 | Hongo | 3.64 | 190 | 0 |
| 11B800 | Actinomiceto | 2.12 | 161.1 | 18.2 |
| 12A5 | Actinomiceto | 3.95 | 158.3 | 0 |
| 52B4 | Bacteria | 3.33 | 150 | 0 |
| 42A8 | Actinomiceto | 2.44 | 150 | 0 |
| 43A2 | Actinomiceto | 3.44 | 123.8 | 58.3 |
| 53A7 | Actinomiceto | 2.16 | 8.7 | 105.4 |
| 11B700 | Actinomiceto | 5.1 | 95 | 66 |
| 11B20 | Bacteria | 3.06 | 25 | 60 |
| 12B2 | Actinomiceto | 2.65 | 100 | 58.3 |
| 22A67 | Bacteria | 2.88 | 40 | 58.3 |
| 51A4 | Actinomiceto | 4.02 | 12.5 | 57.5 |
| 41B3 | Actinomiceto | 2.72 | 0 | 125 |
Respecto a la determinación de cepas con la capacidad de producir sideróforos, moléculas de alta afinidad al hierro, 22% de las cepas carece de esta característica. Aproximadamente 100 cepas tuvieron una eficiencia menor a 50, identificando 10 cepas con una eficiencia mayor a 100, la cepa bacteriana 53A2 presentó la eficiencia más alta con 333.3 (Figura 3B, Cuadro 2). Sharma y Johri reportaron en 2003 que dos cepas de Pseudomonas productoras de sideróforos tenían la capacidad para promover el crecimiento de platas de maíz bajo condiciones limitantes de hierro. Las bacterias que sintetizan sideróforos también pueden actuar como agentes de control biológico, De los santos et al. (2013) realizaron un estudio donde se encontró que por medio de la producción de sideróforos, Burkholderia cepacia XXVI podía inhibir el crecimiento del patógeno Colletotrichum gloeosporioides.
Posteriormente se determinó la capacidad de solubilizar fosfatos por cada uno de los microorganismos aislados. Esta característica fue la más particular, ya que solamente 67 aislados la presentaron, la mayoría con eficiencias bajas, solo en 3 microorganismos se determinó una eficiencia de solubilización mayor a 50.
El actinomiceto 53A4 presentó la eficiencia más alta (105.4). Ningún aislado fúngico resultó positivo para esta característica (Figura 3C, Cuadro 2). Las eficiencias de solubilización de los aislados estudiados son bajas, pero las eficiencias máximas coinciden con las obtenidas en otros estudios (Kannapiran y Ramkumar, 2011). Se ha reportado que, en maíz de grano, es posible reducir la tasa de fertilizante fosforado en 50% sin reducir el rendimiento, si las plantas se inoculan con los microorganismos solubilizadores de fosfato apropiados (Antoun, 2012).
Un total de 54 aislados presentaron las tres características evaluadas, 163 aislados fueron capaces de producir sideróforos e índoles, 65 sintetizaron índoles y solubilizaron fosfatos, mientras que 55 aislados fueron capaces de sintetizar sideróforos y solubilizar fosfatos, a diferencia de otros estudios (Arruda et al., 2013) donde no han encontrado o ha sido limitado el número de cepas con ambas capacidades. Se ha demostrado en diversos estudios el potencial de los microorganismos solubilizantes de fósforo y con síntesis de simultánea de metabolitos supresores de patógenos, principalmente sideróforos, fitohormonas y enzimas líticas (Vassilev et al., 2006)
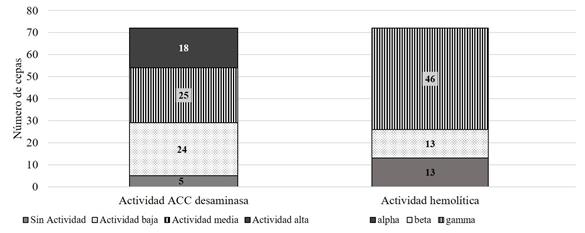
Posteriormente, se seleccionaron las cepas con mejores resultados en cada una de las determinaciones, seleccionando un total de 76 cepas de bacterias y actinomicetos, las cuales fueron analizadas para determinar cualitativamente su actividad ACC desaminasa y actividad hemolítica. Se encontró que 96% de los microorganismos analizados tienen actividad de ACC desaminasa, identificando 18 cepas con alta actividad (Figura 4). La presencia de actividad ACC desaminasa es un indicativo del potencial de la cepa para ayudar a las plantas a mitigar los efectos de ciertas condiciones de estrés, ya que elimina el ACC, precursor de la síntesis de etileno y reduce el efecto tóxico que tiene esta hormona en altas concentraciones en las plantas (Glick, 2007).
Por último, se determinó la capacidad hemolítica de los microorganismos, lo cual nos permite identificar aislados potencialmente patógenos (Forbes et al., 2007). El 64% de las cepas tiene actividad gamma hemolítica mientras que solamente 18% posee actividad beta hemolítica (Figura 4). El porcentaje de aislados beta hemolíticos fue bajo, no debe descartarse por completo su uso ya que se pueden utilizar sus productos o metabolitos sin aplicar el microorganismo directamente en campo.
Promoción de crecimiento vegetal
Para evaluar la capacidad de promoción de crecimiento de los microorganismos aislados se realizaron ensayos con plantas de maíz bajo condiciones de invernadero. Se seleccionaron siete cepas bacterianas, cinco de ellas (22B45, 11B20, 53A2, 52B4, 22A67) en base exclusivamente a sus resultados en las determinaciones metabólicas, mientras que las dos cepas restantes (13B41 y 41B1) se seleccionaron además por su tolerancia a condiciones de estrés abiótico como altas temperaturas, sequía y salinidad. El primer ensayo se realizó en verano (junio-julio), los resultados obtenidos en cada tratamiento se muestran en el Cuadro 3.
Cuadro 3 Efecto de la inoculación de bacterias edáficas nativas en plantas de maíz en verano.
| Cepas | Peso seco aéreo (g) | Peso seco raíz (g) | Altura (cm) | Diámetro del tallo (mm) | Número de hojas |
| 53A2 | 9.5 a | 10.25 a | 26 a | 6.75 a | 6.75 a |
| 11B20 | 7.5 b | 8.5 a | 24 a | 5.25 abc | 5.25 b |
| 13B41 | 7.25 bc | 5.75 b | 22.75 a | 6 ab | 5.75 ab |
| 52B4 | 6 bcd | 9.5 a | 26 a | 4.5 bc | 5.5 ab |
| 22A67 | 6 bcd | 9.75 a | 23.5 a | 4.5 bc | 5.75 ab |
| 22B45 | 4.5 d | 3 c | 23.75 a | 4 c | 6 ab |
| Testigo | 5.5 cd | 9 a | 23 a | 4.5 bc | 5.25 ab |
Letras diferentes por columna denotan diferencias estadísticamente significativas entre tratamientos (α= 0.05).
La inoculación con las bacterias 53A2 y 11B20 promovió significativamente el crecimiento de la parte aérea de la planta, siendo el efecto mayor en el tratamiento con 53A2 con 2.37 g superando al tratamiento control que pesó 1.37 g. Resultados similares fueron encontrados por Viruel et al. (2014) donde atribuyen el incremento en la biomasa por el aumento de la disponibilidad de nutrientes como hierro y fosforo. A diferencia del efecto en la parte aérea la inoculación de las bacterias no causó un efecto estadísticamente significativo en el peso seco de la raíz ni en la altura de las plantas en los tratamientos evaluados. La inoculación con la bacteria 53A2 incrementó el tamaño del diámetro, el cual tuvo un tamaño promedio de 6.75 mm, incrementando 50% el grosor del tallo de las plantas no inoculadas.
En el segundo ensayo, realizado durante otoño (septiembre-octubre), se observó un mayor efecto de la inoculación de las bacterias promotoras de crecimiento en las plantas de maíz (Cuadro 4). Las plantas inoculadas con las cepas 53A2 y 13B41 tuvieron un peso seco aéreo significativamente mayor que el tratamiento control, con incrementos de 71.7 y 48.5%, respectivamente. Un resultado similar se obtuvo en al determinar el peso seco de la raíz, donde los mejores resultados se obtuvieron con las inoculaciones con las cepas 53A2 y 13B41, con un peso de 1.72 y 1.86, respectivamente. La inoculación de las cuatro cepas evaluadas incrementó significativamente el número de hojas (25%), respecto al control.
Cuadro 4 Efecto de la inoculación de bacterias edáficas nativas en plantas de maíz en otoño.
| Cepas | Peso fresco aéreo (g) | Peso fresco raíz (g) | Peso seco aéreo (g) | Peso seco raíz (g) | Altura (cm) | Diámetro del tallo (mm) | Núm. de hojas |
| 53A2 | 10 a | 14.5 a | 2.37 a | 1.72 ab | 27.5 a | 5.5 a | 8.75 a |
| 13B41 | 9.25 ab | 12 ab | 2.05 ab | 1.86 a | 29.5 a | 5.75 a | 8.75 a |
| 41B1 | 7.5 ab | 10.5 b | 1.74 bc | 1.43 bc | 23 a | 5.25 a | 8.75 a |
| 52B4 | 6.75 b | 9 b | 1.54 c | 1.03 c | 24.7 a | 4.25 ab | 8.75 a |
| Testigo | 8.25 b | 10.25 b | 1.38 c | 1.28 c | 23.5 a | 3.25 b | 7 b |
Letras diferentes por columna denotan diferencias estadísticamente significativas entre tratamientos (α= 0.05).
Por último, ningún tratamiento presentó un efecto significativo sobre la altura de las plantas, pero si sobre el grosor del tallo (excepto 41B1) donde se obtuvieron incrementos de 61 al 77% con diámetros de aproximadamente 5.5 cm comparados con los 3.25 del control no inoculado. El obtener tallos con mayor grosor y no incrementar la altura con la inoculación de las cepas de bacterias es buen indicativo del potencial en etapas reproductivas de las plantas, una altura reducida de la planta es considerada deseable en el maíz tropical, ya que las plantas que son generalmente altas, tienen mucho follaje y un bajo índice de cosecha, además las plantas con tallos más gruesos frecuentemente presentan mayor resistencia a acame o vuelco (Forero y Fernández, 2010).
Se observó un mejor desempeño de los microorganismos en el ensayo realizado durante los meses de septiembre y octubre, solamente la cepa 53A2 fue consistente en ambas evaluaciones, lo cual se infiere que es resultado de la capacidad de cada microorganismo para adaptarse a distintas condiciones, ya que ha sido reportado que su desempeño y efectos sobre las plantas pueden estar influenciados por factores que incluyen la adaptación a diferentes tipos de suelos, condiciones climáticas y genotipos vegetales (Saharan y Nehra, 2011; Arruda et al., 2013).
Conclusiones
No obstante, la agricultura intensiva que se ha realizado en el Valle del Yaqui, en la microbiota edáfica asociada al cultivo de maíz, existe una diversidad de microorganismos que poseen características de interés agrícola, como la síntesis de diversos compuestos (auxinas, sideróforos y enzimas/ácidos orgánicos para la solubilización de fosfatos) que impactan el desarrollo y salud de las plantas. Es importante el estudio y caracterización de microorganismos adaptados a las condiciones del suelo y climáticas, para seleccionar aquellos que tengan mayor potencial de mantenerse y multiplicarse en los sitios de interés y de esta manera poder reducir el uso de agroquímicos y a su vez mejorar la fertilidad del suelo y aumentar/mantener el rendimiento de los cultivos reduciendo los efectos negativos en el ambiente.











 texto em
texto em