Introducción
La seguridad alimentaria mundial es uno de los principales retos que actualmente enfrenta la humanidad, la cual “existe cuando todas las personas tienen, en todo momento, acceso físico, social y económico a alimentos suficientes, inocuos y nutritivos que satisfacen sus necesidades energéticas diarias y preferencias alimentarias, para llevar una vida activa y sana” (FAO, 1996).
Hoy en día, se produce suficiente alimento para toda la población mundial, 7 350 millones de personas; sin embargo, se proyecta que ésta aumentará a 9 000 millones de personas para el año 2050 (Godfray et al., 2010; Naciones Unidas, 2015), por lo cual la demanda de alimentos se incrementará entre un 70-100% (World Bank, 2008; FAO, 2016). En este contexto, debido a que la agricultura contribuye con el 98% de la producción de alimento global (Rao, 2013), es determinante incrementar la productividad agrícola con el objetivo de satisfacer la demanda global de alimentos, contribuyendo a la seguridad alimentaria y soberanía nacional.
De esta manera, diversos retos deben ser abordados: i) fertilidad de los suelos (elevados costos de producción agrícola asociados al consumo de agroquímicos); ii) cambio climático; iii) creciente mercado de los biocombustibles; iv) disponibilidad de recursos naturales; v) degradación de los recursos naturales; y vi) transferencia de tecnología limitada (Friedrich, 2014; Hernández-Mondragón et al., 2016). Así, con base en las actividades agrícolas que son susceptibles de ser modificadas e implementados por el hombre, la producción de alimentos está ligada fuertemente a la fertilidad de los suelos agrícolas.
El suelo, formado por material mineral (45%), agua (20-30%), gases (20-30%) y materia orgánica (1-5%) (McCauley et al., 2005), provee diversos servicios ecosistémicos, como son: i) la sostenibilidad social y ecológica; ii) adaptación y mitigación del cambio climático; iii) recurso biotecnológico para la humanidad; iv) ciclaje de agua y nutrientes; y v) seguridad alimentaria (Nelson et al., 2013). Sin embargo, a nivel mundial las tasas de degradación de suelo sugieren que tendremos su capa fértil solamente por 60 años más (Dotterweich, 2013). Actualmente, la degradación del suelo afecta a 1 900 millones de hectáreas en todo el mundo, incrementándose rápidamente a una tasa de 5 a 7 millones de hectáreas por año. Esta degradación impacta aproximadamente 70% de los suelos agrícolas en niveles de moderado a severo, lo que genera un costo estimado de $400 mil millones de dólares anuales a nivel mundial, afectando a más de mil millones de personas, especialmente en zonas áridas (Olafur, 2007).
Una de las principales causas de la degradación de los suelos son las prácticas agrícolas intensivas utilizadas para la producción agrícola, desde labranza mecánica hasta el uso excesivo y constante de fertilizantes y plaguicidas sintéticos (Friedrich, 2014). Esta degradación de los suelos conduce a disminución de sus propiedades físicas (humedad e intercambio de gases), químicas (pH y capacidad de intercambio catiónico) y biológicas (modificaciones en las comunidades microbianas involucradas en el ciclaje de nutrientes), conduciendo al incremento de su densidad aparente, menor estabilidad de sus agregados, la susceptibilidad a la compactación, pérdida de fertilidad, lixiviación de nutrientes, disminución de la productividad, incremento de emisiones de gases de efecto invernadero y disminución del secuestro de carbono y actividad microbiana (Friedrich, 2014).
La diversidad de los microorganismos edáficos son un componente importante involucrado en el mantenimiento de la fertilidad del suelo, dicha diversidad incluye más de 105 especies (Dohrmann et al., 2013), las cuales son responsables de llevar a cabo entre 80- 90% de los procesos observados en el suelo (Nannipieri et al., 2003); es decir, el ciclaje de nutrientes (nitrógeno, carbono, azufre y fósforo), descomposición de materia orgánica, solubilización de minerales (K, Ca, Mn, Mg, etc), fotosíntesis, degradación de compuestos xenobióticos, control de enfermedades de las plantas, mantenimiento de la estructura y función del suelo, entre otros (Pankhurst et al., 1997; Pal y McSpadden, 2006; Pankratova, 2006; Ryan et al., 2008). Actualmente, sólo una pequeña fracción de las comunidades microbianas del suelo (1- 10%) ha podido ser cultivada, por lo cual el estudio de este recurso microbiano permitirá entender el impacto de las actividades antropogénicas y naturales sobre la diversidad y ecología microbiana (Kalia y Gupta, 2005), representando una herramienta para aumentar la productividad de los cultivos agrícolas de una manera amigable con el ambiente y costo-efectiva.
Recientemente, el uso de microorganismos benéficos como base de los biofertilizantes, ha adquirido gran relevancia en el sector agrícola, ofreciendo una alternativa sostenible enfocada a incrementar la producción de los cultivos y la fertilidad de los suelos. Éstos comprenden un grupo heterogéneo de microorganismos de vida libre o asociados a diversas partes de la planta, con la capacidad de estimular el crecimiento vegetal, proteger a las plantas contra el ataque de patógenos o tolerar condiciones de estrés abiótico (altas temperaturas, salinidad, y baja disponibilidad de agua) (Dimkpa et al., 2009; Grover et al., 2011; Glick, 2012). Lo anterior ha sido estudiado bajo diversos mecanismos microbianos, los cuales se pueden clasificar en directos e indirectos.
Así, la promoción de crecimiento vegetal de manera directa por microorganismos involucra mecanismos que faciliten la toma de nutrientes del suelo, como es: i) la fijación de nitrógeno; ii) la solubilización de minerales, como son potasio y fósforo, de forma tal que los hacen disponibles para las plantas; iii) producción de fitohormonas; y iv) mineralización de compuestos orgánicos. Por otra parte, los mecanismos indirectos involucran la acción antagonista contra patógenos, mediante la producción de antibióticos, enzimas hidrolíticas, sideróforos, exopolisacáridos, e inducción de respuesta sistémica (Gupta et al., 2015).
El uso de inoculantes microbianos ha conducido a la reducción de los costos económicos de producción agrícola, debido a una menor aplicación de fertilizantes y plaguicidas sintéticos o al uso eficiente de éstos por las plantas, i.e. el nitrógeno y el fósforo (Gyaneshwar et al., 2002). En este sentido, diversos géneros bacterianos y fúngicos, tales como: Pseudomonas, Bacillus, Penicillum, Aspergillus, entre otros, han sido reportados por sus características metabólicas de producir fitohormonas, involucradas en la elongación radicular y mayor aprovechamiento del nitrógeno o en la producción de ácidos orgánicos que contribuyen a neutralizar el pH del suelo, favoreciendo la solubilización del fósforo insoluble (Kathiresan et al., 1995).
Además, se ha identificado que la aplicación de bioinoculantes permite reducir el uso de fertilizantes sintéticos, Adesemoye et al. (2009) inocularon un consorcio integrado por Bacillus amyloliquefaciens, Bacillus pumilus y Glomus intraradices en cultivo de tomate a nivel invernadero, que la aplicación de 75% de la dosis de fertilización recomendada más el consorcio microbiano evaluado impactó positivamente el crecimiento de las plantas, su rendimiento y absorción de nutrientes (nitrógeno y fósforo), resultados comparables a los obtenidos por el uso de la dosis total de fertilizantes recomendada.
Así, durante las últimas décadas una de las estrategias enfocadas en la sustitución parcial o total de los insumos agrícolas sintéticos ha sido la aplicación de inoculantes microbianos con diversas capacidades metabólicas de interés. Sin embargo, la agricultura Mexicana en su mayoría ha optado por el consumo y la aplicación de consorcios microbianos proveniente de otros países, donde las condiciones edafo climáticas y de cultivos son diferentes a las registradas en nuestro país y que generalmente se han obteniendo resultados poco favorables por el uso de inoculantes microbianos en la productividad agrícola nacional, propiciando así el descontento del sector productivo hacia el uso de estos microorganismos, sin mencionar los potenciales daños ecológicos por la introducción de cepas microbianas exógenas a estos agro sistemas.
Las principales limitantes para el éxito en campo de la aplicación de los inoculantes microbianos, se resumen en: 1) identificar una cepa o consorcio microbiano con impacto significativo sobre la característica deseado en el cultivo agrícola de interés; 2) el método de propagación y reproducción masiva de estos microorganismos, determinando las condiciones óptimas de crecimiento; y 3) formular el bioinoculante con la(s) cepa(as) promisoras y el vehículo o acarreador de aplicación. Una vez que éstas limitantes han sido cubiertas de manera exitosa se deben considerar diversos aspectos de los microorganismos que forman parte de este bioinoculante, tales como i) tener la capacidad de establecerse en el suelo o la planta bajo las condiciones bióticas y abióticos del ecosistema destino; ii) competir con la microbiota nativa; y iii) colonizar la rizósfera y la parte de la planta de interés, expresando las características metabólicas deseadas de promoción de crecimiento/protección contra patógenos (Köhl et al., 2011; Brahmaprakash y Sahu, 2012; Galindo et al., 2013, Bashan et al., 2014). Además, el éxito de la comercialización de este bioinoculante depende de su viabilidad económica en comparación a los fertilizantes y fungicidas sintéticos disponibles en el mercado (Malusa et al., 2016).
En este sentido, el gran esfuerzo de la comunidad científica para la aplicación en campo, ha conducido al aislamiento de miles de cultivos microbianos asociadas a diversos cultivos agrícolas de gran importancia para nuestro país. Una pequeña cantidad de cepas se han estudiado a nivel laboratorio y sólo algunas han llegado a formar parte de desarrollos como inoculantes microbianos y de formar parte de una variedad de productos biológicos existentes en el mercado, enfocados a incrementar la productividad agrícola de manera sostenible. Sin embargo, la gran mayoría de las cepas microbianas aisladas que no son seleccionadas debido a la ausencia o bajos niveles de alguna actividad metabólica de interés son separadas del grupo de microorganismos factibles, sin considerar las diversas características metabólicas potenciales almacenadas en sus genomas
Por lo anterior, la microbiota aislada debe estar resguarda en colecciones microbianas certificadas (independientemente de las características metabólicas de interés particular) para preservar ex situ la diversidad microbiana nativa asociadas a los cultivos, así como el potencial recurso agro-biotecnológico que éstos representan para la comunidad científica, productores y sector público- privado, lo que permitirá explorar aún más su ecología en nuestra agricultura actual y futura de nuestro país.
Así, las colecciones microbianas juegan un papel importante en la conservación y uso sustentable del recurso microbiano, proporcionando material biológico auténticamente puro, estables, útiles para llevar a cabo investigación y enseñanza, facilitando el acceso a cepas de referencia y reactivos útiles para el control de calidad (Sharman y Shouche, 2014). Además, ofrecen servicios de entrenamiento y capacitación en técnicas relacionadas con la conservación, desarrollo e identificación de microorganismos (WFCC, 2014).
Por otra parte, el continuo descubrimiento de nuevas especies microbianas genera la necesidad de preservarlos y transferirlos a la comunidad científica, para llevar a cabo investigación, docencia y su potencial explotación biotecnológica. Sin embargo, estas colecciones microbianas generalmente se encuentran en instituciones altamente especializadas enfocadas en resguardar sus potenciales agro-biotecnológicos para garantizar la seguridad alimentaria de los países con sólida economía, mayor desarrollo científico-tecnológico y consientes de la importancia del resguardo de las comunidades microbianas edáficas.
Estos países preservan, de manera certificada, aproximadamente 98% del total de cepas, lo que constituye 45% del total de microorganismos resguardados en el continente americano, en comparación a México que sólo mantiene alrededor de 9.078 cultivos microbianos en 18 colecciones, lo que representa sólo 2%, y que corresponde únicamente 0.4% del total de microorganismos resguardados a nivel mundial (WFCC, 2014).
Colección de microorganismos edáficos y endófitos nativos
La colección de microorganismos edáficos y endófitos nativos (COLMENA) www.itson.mx/colmena) es una colección microbiana enfocada en la preservación, clasificación, caracterización y transferencia de microorganismos nativos aislados de diferentes agro-sistemas y otros hábitats en México. El objetivo de esta colección es disminuir la pérdida de la diversidad microbiana, como una estrategia de conservación del suelo, mediante el aislamiento, resguardo, caracterización y tipificación del recurso microbiano edáfico cultivable, cuantificando los potenciales beneficios ambientales y económicos de su re-incorporación a los ecosistemas.
Actualmente, COLMENA preserva y estudia un acervo de 1 464 microorganismos aislados de suelo y asociadas a diversos cultivos agrícolas de importancia económica para México, tales como: trigo (448), maíz (313), frijol (35), brócoli (51), alfalfa (54), y otros (Figura 1). La primera etapa de COLMENA se inició con el aislamiento de microorganismos edáficos en dos de las principales regiones agrícolas de México, a) el Valle del Yaqui, localizado en el estado de Sonora en México (longitud 108° 53’ y 110° 37’ E; latitud 26° 53’ y 28° 37’ latitud norte) constituido por 225 000 ha, el cual contribuye aproximadamente con 35% de la producción nacional de trigo (CIMMYT, 2017; SAGARPA, 2017) y b) el Valle del Fuerte, localizado en el estado de Sinaloa (longitud 108° 16’ 47” y 109° 04’ 42” longitud oeste; latitud 25° 53’ 29” y los 26° 38’ 47” norte), siendo el primer lugar en la producción de maíz del estado, con una superficie sembrada de 277 642 ha (SAGARPA, 2011; SIAP-SAGARPA, 2016).
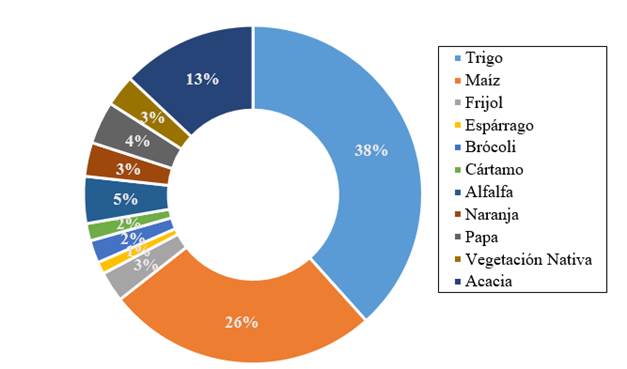
Figura 1 Contribución porcentual del número de cepas microbianas preservadas en COLMENA asociadas a los cultivos agrícolas en estudio, localizados en el Valle del Yaqui, Sonora y el Valle del Fuerte, Sinaloa, México.
A la fecha, 24% de las cepas preservadas en COLMENA han sido caracterizadas molecularmente, mediante la amplificación del gen 16S RNAr y 5.8S RNAr, identificando una diversidad bacteriana compuesta por 28 géneros, siendo los más abundantes: Bacillus (27%), Pseudomonas (8%) y Stenotrophomonas (6%) y 24 géneros fúngicos, siendo los más representativos Aspergillus (8%), Penicillium (3%) y Myrothecium (3%) (Figura 2). Así, la detallada identificación molecular de dichas cepas es determinante para responder preguntas fundamentales de sistemática, taxonomía y evolución, lo que permite: i) establecer criterios de calidad en productos y servicios; ii) identificar fuentes de contaminación; iii) selección de tratamientos de desinfección; iv) identificar microorganismos bioindicadores del ecosistema, v) identificar cepas microbianas promotoras de crecimiento vegetal y agentes de control biológico; vi) estudiar nuevas especies microbianas; y vii) identificar cepas patógenas o perjudiciales, tanto para el ser humano, como plantas y animales, entre otros (Emerson et al., 2008).
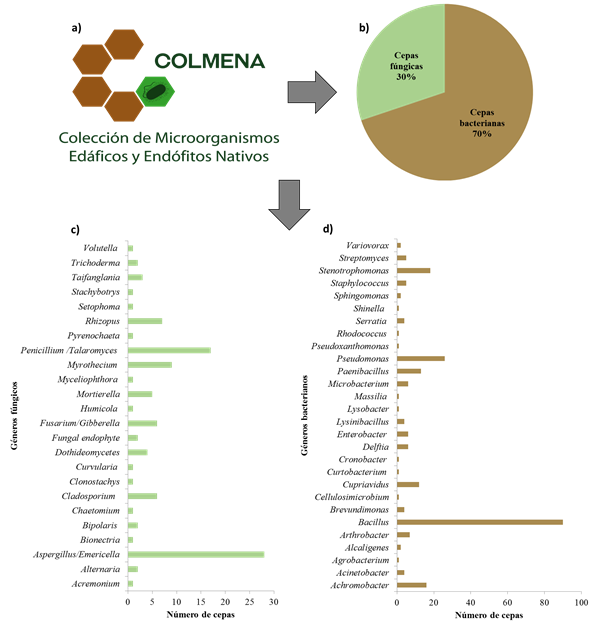
Figura 2 Composición de las cepas resguardadas en COLMENA. a) logotipo de COLMENA; b) porcentaje de bacterias y hongos preservados en COLMENA; c) principales géneros fúngicos; y d) bacterianos estudiados en COLMENA, obtenidos por el análisis de los genes 5.8S RNAr y 16S RNAr, respectivamente.
Por otra parte, la identificación de cepas potencialmente patogénicas para el ser humano -mediante estudios taxonómicos y la actividad β-hemolítica- se lleva a cabo en COLMENA. Así, hasta el momento de un total de 258 cepas microbianas evaluadas, 11% presenta actividad β-hemolisis, lo que restringe su uso potencial como inoculante microbiano para el sector agrícola (Figura 3). COLMENA se ha especializado en identificar y caracterizar cepas microbianas con capacidades metabólicas asociadas al control biológico de enfermedades de plantas y de la promoción del crecimiento vegetal, tales como: la solubilización de fósforo, biosíntesis de sideróforos, producción de indoles, producción de enzimas líticas, entre otras (Figura 3).

Figura 3 Porcentaje de cepas promisorias para la promoción del crecimiento vegetal y agentes de control biológico de fitopatógenos conservadas en COLMENA.
Hasta el momento, 12% de las cepas analizadas (660) han presentado la capacidad de solubilizar fósforo insoluble, lo cual es de gran importancia ya que en los agro-sistemas, después del nitrógeno, el fósforo es el elemento más importante en la nutrición de las plantas, desempeñando un papel importante en procesos fisiológicos como la fotosíntesis, transferencia de energía, biosíntesis de macromoléculas y respiración (Khan et al., 2010). Sin embargo, entre 95-99% del fósforo presente en los suelos agrícolas se encuentra en forma insoluble, limitando su aprovechamiento por las plantas, ya que éstas absorben el elemento en dos formas solubles: iones monobásicos (H2PO4) y dibásicos (HPO42-) (Pandey y Maheshwari, 2007).
Así, la microbiota asociada a las plantas puede contribuir a la solubilización y utilización del fósforo insoluble por éstas, mediante la liberación de compuestos complejos o disolventes minerales (aniones de ácidos orgánicos, protones, iones hidroxilo, CO2), liberación de enzimas extracelulares (mineralización bioquímica de fosfatos) y liberación de fosfato durante la degradación del suelo (mineralización biológica de fosfatos) (Sharma et al., 2013).
Otro nutriente importante en el desarrollo de las plantas y los microorganismos, es el hierro, siendo el cuarto elemento más abundante en la superficie terrestre (1-6%), el cual está relacionado en el transporte de electrones, en la catálisis de reacciones enzimáticas involucradas en el metabolismo del hidrogeno, oxigeno -síntesis de ATP- y nitrógeno, así como en la síntesis de ADN (Faraldo-Gómez y Sansom, 2003). Sin embargo, bajo ciertas condiciones de oxígeno y pH se encuentra escasamente disponible, debido a su rápida oxidación de Fe+2 a Fe+3, y a la subsecuente formación de hidróxidos insolubles (Faraldo-Gómez y Sansom, 2003).
Las bacterias han desarrollado diversos mecanismos para la adquisición de hierro, uno de los mecanismos más utilizados es la síntesis de compuestos quelantes denominados sideróforos (Crichton, 2001). La producción y excreción de sideróforos por los microorganismos asociados a los cultivos agrícolas estimula el crecimiento de éstos, mejorando la nutrición o inhibiendo el establecimiento de fitopatógenos a través del secuestro de hierro del medio ambiente, lo cual limita su crecimiento (de Souza et al., 2015). En este sentido, actualmente se han identificado 290 cepas microbianas capaces devde biosintetizar diversas clases de sideróforos.
Asimismo, se han identificado 50 microorganismos con la capacidad de producción de índoles, grupo al cual pertenece el ácido indol acético, la auxina natural más importante en las plantas. Esta fitohormona desempeña un papel central en la división celular, la elongación, el desarrollo de frutos y la senescencia, por lo que está directamente involucrada en la regulación del crecimiento vegetal, promueve la formación de dominios apicales, incremento longitudinal de la raíz y el desarrollo de órganos (Camelo et al., 2011; Grover et al., 2011; Duca et al., 2014). Algunos microorganismos son capaces de sintetizar ácido indol acético que a concentraciones ideales en la planta estimulan a la formación de vello radicular, aumenta el número y la longitud de las raíces primarias y laterales (Duca et al., 2014).
En COLMENA se han identificado 60 cepas microbianas con la capacidad de producir enzimas celulolíticas, las cuales pueden estar involucradas en diversos mecanismos de control biológico por géneros microbianas, tales como: Trichoderma, Fusarium, Penicillium, Alternaria, Cellolomonas, Bacillus, Pseudomonas, entre otros (Lynd et al., 2002; Ahmad et al., 2008). En COLMENA también se conservan especies microbianas reportadas como patógenas a plantas, como son: Sclerotinia sclerotiorum (agente causal de moho blanco en frijol), Fusarium verticillioides (agente causal de podredumbre de oreja de maíz), y Bipolaris sorokiniana (agente causal de la mancha borrosa en el trigo) (Pal y McSpadden-Gardener, 2006; Villa-Rodríguez et al., 2016). Así, el estudio de estas cepas potencialmente fitopatógenas a diversos cultivos agrícolas de importancia nacional permitirá conocer sus mecanismos de acción, conduciendo al desarrollo de estrategias más eficientes y sostenibles para su control.
Conclusiones
El progresivo requerimiento de alimentos como consecuencia de la tasa de crecimiento poblacional mundial demanda el incremento de la productividad agrícola, mediante el uso de prácticas agrícolas eficientes y sostenibles. Una alternativa es el uso de la diversidad microbiana nativa asociadas a los cultivos agrícolas, representando un potencial recurso agro-biotecnológico para la agricultura y comunidad científica. De esta manera, las colecciones microbianas tienen una contribución de importancia en la conservación y uso sustentable del recurso microbiano, proveyendo de material biológico auténtico, estables, y útiles para desarrollar las estrategias planteadas.
La colección de microorganismos edáficos y endófitos nativos (COLMENA) preserva y caracteriza microorganismos asociados a cultivos agrícolas de importancia nacional, mediante la identificación de cepas promotoras del crecimiento vegetal y agentes de control biológico de fitopatogenos. Además, COLMENA es un proyecto dinámico, el cual incluirá un mayor número de zonas agrícolas a nivel nacional, continuando con la caracterización metabólica y molecular de los microorganismos resguardados en la colección, además de implementar estudios sobre características metabólicas adicionales como es la producción de antibióticos, ensayos de tolerancia a estrés, formulación de bioinoculantes, pruebas en campo, por citar algunos.











 texto en
texto en 


