Introducción
El ablandamiento de los frutos es una serie de eventos genéticamente programados, caracterizados por procesos bioquímicos y fisiológicos que alteran su firmeza, color, sabor y textura (Nishiyama et al., 2007). Dado que la mayor parte de los atributos de calidad son el resultadao del proceso de maduración, se ha considerado esencial comprender los mecanismos regulatorios involucrados en esta etapa de desarrollo de los frutos (Bouzayen et al., 2010).
Los frutos son productos altamente perecederos debido a su arquitectura celular y la intensa actividad metabólica (Dos Santos et al., 2015). Algunos procesos de deterioro causan a los agricultores pérdidas de hasta 40% del valor de la cosecha antes de que lleguen al consumidor (Kitinoja et al., 2011). La aplicación de las tecnologías apropiadas para mantener la calidad depende del conocimiento de la estructura del fruto, la fisiología y las transformaciones metabólicas (Pech et al., 2013), por ello se han realizado estudios con el fin de comprender mejor el órgano floral y el desarrollo del fruto (Bao et al., 2010; Seymour et al., 2013), el papel de las hormonas y los genes relacionados con el desarrollo y la maduración (Alexander y Grierson, 2002; Cara y Giovannoni, 2008; Kumar et al., 2014), así como los desórdenes fisiológicos (Pegoraro et al., 2010) y las alteraciones epigenéticas asociadas a la maduración (Manning et al., 2006; Zhong et al., 2013) (Dos Santos et al., 2015).
El objetivo de esta investigación es recopilar la información más relevante publicada referente a los cambios que ocurren en los frutos durante la etapa postcosecha.
Maduración fisiológica de los frutos
El desarrollo del fruto ocurre en tres etapas: crecimiento, desarrollo y maduración, seguidas por el ablandamiento y la senescencia (Alba et al., 2005).
El fruto comienza a desarrollarse poco tiempo después de la polinización y la fertilización (O’Neill, 1997) a través de la divison celular, fenómeno que se presenta en las primeras etapas del desarrollo (Dos Santos et al., 2015). Después de este periodo, el crecimiento ocurre debido al aumento de tamaño de la célula al aparecer las vacuolas. Esta etapa se caracteriza por el crecimiento y alargamiento del fruto, seguida por una fase de maduración, donde el número de células se mantiene relativamente constante, observándose un aumento en el tamaño de las mismas (Dos Santos et al., 2015). Esta expansión aumenta en la maduración, etapa donde el fruto es capaz de madurar aún adherido a la planta.
Dentro de las etapas mencionadas, ocurren varios pasos que se llevan a cabo entre el inicio del desarrollo del fruto y su senescencia (Figura 1). La madurez fisiológica ocurre antes del desarrollo completo del fruto que después de cosechado debe sobrevivir con sus propios sustratos acumulados (Dos Santos et al., 2015). Este es un paso intermedio entre el fin del crecimiento y el inicio de la senescencia (Dos Santos et al., 2015). Las actividades bioquímicas y fisiológicas involucradas en el ablandamiento, como cambios en la firmeza y en la velocidad de respiración, entre otros; son irreversibles una vez iniciadas (Omboki et al., 2015). Solo pueden retrasarse o disminuir su velocidad con la aplicación externa de ciertos procedimientos (Omboki et al., 2015).
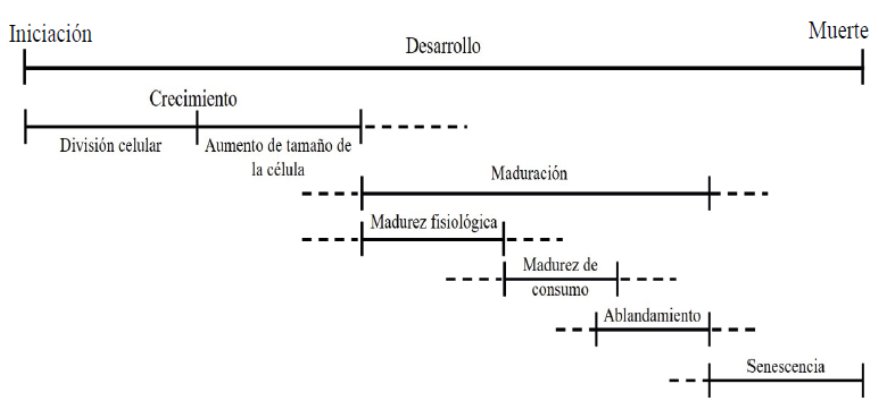
Figura 1 Etapas entre la formación del fruto y la senescencia (Watada et al., 1984; Dos Santos et al., 2015).
Además, desde el desarrollo y hasta la maduración, varios genes están involucrados y entre estos se encuentran los factores de transcripción (TFs) que tienen gran importancia en la modulación de la expresión de varios genes y procesos metabólicos (O’Neill 1997; Giovannoni, 2001).
El proceso de maduración, cambios bioquímicos y sensoriales
En las etapas finales del crecimiento y el desarrollo, ocurre el proceso de maduración en dos pasos: la madurez fisiológica, es cuando el fruto alcanza su máximo tamaño y el mayor vigor de las semillas; y segundo, la madurez de consumo, aquí los cambios del fruto incluyen 1) la modificación del color a través de la alteración en el contenido de clorofilas, carotenoides y la acumulación de los flavonoides; 2) la modificación de la textura vía alteración del turgor celular y de la estructura de la pared celular y por el metabolismo; 3) la modificación de azúcares, ácidos orgánicos y compuestos volátiles que afectan la calidad nutricional, el sabor y el aroma del fruto; y 4) aumento en la susceptibilidad al ataque de patógenos oportunistas que están asociados a la pérdida de integridad de la pared celular (Giovannoni, 2004; Seymour et al., 2013; Dos Santos et al., 2015). A continuación se describen estos fenómenos más a detalle:
Modificación del color. Los pigmentos son esenciales para que los frutos sean atractivos, se acumulan comúnmente en la cutícula durante el proceso de maduración, aunque muchos frutos climatéricos también acumulan pigmentos en el tejido de la pulpa durante la maduración postcosecha, a diferencia de los frutos no climatéricos (Bouzayen et al., 2010). Los pigmentos más importantes son los carotenoides y las antocianinas (Bartley y Scolnik, 1995). Además de su papel en la pigmentación, son importantes para la salud humana como fuentes de vitamina A y compuestos antioxidantes, respectivamente (Bartley y Scolnik, 1995).
Los carotenoides comprenden a los carotenos, como el licopeno, el β-caroteno y las xantofilas que incluyen a la luteína (Bouzayen et al., 2010). Las antocianinas pertenecen a la subclase flavonoide de los compuestos fenólicos (He y Giusti, 2010). En la uva (Vitis vinifera), donde las antocianinas son cruciales para la calidad del vino, se ha demostrado que el etileno estimula la coloración de la baya, por lo que se concluye que esta hormona está involucrada en la regulación de los genes de la biosíntesis de antocianinas (El-Kereamy et al., 2003; Bouzayen et al., 2010). Es sabido que las condiciones ambientales y el manejo de la huerta, donde se incluyen el riego, la poda y la fertilización impactan fuertemente en la coloración de los frutos (Bouzayen et al., 2010).
Estudios han demostrado que existe una correlación positiva entre la síntesis de antocianinas y la intensidad de la luz solar en diversos frutos como la manzana (Malus domestica) (Ju et al ., 1999), la uva (Vitis vinifera) (Dokoozlian y Kliewer, 1996; Bergqvist et al., 2001; Spayd et al., 2002), el durazno (Prunus persica) (Jia et al., 2005), la fresa (Fragaria ananassa) (Da Silva et al., 2007) y el litchi (Litchi chinensis) (Tyas et al., 1998). En estos casos, la luz del sol aumenta la síntesis de antocianinas (de Pascual-Teresa y Sánchez-Ballesta, 2008). Los cambios de temperatura también juegan un papel importante, se ha observado que ambientes con temperaturas bajas favorecen la acumulación de antocianinas, mientras que climas cálidos disminuyen la síntesis de estos compuestos (Leng et al., 2000; Li et al., 2004; Mori et al., 2005).
Las deficiencias en nutrientes, especialmente fósforo (P) y nitrógeno (N) inducen la acumulación de antocianinas en diferentes especies (Hodges y Niozillo, 1995; de Pascual-Teresa y Sánchez-Ballesta, 2008). En tomate (Solanum lycopersicum), además de aumentar el contenido de flavonoides, el estrés por N también produce efectos en la expresión diferencial de genes que codifican enzimas para la biosíntesis de antocianinas (Bongue- Bartelsman y Phillips, 1995). En contraste, se ha reportado que altos niveles de N aplicado a árboles de durazno (Prunus persica) y nectarina (Prunus persica var. nucipersica) afectan negativamente la calidad del fruto, ya que la madurez se retrasa, el porcentaje de coloración roja disminuye y el tamaño del fruto no aumenta en comparación con los frutos tratados con niveles óptimos de N (Daane et al., 1995). Se observaron resultados similares en aronia negra (Aronia melanocarpa cv. Viking) al utilizar un fertilizante con combinación de N, P y potasio (K) (Jeppsson, 2000).
Modificación de la textura. Uno de los principales factores asociado con el deterioro postcosecha de los frutos es la velocidad de ablandamiento, que provoca una vida de anaquel más corta, reduciendo los tiempos de transporte y distribución y aumenta las pérdidas postcosecha (Bapat et al., 2010).
El ablandamiento de los frutos es causado por el efecto acumulativo de una serie de modificaciones que ocurren en las redes de polímeros que constituyen la pared celular primaria. El ablandamiento del fruto es un proceso complejo que involucra tres pasos subsecuentes: 1) relajación de la pared celular mediada por expansinas; 2) despolimerización de hemicelulosas; y 3) despolimerización de poliurónidos por la poligalacturonasa u otras enzimas hidrolíticas (Brummell et al., 1999; Payasi et al., 2009); lo cual contribuye a una pérdida de firmeza y cambios en calidad de la textura (Brummell y Harpster, 2001). Las modificaciones en los polímeros de la pared celular durante el ablandamiento son complicadas y se considera que involucran una acción coordinada e interdependiente de un rango de enzimas y proteínas modificadoras de la pared celular tales como la poligalacturonasa (PG, EC 3.2.1.15), pectinmetilesterasa (PME, EC 3.1.1.11), β-galactosidasa (EC 3.2.1.23) xiloglucano endotransglicosilasa (XET, EC 2.4.1.207) y expansinas (Brummell y Harpster, 2001; Payasi et al., 2009).
Modificación del aroma. El aroma es una mezcla compleja de un amplio rango de compuestos. Los compuestos volátiles del aroma contribuyen decisivamente a la calidad sensorial de los frutos (Bouzayen et al., 2010). En años recientes, los esfuerzos en la investigación se han dirigido hacia el aislamiento de genes relacionados a los compuestos volátiles en frutas (Aharoni et al ., 2000; Yahyaoui et al., 2002; Beekwilder et al., 2004; El-Sharkawy et al., 2004; Pech et al., 2008). Las clases más importantes de compuestos que confieren olor son los monoterpenos, sesquiterpenos y compuestos derivados de lípidos, azúcares y aminoácidos.
Se sabe que el etileno controla la velocidad de maduración, la duración de la vida de anaquel y la mayoría de los eventos de maduración en frutos climatéricos (Bouzayen et al., 2010). También se ha desmostrado que el etileno tiene un papel clave en la regulación de genes involucrados en la producción de compuestos volátiles en múltiples especies frutales a través del uso de mutantes en tomate, líneas transgénicas de RNA antisentido en manzana y otros inhibidores de receptores de etileno (en manzana, Schaffer et al., 2007; en tomate, Kovacs et al., 2009; DeFillipi et al., 2009 y Gapper et al., 2013). Por lo tanto, se ha observado que los genotipos generados para tener una vida de anaquel extendida, han resultado en una severa pérdida de sabor y olor, ya que muchos genes de la biosíntesis del aroma son regulados por el etileno (El-Sharkawy et al., 2004; Manríquez et al., 2006).
Dandekar et al. (2004), reportaron una regulación diferencial de etileno con respecto a los componentes de la calidad de la fruta en manzana. Se ha reportado que existe una correlación directa entre el etileno y la producción del aroma durante la maduración del fruto de manzana (Wang et al., 2007). Asimismo, Schaffer et al. (2007), identificaron 17 genes candidatos que era probable que fueran puntos de control de etileno con respecto a la producción del aroma en manzana, aunque solo ciertos puntos en las rutas de la biosíntesis del aroma eran regulados por el etileno. Es decir, el primer paso en algunas rutas y los últimos pasos de todas las rutas biosintéticas contenían enzimas reguladas por etileno.
Con estos hallazgos concluyeron que los pasos tanto inicial como final de las rutas biosintéticas son puntos importantes de regulación transcripcional para la producción del aroma en manzana. Un reto importante para el futuro será desunir la regulación por disminución de etileno de la inhibición de la producción de compuestos volátiles (Bouzayen et al., 2010).
Al final de la etapa de madurez de consumo, ocurren algunos cambios fisiológicos relacionados con la senescencia que llevan al deterioro de la membrana y a la muerte celular. En este aspecto, la madurez de consumo puede ser considerada como el primer paso de un proceso de muerte celular programada (Bouzayen et al., 2010). Durante la senescencia la síntesis de carbohidratos cesa y tiene lugar la degradación de las proteínas, clorofilas, lípidos y ácidos nucleicos, que requiere la síntesis de enzimas hidrolíticas, así como la síntesis de carotenoides y de compuestos antioxidantes (Gapper et al., 2013).
Dichas enzimas son sintetizadas a partir de la activación de genes que las codifican; así como también, todos los cambios bioquímicos y fisiológicos que tienen lugar durante esta etapa son promovidos por la expresión coordinada de genes relacionados con la maduración del fruto (Bouzayen et al., 2010). También codifican para proteínas reguladoras que participan en las rutas de señalización y en la maquinaria transcripcional que regula la expresión de genes y genera el programa de desarrollo de la maduración (Bouzayen et al., 2010). El conjunto de genes que controlan la firmeza, el sabor, el color y el aroma del fruto están regulados por un diferente conjunto específico de genes que a su vez pueden ser regulados ya sea por uno solo o por un conjunto de factores de transcripción (Nath et al., 2007).
Actividad respiratoria
Los frutos son definidos fisiológicamente con base a la presencia (climatéricos) o ausencia (no climatéricos) de un aumento en la respiración y en la síntesis de etileno al comienzo de la madurez de consumo (Lelièvre et al., 1997).
Los frutos climatéricos son aquellos que pueden madurar no sólo adheridos a la planta, sino también después de la cosecha, cuando son cortados en la etapa pre climatérica, como el tomate (Solanum lycopersicum), la manzana (Malus domestica) y el plátano (Musa spp.), este tipo de frutos alcanza más pronto la senescencia (Fernández-Trujillo et al., 2007; Obando-Ulloa et al., 2008) en vista de que la respiración está acompañada por un aumento similar en los niveles de etileno, que coordina y sincroniza el proceso de maduración (Omboki et al., 2015).
Por otro lado, los frutos no climatéricos como la fresa (Fragaria spp.), la uva (Vitis vinifera L.) y los cítricos, solo alcanzan la maduración cuando aún están unidos a la planta, ya que no presentan un aumento en la respiración y en la producción de etileno después de la cosecha (Biale, 1964; Given et al., 1988; Chervin et al., 2004). Los frutos no climatéricos no desarrollan los patrones climatéricos que incluyen el aumento en la respiración, biosíntesis de etileno y respuesta autocatalítica al etileno, pero muestran algunas respuestas típicas al etileno como desverdizado (cambios en la coloración de verde a amarillo o anaranjado y ablandamiento (síntesis de enzimas que degradan la pared celular), entre otros (Dos Santos et al., 2015). Es decir, se llevan a cabo los mismos cambios bioquímicos en el color, textura, sabor y olor del fruto. Esto sugiere que los genes involucrados son los mismos que están expresados diferencialmente debido a la evolución que sus reguladores han sido conservados vía procesos evolutivos (Omboki et al., 2015).
Los frutos climatéricos sufren un deterioro masivo durante el manejo postcosecha, lo que se traduce en pérdidas económicas significativas (Bapat et al., 2010). El proceso de la maduración involucra aspectos tales como la regulación del control metabólico, la comunicación entre organelos, los reguladores de crecimiento y la expresión genética (Alexander y Grierson, 2002). Diversos estudios genéticos han sugerido que el proceso de la maduración está programado en la célula y que requiere de la expresión diferencial de genes, lo que resulta en la transcripción de mRNA específicos y en la síntesis de proteínas de novo (Lincoln y Fischer, 1988; Darley et al., 2001).
En este sentido, se han utilizado técnicas de biología molecular dirigidas al aislamiento, reconocimiento y expresión de los genes de las principales enzimas que actúan durante el ablandamiento que se presenta en la maduración de los frutos (Brummell y Harpster, 2001); sin embargo, las diferencias moleculares que hay entre la maduración climatérica y no climatérica aún son poco conocidas (Giovannoni, 2004).
Aunque el papel específico de la respiración climatérica en la maduración del fruto aún no está claro, la incorporación del etileno como coordinador de la maduración de especies climatéricas probablemente sirva para facilitar la maduración rápida y coordinada (Giovannoni, 2004).
El etileno
El crecimiento y desarrollo del futo son controlados por la producción de hormonas, las cuales son susceptibles a los cambios ambientales (McClellan y Chang, 2008). Entre estas hormonas se encuentra el etileno, que controla muchos procesos en la plantas superiores, como la senescencia de los órganos, respuesta al estrés, la germinación de la semilla (Owino et al., 2006; Zhu y Zhou; 2007; Jiang et al., 2011; Oms-Oliu et al., 2011; Zheng et al., 2013), la cicatrización de heridas (Capitani et al., 1999), además de las interacciones con otras hormonas e iones metálicos (Cervantes, 2002).
Asimismo, ha sido identificado como la principal hormona que inicia y controla el proceso de maduración del fruto (Abeles et al., 1992; Lara y Vendrell, 2003; Owino et al., 2006; McClellan y Chang, 2008; Pech et al., 2008; Asif et al., 2009; Wang et al., 2009; Bapat et al., 2010; Iguarán y Alzate, 2014). En resumen, la presencia del etileno inicia la maduración y la completa en varias etapas (Omboki et al., 2015).
En frutos carnosos, se ha intentado disminuir la biosíntesis del etileno durante la maduración para retardar el deterioro en postcosecha (Bapat et al., 2010) puesto que una vez que la maduración ha sido iniciada, el proceso es incontrolable (Jiang et al., 2011). La mayor parte de los procedimientos utilizados para limitar la biosíntesis de etileno se enfocan en el aumento o disminución de la temperatura y la modificación de la atmósfera en la que se conservan los frutos (Lara y Vendrell, 2003; Zhu y Zhou, 2007; Asif et al., 2009).
Biosíntesis de etileno
El etileno se produce en la mayoría de los tejidos de plantas (Oms-Oliu et al., 2011). En los frutos existen dos sistemas distintivos de biosíntesis.
El sistema 1 corresponde a una baja producción de etileno en el periodo pre- climatérico de los frutos climatéricos y está presente a lo largo del desarrollo de frutos no climatéricos. El sistema 2 se refiere a una producción de etileno autorregulatoria llamada “síntesis autocatalítica”, y es específica para frutos climatéricos (Bapat et al., 2010). Es decir, que en el inicio de la maduración, los frutos climatéricos presentan un punto máximo de respiración, seguido por una explosión en la producción de etileno, mientras que, en los frutos no climatéricos, la maduración es independiente del etileno, el cual está presente solo a un nivel basal (Asif et al., 2009). Además, la explosión climatérica de la producción de etileno estimula los genes responsables de la biosíntesis del etileno (Lara y Vendrell, 2003).
La ruta biosintética del etileno (Figura 2) está bien establecida (Yang y Hoffman, 1984). Esta hormona de la maduración inicia con la conversión de metionina a S-adenosil-L-metionina (SAM) y ácido 1-aminociclopropano-1-carboxilico (ACC) (Kende, 1993). Dos enzimas clave están involucradas en la ruta biosintética, la ACC sintasa (ACS), que convierte a SAM en ACC, y la ACC oxidasa (ACO) que convierte a ACC en etileno (Kende, 1993) y se han identificado y caracterizado los genes correspondientes que las codifican (Sato y Theologis, 1989; Hamilton et al., 1990, 1991). Los perfiles de expresión y mecanismos de regulación de los genes de ACS y ACO en frutos han sido investigados en plantas (Liu et al., 2015).
En tomate se ha reportado que tanto ACS como ACO son codificadas por una familia de multigenes de cinco y nueve miembros, respectivamente, con expresión regulada diferencialmente durante el desarrollo y la madurez del fruto (Bapat et al., 2010; Bouzayen et al., 2010). Asimismo, los genes de ACS y ACO han sido utilizados como blanco para suprimir la producción de etileno y retardar la maduración y la senescencia de los frutos en otras especies como melón (Cucumis melo var. cantalupensis; Ayub et al., 1996), manzana (Wang et al., 2009) y en frutos de mora (Morus atropurpurea cv. Jialing; Liu et al., 2015).
Control químico de la respuesta al etileno
Un inhibidor de etileno, un compuesto llamado 1-metilcilopropeno (1-MCP), ha probado ser un antagonista potente de la acción del etileno y ahora es usado como una herramienta de investigación para poder llegar a un mejor entendimiento de los procesos reguladores de etileno y para la extensión de la vida de anaquel de frutas y vegetales (Blankenship y Dole, 2003). Se ha observado un amplio rango de efectos que varían entre especies e incluso entre cultivares (Watkins, 2006). Parece ser que este compuesto tiene limitantes en muchas especies, pero su mayor éxito ha sido prolongar la vida de anaquel de los frutos de manzana, lo que llevado a que sea ampliamente utilizado en la industria.
El 1-MCP se aplica mejor después de que la maduración ha iniciado. La aplicación preclimatérica resulta en una severa inhibición de la maduración que puede ser problemática para recuperarse (Omboki et al., 2015). Se determinó que la actividad del 1-MCP está influenciada por los niveles internos de etileno (Zhengke et al., 2009). Este es un descubrimiento importante que puede ser explotado para el cultivo hortícola a escala industrial o comercial (Omboki et al., 2015).
Conclusiones
Hay un notable progreso en el estudio de los mecanismos de la maduración de los frutos, pero un gran número de preguntas aún permanecen sin respuesta.
El etileno juega un papel determinante en el proceso de maduración y su relación con los diferentes procesos que ocurren en esta etapa en los frutos climatéricos, pero aún quedaría por abordar la función de otras hormonas y la forma en la que actúan junto con el etileno. Asimismo, otro tema sobre el que se requiere más información, es el mecanismo por el cual el etileno selecciona genes específicos de regulación de la maduración.
Por otro lado, aunque en frutos no climatéricos hay información acerca de los mecanismos que regulan el proceso de maduración, existe interés en el tema y se realizan estudios que están generando información valiosa.
Como resultado de esta búsqueda exhaustiva de información relacionada con los cambios biquímicos en la maduración de los frutos durante su manenejo poscosecha, se permite una actualización de lo que se hace en investigación sobre el tema, cuya información servirá para que los investigadores biotecnólogos y fitomejoradores generen conocimiento o propongan materiales vegetales sobresalientes con una técnica de manejo postcosecha mas efectiva y aplicable, lo que impactaría en la economía de países cuya principal actividad es la agricultura.











 texto en
texto en 



