Introducción
Existen evidencias de que los reguladores de crecimiento incrementan el tamaño de fruto partenocárpico en mango (Ogata et al., 2010; Pérez et al., 2015). Diversos estudios coinciden que el incremento sucede al modificar el patrón de distribución de fotosintatos, específicamente por un aumento en la concentración de azúcares, en frutales como vid (Pérez y Gómez, 2000), pera ‘Kousui’ (Zhang et al., 2007) y cítricos (Agusti et al., 2002; Khalid et al., 2012). Sin embargo, en arándano cv. Beckyblue rabbiteye, la aplicación de giberelinas (GAs) no modificó el patrón de distribución, lo que indicó que el tamaño de frutos tanto polinizados como tratadosconAG3 no dependió de la capacidad para acumular azúcares (Cano y Darnell, 1997a).
En frutales, la relación fuente-demanda se relaciona con crecimiento de fruto y productividad del cultivo (Goldschmidt, 1999). Esta relación influye también en los niveles de azúcares como glucosa, fructosa y sacarosa que son sintetizados en hojas y se mueven a través del floema hacia los órganos no fotosintéticos o demandantes de la planta, entre ellos el fruto. Desde tiempo atrás se conoce que sacarosa es el principal azúcar transportado y que su transporte por floema, depende del gradiente de concentración entre los sitios de carga y descarga (Avigad, 1982). Sacarosa una vez descargada del floema en los sitios de demanda, puede entrar en las células del fruto por dos rutas, vía simplasto a través de plasmodesmos o apoplasto vía pared celular.
En mango hay pocos trabajos sobre el contenido de carbohidratos en frutos en desarrollo. En el cultivar Irwin durante el desarrollo de fruto (90-110 días después de floración; la última fecha correspondió a madurez fisiológica) el contenido de fructosa incrementó de 12.8 mg g-1 de peso fresco a 20.6 mg, después de cosecha incrementó a aproximadamente 30 mg y permaneció estable hasta madurez de consumo. El contenido de glucosa se mantuvo estable entre 10 mg g-1 y disminuyó después de cosecha. El contenido de sacarosa fue más bajo que glucosa y fructosa durante el desarrollo; no obstante, después de cosecha hasta madurez de consumo presentó un fuerte incremento de 5.9 hasta 82 mg g-1.
El contenido de almidón fue alto durante el desarrollo (≈50 mg g-1) y disminuyó después de cosecha hasta prácticamente desaparecer (Wei et al., 2013). En mango ‘Keitt’, Bernardes et al. (2008) observaron acumulación de almidón durante el desarrollo del fruto y mencionan que es la fuente más probable de carbón para la síntesis de azúcares solubles. Aparentemente, glucosa y fructosa pueden ser utilizadas tanto para sintetizar almidón como para respiración. Durante el crecimiento del fruto, hay un baja cantidad de sacarosa debido a la hidrolisis de este disacárido importado de las hojas, para proporcionar el carbono demandado durante el desarrollo (Bernardes et al., 2008).
La mayoría de los estudios en el contenido de carbohidratos en mango, son enfocados principalmente a poscosecha. Durante esta etapa, la degradación de almidón está altamente correlacionada con la acumulación de sacarosa, concluyendo que es el principal azúcar en mango (Castrillo et al., 1992; Bernardes et al., 2003; Bernardes et al., 2008; Wei et al., 2013).
Por otro lado, en muchos frutales la producción de células antes de floración e inmediatamente después de polinización/fecundación es el primer factor que impulsa el crecimiento temprano del fruto. Mientras que la expansión o alargamiento celular es un importante facilitador del crecimiento de órganos, un mayor crecimiento del fruto especialmente durante la etapa tardía del desarrollo es a menudo alcanzado (Johnson et al., 2011).
Variaciones en tamaño de frutos está asociado con diferencias en el número y tamaño de células, frutos grandes se relacionan con un alto número de células en muchos frutos como durazno (Scorza et al., 1991), fresa (Cheng y Breen, 1992), Olivo (Rapoport et al., 2004), cereza (Olmstead et al., 2007) y tomate (Bohner and Bangerth, 1988; Bertin et al., 2003; Tanksley, 2004; Bertin et al., 2009). Se demostró que los reguladores de crecimiento inducen amarre y desarrollo de frutos partenocárpicos, afectando división y alargamiento celular.
En arándano cv. Beckyblue las diferencias en el tamaño final de frutos polinizados y frutos partenocárpicos tratados con AG3, fueron debidas al alargamiento celular más que al número de células (Cano y Darnell, 1997b). En vid ‘Sultana’ la aplicación de AG3 (45 mg L-1) ocho días después de floración incrementaron el tamaño de frutos sin semilla al incrementar división y alargamiento celular (Pérez y Gómez, 2000). Mientras que en pera ‘Kousui’ un incremento en tamaño de fruto fue en respuesta a la aplicación exógena de AG3+4 y estuvo asociado con un incremento en el tamaño de células del mesocarpio (Zhang et al., 2006).
En frutos de mango, no existen a la fecha trabajos al respecto y menos aún en frutos partenocárpicos de ‘Ataulfo’. Por lo anterior, el objetivo del presente estudio fue determinar el efecto de reguladores de crecimiento en la acumulación de azúcares y en el número y tamaño de células en frutos de mango ‘Ataulfo’.
Materiales y métodos
El estudio se realizó en 2014 en Atonalisco, municipio de Tepic, Nayarit (21° 18’ latitud norte y 104° 53’ longitud oeste, 450 msnm). Se seleccionó un huerto comercial de mango ‘Ataulfo’/criollo regional, con 80% de incidencia de frutos partenocárpicos (PRT). Los árboles fueron de 8 años establecidos a 5 × 5 m entre hilera y árbol, respectivamente. El huerto se manejó con riego por gravedad (uno cada mes a partir de febrero hasta abril), poda (despunte de aproximadamente 50 cm y eliminación de ramas centrales) y fertilización con 2 kg de Triple 17 por árbol al inicio de la temporada de lluvias (junio) y 2 kg de fertilizante orgánico (gallinaza) por árbol aplicado en septiembre
Se evaluaron tres tratamientos. En el tratamiento 1, se aplicó 50 mg L-1 de TDZ a los 0 días después de plena floración (DDF) combinado con tres aplicaciones de AG3 a los 15+30+45 DDF. El tratamiento 2 correspondió a la aplicación de TDZ+AG3 (50 mg L-1 de c/u) a los 15+30+45+60 DDF. Se utilizó un testigo. Trabajos anteriores indicaron que estas dosis incrementaron el tamaño de fruto (Pérez et al., 2015). Las aspersiones se efectuaron a punto de goteo entre 8:00 - 10:00 am mediante bombas aspersoras motorizadas. Como fuente de TDZ se utilizó el producto comercial Revent® y para el AG3 se utilizó Progibb®. Se usó 1 mL L-1 de agua de surfactante (Inex®) y urea foliar al 1% como penetrante. El testigo se asperjó con agua + surfactante y urea, el pH de las soluciones se ajustó a 5.8 con ácido clorhídrico (HCl).
Las variables evaluadas fueron: longitud y diámetro de frutos muestreados, contenido de carbohidratos y número y tamaño de célula.
Longitud y diámetro de fruto. Se registró la longitud y diámetro de fruto cada 15 días, iniciando a partir de etapa I de lento crecimiento del fruto (15 DDF) hasta etapa III que corresponde a un crecimiento acelerado del mismo (105 DDF, madurez fisiológica). Para ello, se seleccionaron cuatro inflorescencias por árbol y se marcaron hasta cuatro frutos partenocárpicos por cada inflorescencia, solamente uno de ellos fue medido. Se evaluó utilizando un vernier digital (Control Company).
Determinación de carbohidratos. En cada tratamiento, se realizaron muestreos de frutos a los 15, 30, 45, 60, 90 y 105 días después de plena floración (DDF), el último muestreo se realizó al momento de la cosecha (madurez fisiológica). En el primer muestreo se tomaron 10 frutillos de cada repetición (aproximadamente 5 g), en los muestreos posteriores se tomaron dos frutos partenocárpicos y dos polinizados por repetición y en el muestreo final, un fruto de cada uno por repetición. Estos fueron transportados en hielera al laboratorio. De cada fruto se tomó una muestra de aproximadamente 5 g de pulpa de la parte media del fruto, las muestras tanto de frutos partenocárpicos como polinizados, se homogeneizaron por separado y se formaron cuatro repeticiones por cada tratamiento y fueron almacenadas a -20 °C hasta su análisis.
Siguiendo la metodología utilizada por Cano y Darnell (1997a), con ligeras modificaciones, de cada tipo de fruto y repetición se tomó 1 g de pesos fresco (pf) de pulpa, por separado y fue molido con nitrógeno líquido. Para la extracción se utilizó etanol al 80% (10 mL) a ebullición por 2min. Se agregó 100 mg de manitol como un estándar interno. El extracto se centrifugó a 3 000 rpm y el sobrenadante fue decantado y el residuo fue re-extraído dos veces más. Al sobrenadante se le agregó cloroformo (3 mL), se centrifugó a 2 000 rpm durante 3 min a 4 oC. La fase acuosa se rescató y fue secada al vacío, resuspendida con agua y pasada a través de resinas de intercambio iónico (Dowex-1 y Dowex-50). El sobrenadante final fue secada al vacío, resuspendido con agua grado HPLC y filtrado a través de un filtro con malla de 0.45 µm.
El contenido de glucosa, sacarosa y fructosa se determinó mediante cromatografía líquida de alta resolución HPLC (por sus siglas en inglés). La muestra fue inyectada dentro de un Bio-Rad HPLC (Cambridge, MA), se utilizó una columna de intercambio catiónico Bio-Rad Aminex® HPX-87C con las siguientes condiciones de medición: flujo 0.6 mL min-1, temperatura en columna 80 °C, temperatura de celda de detección 45 °C y fase móvil, agua grado HPLC. Se inyectó un volumen de 20 µl.
Tamaño y número de células. En los mismos tratamientos, se realizaron muestreos de frutos partenocárpicos a los 15, 30 y 45, días después de plena floración (DDF). En cada etapa de muestreo se tomaron tres frutos por repetición para un total de 12 frutos por tratamiento. Solo en la etapa de 45 DDF se muestrearon 12 frutos partenocárpicos y 12 polinizados por tratamiento. En el primer muestreo los frutos fueron colocados inmediatamente en FAA (10% (v/v) de formaldehido, 5% ácido acético glacial; 50% etanol al 100% y 35% agua destilada). En los siguientes muestreos se tomó una porción de epicarpo + mesocarpo de la parte media del fruto y se fijaron en FAA de la misma manera que en el primer muestreo. Las muestras fueron deshidratadas en series graduales de alcohol y xilol para terminar con xilol 100%. Posteriormente se fijaron en parafina a 60 °C. Se realizaron cortes anatómicos (8 µm) usando un micrótomo rotatorio (American Optical, USA), los cortes fueron teñidas con safranina y verde fijo.
El número y tamaño se determinó usando microscopia (Stereomaster digital zoom high -resolution microscope; Fisher Scientific, Pittsburgh, PA) y proyección de imagen tomada de la sección transversal del fruto (40X). Para el número de células, se delimitó un área de 15 mm2 en cada una de los cortes, utilizando el sowtware ImageTool ver 3 y se contó el número de células proyectando la imagen. El área de la sección transversal del fruto se calculó midiendo el diámetro del mismo y utilizando la ecuación para el área de una elipse. Para calcular el número de células del área transversal del fruto se utilizó la formula usada por Cano y Darnell (1997b).
Para determinar el tamaño se consideró el área delimitada (15 mm2) y se midieron 20 células del mesocarpo (cercanas a exocarpo) en cada sección, utilizando el software ImageTool 3.0. El área de la sección transversal fue determinada midiendo el diámetro de la célula en dos direcciones y usando la ecuación para el área de una elipse (Área = πab; siendo a y b los semiejes mayor y menor de la elipse.
Se utilizó un diseño experimental completamente al azar, se evaluaron tres tratamientos con cuatro repeticiones y un árbol como parcela útil.
Se llevaron a cabo análisis de varianza por fecha de muestreo y comparaciones múltiples de medias de acuerdo a la prueba de Tukey a una p≤ 0.05. Se utilizó el programa SAS versión 9.2 (SAS, 2008).
Resultados
Tamaño de fruto
En todos los tratamientos, el tamaño del fruto (longitud y diámetro) en la etapa I, fue menor a 1 cm. En la etapa II de rápido crecimiento (45 DDF), la longitud de frutos de T1 fue de 5.1 cm y en frutos de T2 la longitud fue de 5.3 cm, siendo estadísticamente igual al tratamiento anterior (Figura 1a ). Los frutos testigos presentaron un longitud de 4.1 cm. En la etapa final de crecimiento (etapa III), la longitud fue de 6.8 y 7.2 cm en los tratamientos T1 y T2, respectivamente; en frutos testigo fue de 5.1 cm. A los 105 DDF, el diámetro varió de 3.4 en el testigo), a 4.9 en T2 (Figura 1b), el testigo presentó los frutos de menor tamaño.
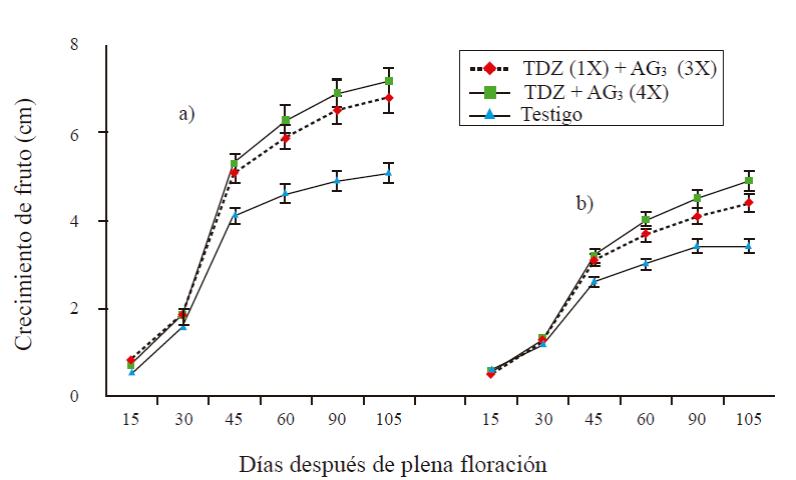
Figura 1 Longitud (a) y diámetro (b) de frutos partenocárpicos con y sin aplicación de regulador de crecimiento. 1X= una aplicación a 0 DDF; 3X= tres aplicaciones a 15+30+45 DDF; 4X= cuatro aplicaciones a 15+30+45+60. Las barras en cada punto representan el promedio de 16 frutos por tratamiento ± error estándar.
Acumulación de azúcares
En frutos partenocárpicos no hubo diferencias significativas entre tratamientos en el contenido de sacarosa y glucosa en las primeras etapas de desarrollo (15, 30 y 45 DDF), a excepción de fructosa. En frutos con una aplicación de TDZ (50 mg L-1) cero DDF + tres aplicaciones de AG3 a los 15+30+45 DDF (T1), el contenido de fructosa fue de 1.03 mg g-1 de peso fresco (pf) a los 15 días DDF, disminuyó a 30 y 45 días, se mantuvo ligeramente alto de 60 y disminuyo a 105 DDF (Figura 2A). En frutos con aplicación de TDZ+AG3 (50 mg L-1 de c/u) a los 15+30+45+ 60 DDF (T2), el contenido a los 15 DDF fue de 0.5 mg g-1 de pf, a los 30 DDF fue de 0.73 mg g-1 de pf y se mantuvo estable a los 60 y 105 DDF. En frutos testigo, el contenido se mantuvo en ≈0.8 mg g-1 de pf durante el desarrollo de fruto a excepción de 45 DDF que presentó un contenido de 0.6 mg g-1 de pf (Figura 2a).
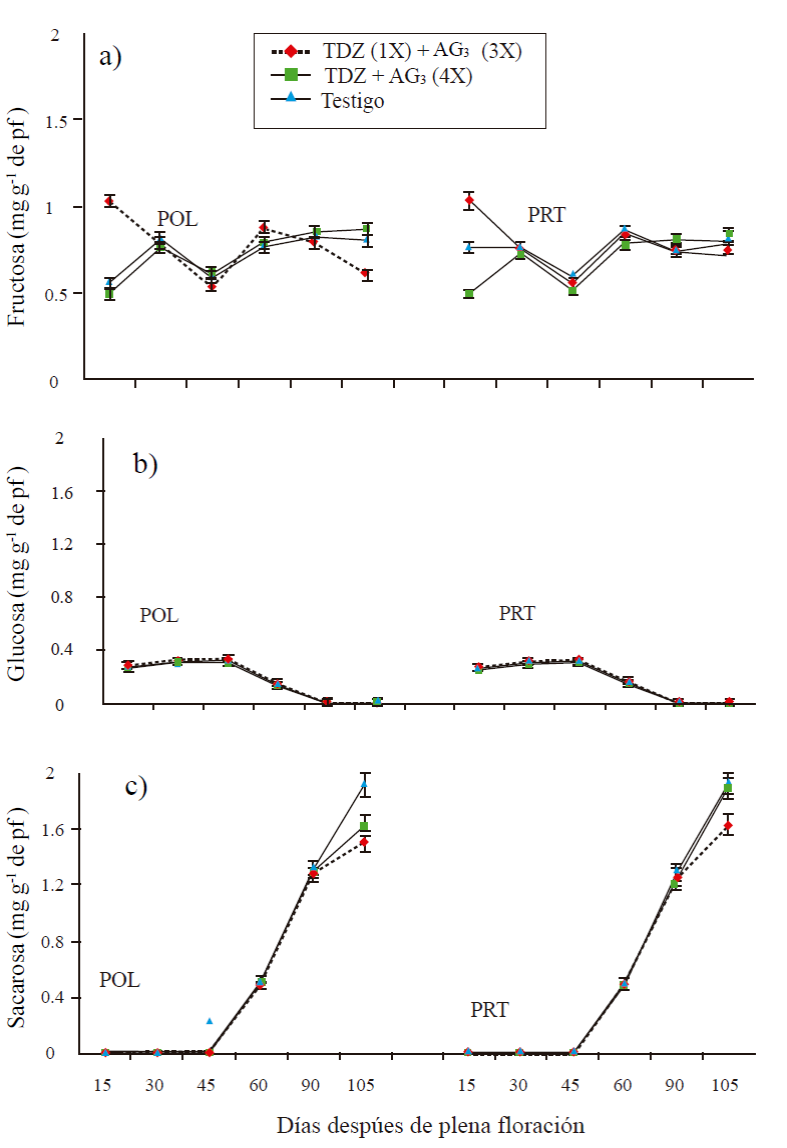
Figura 2 Contenido de fructosa (a), glucosa (b) y sacarosa en frutos partenocárpicos (PRT) y polinizados (POL) de mango ‘Ataulfo’. 1X= una aplicación a 0 DDF; 3X= tres aplicaciones a 15+30+45 DDF; 4X= cuatro aplicaciones a 15+30+45+60 DDF. Las barras en cada punto representan el promedio de cuatro repeticiones por tratamiento ± error estándar.
El contenido de glucosa se mantuvo estable entre 0.2 y 0.3 mg g-1 de pf durante las primeras etapa de desarrollo y disminuyó a los 60 y 105 DDF, el comportamiento fue igual entre tratamientos (Figura 2b). En todos los tratamientos, sacarosa mantuvo a niveles estables en su contenido durante 15, 30 y 45 DDF (< a 0.1 mg g-1 de pf), para incrementar a partir de los 60 DDF, hasta alcanzar su máximo contenido a los 105 DDF (mostrando diferencias significativas entre tratamientos en esta etapa (Pr= 0.004 a 60 DDF y Pr≤ 0.0001 a los 105 días). En la última etapa el contenido varió de 1.6, 1.9 y 2 mg g-1 de pf, para T1, T2 y T3, respectivamente, T2 y T3 fueron estadísticamente iguales con un alto contenido de sacarosa, respecto a T1 (Figura 2c).
En frutos polinizados, los resultados fueron muy similares a los encontrados en frutos partenocárpicos (Figura 2a, 2b, y 2c). No hubo diferencias significativas entre tratamientos, ni entre época de muestreo. El contenido de glucosa varió de 0.3 mg g-1 de pf en las primeras etapas para disminuir a los 60 y 105 DDF. Fructosa presentó diferencias entre tratamientos en las etapas muestreadas. Sacarosa se mantuvo en niveles menores a 0.1 mg g-1 de pf a los 15, 30 y 45 DDF, posteriormente se incrementó a partir de 60 DDF de aproximadamente 0.5 mg g-1 de pf hasta 1.5, 1.6 y 2 mg g-1 a los 105 DDF en los tratamientos T1, T2 y T3, respectivamente, mostrando diferencias significativas entre tratamientos (Pr≤ 0.004) en esta última etapa.
Número y tamaño de células
Quince días después de floración, los frutos tratados con una aplicación de TDZ (50 mg L-1) a cero DDF + tres aplicaciones deAG3 a los 15+30+45 DDF (T1) tuvieron 772 células en un área de 15 mm2, el resto de los tratamientos tuvo ≈549 y 474 células (Figura 3). A los 30 DDF el número varió de 2 878 a 3 262 células mm-2, el mayor número correspondió a T1 pero estadísticamente no fue diferente a T2 ni testigo. A los 45 DDF, el número de células varió de 3 526 a 4 603 mm2, T1 presentó el mayor número aunque fue estadísticamente igual al encontrado en T2, pero T3 mostró en menor número de células. Desde los 15 y hasta los 45 días el T1 numéricamente fue superior pero estadísticamente solo a los 45 DDF fue diferente al testigo.
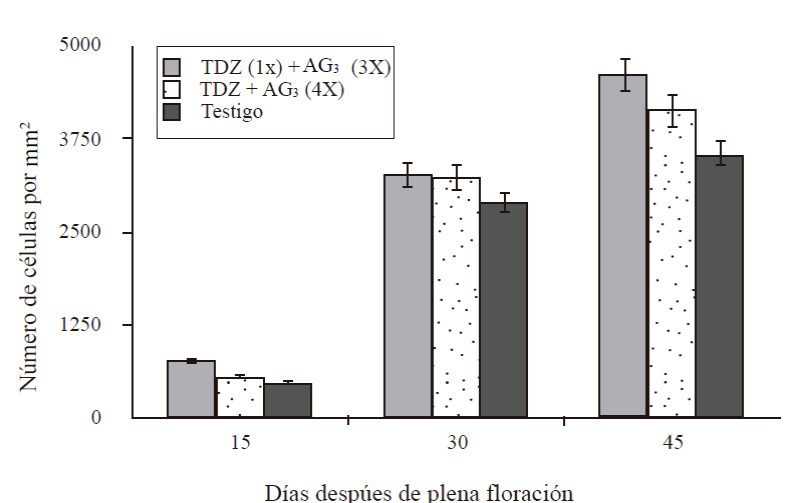
Figura 3 Número de células de la sección transversal del mesocarpo de frutos partenocárpico en desarrollo de mango ‘Ataulfo’. 1X= una aplicación a 0 DDF; 3X= tres aplicaciones a 15+30+45 DDF; 4X= cuatro aplicaciones a 15+30+45+60 DDF. Las barras en columna representan el promedio de 12 secciones por tratamiento ± error estándar.
Se observó una variación en el tamaño de la célula, incrementándose conforme el desarrollo del fruto. A 15 DDF, el tamaño de las células fue entre 10 mil µm2 en frutos tratados con una aplicación de TDZ a cero DDF + tres aplicaciones de AG3 a 15+30+45 DDF (T1), y 15 mil µm2 en los tratados con cuatro aplicaciones de TDZ+AG3 a 15+30+45+60 DDF (T2) y en testigo (Figura 4). A 30 DDF, el mayor tamaño correspondió T2 (25 mil µm2), T1 y T3 tuvieron un tamaño de 15 y 18 mil µm2, respectivamente. El tamaño incrementó vigorosamente a los 45 DDF de 76, 84 en T3 hasta 108 mil µm2 en frutos de T2, T2 presentó las células más grandes seguido por T1; no obstante, este último tratamiento no fue significativamente diferente al testigo. En esta misma fecha, el tamaño de células en frutos polinizados varió entre 134 y 147 mil µm2 (Figura 5). Frutos partenocárpicos con cuatro aplicaciones de TDZ + AG3 a 15+30+45+60 DDF, tuvieron células de 108 mil µm2 y los polinizados con la misma aplicación de regulador tuvieron células de 147 mil µm2.
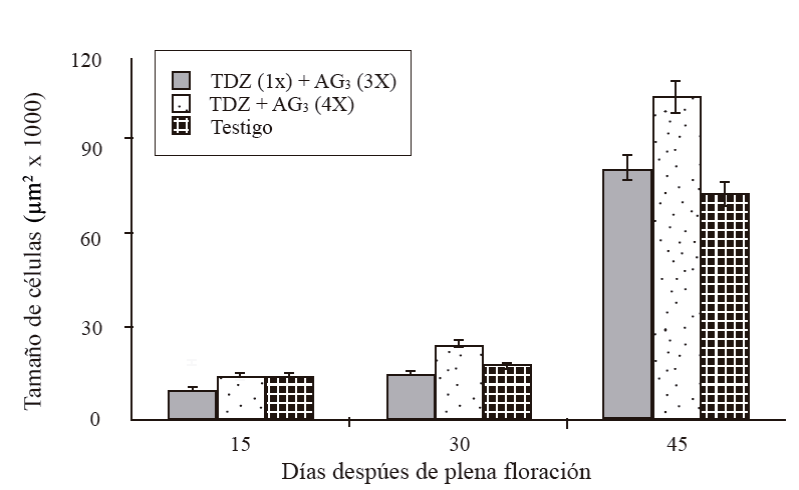
Figura 4 Tamaño de células de la sección transversal del mesocarpo de frutos partenocárpicos en desarrollo de mango ‘Ataulfo’. 1X= una aplicación a 0 DDF; 3X= tres aplicaciones a 15+30+45 DDF; 4X= cuatro aplicaciones a 15+30+45+60 DDF. Las barras en columna representan el promedio de 20 células por tratamiento ± error estándar.
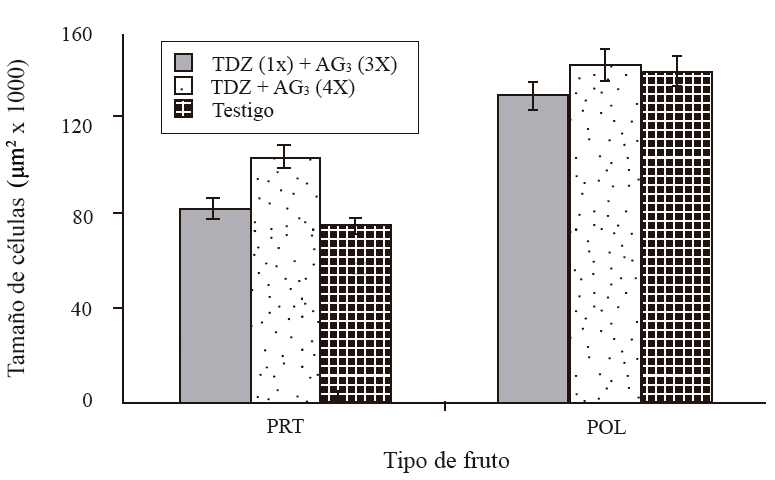
Figura 5 Tamaño de células de la sección transversal del mesocarpo de frutos partenocárpico y polinizados de mango ‘Ataulfo’, 45 días DDF. 1X= una aplicación a 0 DDF; 3X= tres aplicaciones a 15+30+45 DDF; 4X= cuatro aplicaciones a 15+30+45+60 DDF. Las barras en columna representan el promedio de 12 secciones por tratamiento ± error estándar.
Discusión
Los reguladores de crecimiento incrementaron el tamaño de frutos partenocárpicos tanto en longitud como diámetro. Se logró un incremento de 20% con T1 y de 23% con T2, respecto a la longitud de frutos sin regulador (T3). En frutales, de acuerdo a varios autores, el aumento en tamaño es debido a que los reguladores incrementan la fuerza de la demanda modificando el patrón de distribución de fotosintatos (Pérez y Gómez, 2000; Agusti et al., 2002; Zhang et al., 2007; Khalid et al., 2012).
Los resultados de este estudio no coinciden con los reportes anteriores, ya que el contenido de azúcares fue similar a los frutos sin regulador de crecimiento, por lo que en mango ‘Ataulfo’ el tamaño logrado en frutos partenocárpicos no estuvo en función de la acumulación de azúcares; lo que, coinciden con los resultados encontrados por Cano y Darnell (1977a) donde el tamaño de frutos de arándano tanto polinizados como tratados con AG3 no dependió de la capacidad para acumular azúcares. Lo anterior indica que la respuesta de la distribución de los fotosintatos está en función del tipo de fruto y la especie.
En frutos polinizados y partenocárpicos, glucosa mostró bajo contenido durante las primeras etapas de desarrollo y descendió en la etapa de rápido crecimiento de fruto, mientras que fructosa permaneció ligeramente inestable durante todo el crecimiento, mostrando niveles ligeramente más altos que glucosa. Los resultados coinciden con los obtenidos en mango ‘Irwin’ por Wei et al. (2013) y ‘Keitt’ por Bernardez et al. (2008) mencionando que en las primeras etapas de desarrollo, glucosa y fructuosa pueden ser utilizadas tanto para sintetizar almidón como para respiración.
El contenido de sacarosa en ambos tipos de fruto, fue prácticamente insignificante en las primeras etapas de desarrollo (15 - 45 DDF; división y elongación celular) y se incrementó a partir de los 60 DDF logrando un incremento de casi 100% en madurez fisiológica. Diferentes estudios muestran que durante las primeras etapas de desarrollo, sacarosa es transportada de las hojas a frutos en desarrollo, es hidrolizada por enzimas como sacarosa sintasa al entrar a la célula vía simplasto e invertasa ácida o de pared celular al entrar vía apoplasto, para proporcionar el carbono demandado durante el desarrollo (Koch, 2004; Bernardes et al., 2008). Al respecto, Wei et al. (2013) reportan una alta actividad de invertasa ácida en frutos en desarrollo (etapa I) de mango ‘Irwin’.
Por otro lado, independientemente del tipo de fruto y la aplicación de reguladores, sacarosa fue el azúcar de mayor presencia en frutos con madurez fisiológica. Lo anterior, indica que fue el principal azúcar desde madurez fisiológica hasta maduración (postcosecha) y es el responsable de la dulzura del fruto. Los resultados encontrados coinciden con los obtenidos por Castrillo et al. (1992); Bernardes et al. (2008) y Wei et al. (2013), en mango ‘Haden’, ‘Keitt’ e ‘Irwin’, respectivamente. De acuerdo con estos autores, en la etapa de maduración la degradación de almidón en fruto está altamente correlacionada con la acumulación de sacarosa. Por otro lado, diversos autores coinciden que esta etapa la síntesis de sacarosa es debido a la actividad de la enzima sacarosa fosfato sintasa (Hubbard et al., 1991; Castrillo et al., 1992; Wei et al., 2013).
Por otro lado, el número de células se incrementó en frutos partenocárpicos independientemente de la aplicación de reguladores en la etapa I y II del desarrollo del fruto, con una tendencia hacia un incremento acorde al desarrollo del mismo. En la etapa I de desarrollo de fruto (15 DDF), se logró un incremento de 30% en T1 (una aplicación de TDZ en floración y tres aplicaciones de AG3 a 15+30+45 DDF), con relación al testigo. Lo que sugiere la acción del TDZ (citocinina) en división celular durante esa etapa. Al inicio de la etapa II (30 DDF) el incremento fue de 12% respecto al testigo con el mismo tratamiento, pero al final de esa etapa (45 DDF) la diferencia entre este y el testigo fue de aproximadamente 24%.
Los resultados indican que la aplicación de citocininas (TDZ) fue clave al momento de floración para inducir mayor división celular y por lo tanto mayor número de células, lo que probablemente se asocia con el tamaño logrado en frutos partenocárpicos. Los resultados coinciden con lo reportado en diversos frutales, donde hay evidencias que los reguladores de crecimiento inducen amarre y desarrollo de frutos partenocárpicos, afectando división y alargamiento celular (Pérez y Gómez, 2000; Zhang et al., 2006).
En general, el periodo de división celular del mesocarpo fue de 15 hasta 30 DDF (Figura 6), pero en el mesocarpo de frutos testigo se observó menor división a 30 DDF (Figura 6f). En la Figura 6a, se puede observar un mayor número de células a 15 DDF provocado por la acción de TDZ, respecto testigo Figura 6c en la misma etapa.
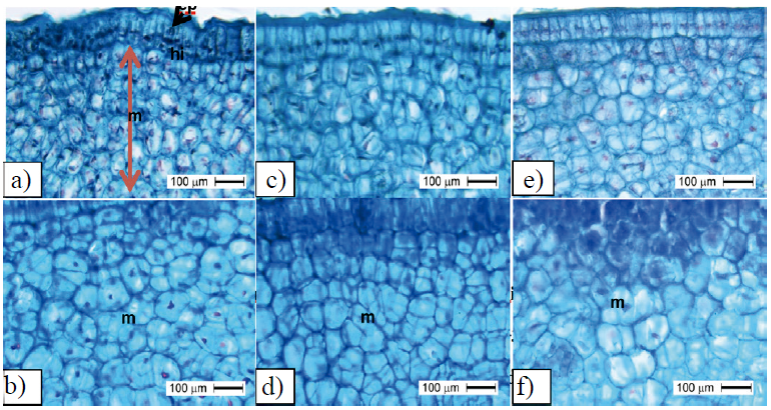
Figura 6 Número de células en mesocarpo de frutos partenocárpicos de mango ‘Ataulfo’. Con una aplicación de TDZ a 0 DDF + tres aplicaciones de AG3 a 15+30+45 DDF en la etapa I de rápido crecimiento de fruto (a) e inicio de etapa II (b); número de células en frutos tratados con cuatro aplicaciones de TDZ+AG3 a 15+30+45+60 DDF en la etapa I de rápido crecimiento de fruto (c) e inicio de etapa II (d); número de células en frutos sin regulador de crecimiento en la etapa I de rápido crecimiento de fruto (e) e inicio de etapa II (f); ep= epicarpio, hi= hipocarpio, m= mesocarpo.
Con relación al tamaño de células, durante la etapa I, los frutos de T2 (cuatro aplicaciones de TDZ+AG3 a 15+30+45+60 DDF), tuvieron numéricamente células más grandes pero significativamente iguales a testigo. En el mismo tratamiento, a partir del inicio de la etapa II (30 DDF) y hasta el final de la etapa (45 DDF) el tamaño se incrementó 30% con relación al testigo y 23% respecto a los frutos de T1 (una aplicación de TDZ en floración y tres aplicaciones de AG3 a 15+30+45 DDF). El incremento alcanzado en el tamaño de células de frutos partenocárpicos puede explicar, al igual que el logrado en número de células, el aumento en longitud y diámetro de fruto y por ende en el tamaño del mismo, indicando que las aplicaciones repetidas de TDZ y AG3 estimularon la elongación celular y por lo tanto el tamaño del fruto.
Los resultados coinciden con los obtenidos en frutales como vid (Pérez y Gómez, 2000) y en pera ‘Kousui’ (Zhang et al., 2007), donde el incremento en tamaño de fruto lo asociaron con un incremento en el tamaño de células del mesocarpo por la acción de GAs. En arándano, las diferencias en tamaño de fruto fueron asociadas principalmente a diferencias en tamaño de células, pero el número de células tuvo una menor relación (Cano-Medrano y Darnell, 1997b).
Por otro lado, aun cuando se incrementó el tamaño de frutos partenocárpicos, éste no superó al de los polinizados. La diferencia fue en que, aunque los reguladores estimularon división y elongación celular en frutos partenocárpicos, el tamaño de las células en frutos polinizados fue mayor (Figura 7a).
Conclusiones
La aplicación de TDZ y AG3, no incrementó la fuerza de la demanda en frutos partenocárpicos, de ‘Ataulfo’, por lo que el incremento logrado en tamaño de los mismos, no está asociada con la distribución de fotosintatos.
La sacarosa fue el principal azúcar en frutos de mango ‘Ataulfo’ en la etapa III del desarrollo.
El incremento logrado en el tamaño de frutos partenocárpicos estuvo asociado a una mayor división y elongación celular.
En frutos partenocárpicos, TDZ (citocinina) asumió un papel importante en división celular mientras que AG3 lo tuvo en expansión celular.
Los frutos polinizados tienen células más grandes que los partenocárpicos.











 texto em
texto em 



