Introducción
Actualmente, la identificación, cuantificación y expresión de genes relacionados con floración constituye una herramienta importante para entender el proceso desde inducción, iniciación y diferenciación floral en muchos frutales (Nishikawa et al., 2007; Muñoz et al., 2012). En mango, varios estudios mencionan que las hojas maduras son capaces de percibir el estímulo ambiental para floración y producir grandes cantidades de “florígero” bajo condiciones inductivas y transportarlo al meristemo apical desde una distancia de hasta 100 cm en condiciones subtropicales y de 52 en tropicales (Davenport y Ying, 2004; Davenport et al., 2006; Ramírez y Davenport, 2010). La inducción floral se manifiesta por la generación de este “florígero” en la hoja, aparentemente desconocido.
En Arabidopsis thaliana, una especie anual, se han identificado cuatro rutas que permiten la floración; fotoperiodo, vernalización, giberelinas y autónoma, y su relación a nivel genético ha sido muy estudiado (Wilkie et al., 2008). En la ruta del fotoperiodo que desencadena la floración en Arabidopsis, participa el reloj circadiano que conduce a que muchos metabolitos y procesos moleculares, como la expresión de genes, varíen a lo largo del día. Constans (CO), gen clave en el control de la floración de esta especie, proporciona el vínculo entre el mecanismo que detecta la luz del día y la producción de la señal de floración. CO es entonces un factor de transcripción que activa el gen flowering locus T (FT) el cual genera la señal de floración mediante su transcripto de FT mRNA que se traduce en la proteína FT (Corbesier et al., 2007; Zeevaart, 2008).
Esta proteína es considerada como el supuesto “florígero” mencionado hipotéticamente durante mucho tiempo como el responsable de la floración en muchas especies y se menciona que un mecanismo similar en frutales, incluyendo el mango (Wilkie et al., 2008), podría estar envuelto en la inducción floral (Brunner y Nilsson, 2004).
Los estudios realizados en Arabidopsis han servido como base para estudios moleculares en especies frutales. En tropicales, los estudios generalmente incluyen una relación de la expresión del gene con la iniciación y desarrollo floral, ambiente y reguladores de crecimiento. En mandarina ‘Satsuma’ los niveles del gene homólogo FT incrementaron con temperaturas frías durante el tiempo de inducción floral (Nishikawa et al., 2007) y en naranjo dulce hay evidencias que los niveles de homólogos leafy (LFY) y apetala (AP1) incrementan durante y después de la inducción floral con temperaturas frías (Pillitteri et al., 2004).
En el híbrido transgénico de cítrico ( Citrus sinensis L. Osbeck x Poncitrus trifoliata L. Raf) una sobre-expresión de LFY y AP1 redujeron sustancialmente la fase juvenil, aunque la floración al parecer dependió del control ambiental (Peña et al., 2001). En Poncirus trifoliata la expresión de FT le confiere la floración temprana (Endo et al., 2005). Mientras que en mandarina ‘Moncada’ FT es inhibido por la carga de fruta (Muñoz et al., 2011).
En árboles de naranjo dulce ‘Salustiana’, se observó que las giberelinas inhibieron floración reprimiendo la expresión de los genes homólogos flowering locus T (CiFT), en hojas; mientras que el paclobutrazol (PBZ) incrementó la floración estimulando su expresión. La actividad de los homólogos terminal flower 1, flowering locus C, suppressor of overexpression of constans 1, y apetala 1 no fueron afectados por los reguladores (Muñoz et al., 2012).
En mango hay poca información al respecto, recientemente, un gene como el flowering locus T (FT) fue identificado y caracterizado. La secuencia de flowering locus T (MiFT) mostró una alta identidad al gene FT de otras plantas y su expresión incrementó en hojas bajo condiciones inductivas de floración (temperaturas bajas) y en árboles con baja producción de fruta. La aplicación de 250 mg L-1 de ácido giberélico (AG3) inhibió completamente la floración y la expresión de MiFT tanto en alta como en baja producción. En este estudio concluyen que MiFT es el factor clave en la floración del mango (Nakagawa et al., 2012).
De acuerdo a lo anterior, genes relacionados con el proceso de floración en plantas herbáceas como Arabidopsis, han servido como base para realizar estudios en frutales. En subtropicales y tropicales existen trabajos al respecto en cítricos pero en mango la información es muy escasa y nula en el caso de mango ‘Ataulfo’. En esta especie es necesario realizar estudios a nivel molecular para tratar de contrarrestar los efectos del clima en la inducción, diferenciación y brotación floral. Basado en lo anterior, el objetivo de este estudio fue cuantificar la expresión del gen flowering locus T (MiFT) de floración en mango ‘Ataulfo’ y su relación con ambiente y reguladores de crecimiento.
Materiales y métodos
El estudio se realizó durante el ciclo 2013-2014 con clima cálido (32-35/23-24 °C; día, noche) y presencia de lluvia durante los meses de octubre (122 mm), noviembre (161 mm) y diciembre (105 mm). Se seleccionó un huerto comercial de mango ‘Ataulfo’/criollo regional de seis años de edad, en el municipio de Santiago Ixcuintla, Nayarit. La distancia de plantación fue 3× 2.5m entre hilera y árbol, respectivamente y manejado en tipo seto. El huerto se manejó bajo un sistema de riego por goteo, poda lateral (despunte de aproximadamente 50 cm, solo en lado oriente y poniente) y fertilización con 2 kg de Triple 17 por árbol al inicio de la temporada de lluvias (junio) y 1 kg de fertilizante orgánico (gallinaza) por árbol aplicado en septiembre.
En dicho huerto, se seleccionaron 60 árboles de vigor uniforme, en los cuales se realizaron dos experimentos. Experimento 1. Expresión de MiFT en hojas tratadas con PBZ por efecto de época de muestreo y orientación en el árbol. Se aplicó una sola dosis (1X) de 2500mgL-1 de PBZ a 12 árboles, 30 días después de la poda (ddp). Como testigo, se colectaron brotes antes de la aplicación de PBZ (septiembre 30) y posteriormente a 60, 90, 120 y 150 días después de la aplicación (dda); cada mes, iniciando en noviembre 30 de 2013 a febrero de 2014 (inicio de floración). En cada fecha, 36 brotes fueron seleccionados de seis árboles por tratamiento asignados previamente para el muestreo y se tomaron 12 brotes en orientación norte (lado sombreado), 12 en oriente (lado soleado por la mañana) y 12 en poniente (lado soleado por la tarde). Las hojas fueron separadas, identificadas y almacenadas a -80 °C hasta su utilización para la extracción de ARN.
Experimento 2. Expresión de MiFT en hojas de Mango ‘Ataulfo’ por efecto de reguladores de crecimiento. Se evaluaron cuatro tratamientos. 1. La dosis de 500 mg L-1 de prohexadiona de calcio (P-Ca), en tres aplicaciones (3X) a 30+45+60 días después de la poda (ddp). 2. Una dosis de 2500 mgL-1 de PBZ en una sola aplicación (1X) 30ddp. 3. Una dosis de 200 mg L-1 deAG3, una aplicación (1X) a 120 ddp y 4. Testigo. En todos los casos, se asperjaron 12 árboles. Para los tratamientos con P-Ca y PBZ, se colectaron brotes emergidos a los 0 días después de la aplicación (dda) y posteriormente a 60, 90, 120 y 150 días después de la aplicación (dda); es decir, de noviembre 2013 a febrero 2014 (inicio de floración). En árboles asperjados con AG3 (noviembre 30, 2013) se colectaron brotes a los 0, 30 y 90 días después de la aplicación. En el testigo, los brotes se colectaron en fecha similar a los tratamientos P-Ca y PBZ. En cada fecha, 36 brotes fueron seleccionados de solo seis árboles (alrededor y parte media) por tratamiento asignados previamente para el muestreo. Al igual que el experimento anterior, las hojas fueron separadas, identificadas y almacenadas a -80 °C hasta su utilización para la extracción de ARN.
En ambos experimentos PBZ (Austar®) fue aplicado al suelo bañando el tallo principal a una altura de 30 cm de la base del suelo. En el segundo experimento, la solución de P-Ca (Apogee®) se preparó con agua corriente y se usó 1 ml L-1 de surfactante Inex®. P-Ca se aplicó al follaje a punto de goteo mediante bomba aspersora motorizada. La solución de AG3 se preparó con agua corriente y se usó urea foliar 1% como penetrante y 1 ml L-1 de surfactante Inex®. Los árboles testigo fueron asperjados con agua + urea + surfactante.
Las variables evaluadas en ambos experimentos fueron las siguientes:
1. Extracción, cantidad y calidad de ARN y cDNA. Para la extracción de ARN, se utilizó la metodología de Nakagawa et al. (2012). La extracción se hizo utilizando un Kit RNAqueous (Applied Biosystems). Para remover los fenoles, se utilizó el kit Plant RNA isolation Aid (Applied Biosystems), el cual fue agregado en el primer paso del procedimiento de extracción. Posteriormente la extracción fue tratada con TURBO DNA-free Kit (Applied Biosystems) para remover el DNA genómico y purificar y limpiar la muestra. La cuantificación y evaluación se calidad se realizó mediante espectrofotometría de UV (Thermo Scientific NanoDrop 2000).
Posterior a esto se procedió a la síntesis de ADN complementario; la primera hebra del cDNA fue sintetizado por retrotranscriptasa, usando SuperScript® VILO™ cDNA Synthesis Kit (Applied Biosystems). La cuantificación y evaluación fue similar a la del ARN.
2. Expresión relativa del gen MiFT. Posterior a la extracción de ARN y síntesis de ADN complementario cDNA (por sus siglas en inglés), la cuantificación de la expresión relativa (significa que el nivel del gen de interés en la muestra tratada representa sólo un (%) del nivel de gen endógeno) fue mediante PCR Tiempo Real, reacción en cadena de la polimerasa tiempo real (qPCR, por sus siglas en ingles), siguiendo la metodología de Nakagawa et al. (2012).
Los primers forward y reverse, empleados para la cuantificación y expresión del gen MiFT en mango ‘Ataulfo’, fueron los reportados por Nakagawa et al. (2012) y las secuencias de los primers fueron las siguientes:
El PCR tiempo real, fue realizado con Platinum® SYBR® Green qPCR SuperMix-UDG (Applied Biosystems) usando StepOne (Applied Biosystems) siguiendo las instrucciones del fabricante. Cada reacción contenía 12.5 µl de Platinum® SYBR® Green, 0.5 µl de cada uno de los primers forward y reverse, 0.5 µl de ROX, 9 µl de agua deionizada (dH2O), 2 µl de cDNA de la muestra. Las condiciones del termociclador fueron 95 °C por 30 s seguido de 40 ciclos de 95 °C por 5 s y 60 °C por 30 s. Se utilizó un gene factor de amplificador de mango (MiEF) como un control interno (endógeno). PCR tiempo real fue realizado en tres repeticiones y los niveles de transcripción fueron normalizados contra MiEF. El cálculo de la expresión relativa del gen se realizó mediante el método 2-ΔΔCT propuesto por Livak y Schmittgen (2001).
3. Número y tipo de crecimiento. En ambos experimentos y en los seis árboles restantes (sin muestreo de brotes) de cada tratamiento, se etiquetaron 30 brotes apicales árbol-1 emergidos después de la poda de verano (agosto 5, 2013); es decir, 180 por tratamiento. En estos brotes se registró el número y tipo de crecimiento (vegetativo, reproductivo e inactivo) emergido en la yema apical de los brotes durante el periodo de floración. Con estos datos, se calculó el porcentaje de brotes florales, vegetativos e inactivos, considerando el número de cada uno de ellos entre el total de brotes evaluados; por ejemplo número de brotes florales/total de brotes marcados.
4. Temperatura y precipitación. Los datos de temperatura fuerontomadosdelsensorcolocadoenelexperimentoanterior y los de precipitación de la estación Verdineño, ubicada a 2 km del huerto (Red de Estaciones Agroclimatológicas del estado de Nayarit).
En el experimento 1, se realizaron pruebas de normalidad Shapiro-Wilks, debido a los valores obtenidos de QR (cantidad relativa) no presentaron distribución normal. Se ajustaron con transformaciones y se analizaron bajo unl diseño experimental fue completamente al azar, con arreglo de tratamientos factorial (5x3), donde los factores fueron los siguientes: Fechas (septiembre, noviembre, diciembre, enero y febrero) y orientación en el árbol (lado oriente, poniente y norte). Se evaluaron 15 tratamientos, más un testigo, con tres repeticiones y se analizó con estadísticas no paramétricas, con la prueba de Kruskal-Wallis, que permitió comparación múltiples.
En el experimento 2, el diseño experimental fue completamente al azar, evaluando cuatro tratamientos con seis repeticiones, 30 brotes por repetición como parcela útil. Se usó la prueba de Tukey (p≤ 0.05) para comparación de medias. Se utilizó el programa SAS versión 9.2.
Resultados y discusión
Cuantificación y calidad de RNA
En general, la cantidad promedio de RNA en hojas maduras con PBZ (2 500 mg L-1, 1X a 30 ddp) fue de 44.7 ng µL-1 alcanzando una relación 260/280 de 1.96 en promedio. La cantidad promedio de cDNA fue 2103.6 ng µL-1 y una relación 260/280 de 1.87 (Cuadro 1). En hojas con P-Ca (500 mg L-1, 3X a 30+45+60 ddp) la cantidad de RNA fue de 42.3 ng µL-1, con una relación de 1.95 (260/280), mientras que la de cDNA fue de 2025 ng µL-1 y una relación de 1.87. Con AG3, la cantidad de RNA fue de 36.1 ng µL-1 y de 2006.7 el contenido de cDNA con una relación 260/280 de 1.92 y 1.85, respectivamente. En hojas sin regulador, se encontró una cantidad de 33.6 ng µL-1 de RNA y 2006.3 ng µL-1 de cDNA, la relación 260/280 fue de 1.89 y 1.85, respectivamente.
Cuadro 1 Cantidad y calidad de RNA y cDNA en Hojas de mango ‘Ataulfo’.
| Tratamiento | RNA (ng µl-1) | Relación (260/280z) | cDNA (ng µl-1) | Relación (260/280z) |
| PBZ 2 500 1X | 44.7 | 1.96 | 2 103.6 | 1.87 |
| P-Ca 500 3X | 42.3 | 1.95 | 2 025.5 | 1.87 |
| AG3 200 1X | 36.1 | 1.92 | 2 006.7 | 1.86 |
| Testigo | 33.6 | 1.89 | 2 006.3 | 1.85 |
| CV | 52.9 | 4.37 | 5.56 | 1.81 |
z= Longitud de onda para absorción de los ácidos nucleicos/proteínas (Luz UV).
Independientemente del experimento, la cantidad extraída de ARN en hojas de mango ‘Ataulfo’ fue suficiente para lograr una cantidad sobresaliente de cDNA una vez convertido mediante retrotranscriptasa, enzima que existe en la naturaleza como parte del mecanismo de replicación en virus y utiliza un tARN como oligonucleotido o primer (Falcon y Valera, 2007).
El ARN extraído fue de excelente calidad, de acuerdo a la relación 260/280 obtenida en el espectrofotómetro. La relación entre las lecturas obtenidas a 260 nm y 280 nm (OD260 /OD280) proveen un estimado de la pureza de los ácidos nucleicos. Los ácidos nucleicos tienen un máximo de absorción a una longitud de onda de 260 nm. A esta longitud por lo tanto, la absorción es un indicativo de la concentración, mientras que en la longitud 280 nm, la absorción muestra proteínas y compuestos fenoles. Las extracciones de ácidos nucleicos de buena calidad y pureza deben tener una relación 260/280 con valores entre 1.8 - 2, cantidades menores a estos significa que hay presencia de proteínas, fenoles u otros contaminantes que pudieran interferir con los resultados de los ensayos a realizar (Wilfinger et al., 1997; Anónimo, 2007). De igual manera la cantidad de cDNA obtenido fue de buena calidad sin contaminación de compuestos como los mencionados anteriormente. Esto permitió realizar de manera eficiente la qPCR para cuantificar la expresión del gen MiFT, en ambos experimentos.
Temperatura y precipitación
En 2013- 2014, la temperatura mínima en los meses de octubre y noviembre se mantuvo entre 23 y 24 °C, mientras que la máxima fue entre 32 y 35 °C, en diciembre la temperatura mínima descendió hasta 17 °C y en enero y febrero se mantuvo entre 15 y 18 °C. Se tuvo presencia de lluvias durante el mes de octubre y noviembre (122 y 161 mm, respectivamente), en diciembre la precipitación fue de 105 mm y hubo escasa lluvia en enero y febrero (Figura 1).
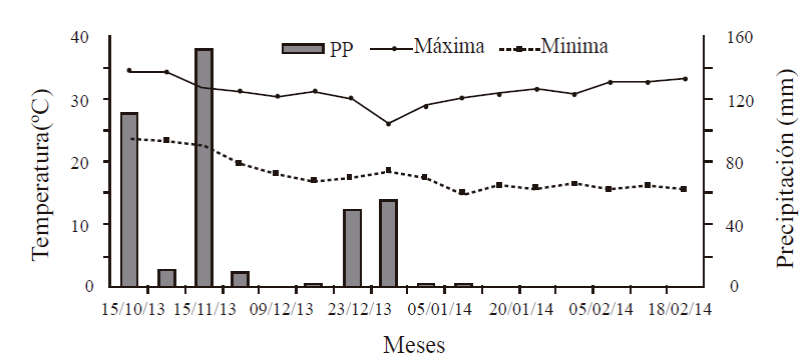
Figura 1 Temperatura máxima, mínima y precipitación presentadas durante el periodo de inducción, iniciación y brotación floral en mango ‘Ataulfo’.
Experimento 1. La expresión de MiFT por efecto de la época y orientación en el árbol. El análisis de varianza para la variable correspondiente QR, cantidad relativa de la expresión del gen de interés MiFT, mostró alta significancia para el intercepto y meses (Cuadro 2). Mientras que la comparación múltiple, con Kruskal-Wallis, de la expresión del gen MiFT de acuerdo a la orientación, mostró relación para el lado poniente y oriente (Cuadro 3).
Cuadro 2 Análisis de varianza para datos transformados (Ln X+1) de la expresión del gen.
| Efecto | SC | GL | CM | F | P |
| Intercepto | 42.86635 | 1 | 42.86635 | 637.4918 | 0 |
| Meses | 7.31809 | 4 | 1.82952 | 27.208 | 0 |
| Orientación | 9.67863 | 2 | 4.83932 | 71.9685 | |
| Meses*orientación | 32.51464 | 8 | 4.06433 | 60.4431 | |
| Error | 2.01727 | 30 | 0.06724 |
Cuadro 3 Comparación múltiple de la expresión del gen MiFT según la orientación en el árbol. Kruskal-Wallis.
| Orientación | Norte (N) | Oriente (O) | Poniente (P) |
| Norte (N) | 0.820157 | 1.862729 | |
| Oriente (O) | 0.820157 | 2.682885 | |
| Poniente (P) | 1.862729 | 2.682885 |
En la Figura 2, se muestran los resultados obtenidos en la expresión del gen de interés MiFT con relación al gen endógeno MiEF. Respecto a la época de muestreo, la expresión relativa de MiFT fue observada en todos los meses muestreados. La expresión varió de 0.30 hasta 3.4 respecto a MiEF. El mes de mayor expresión fue diciembre seguido de enero y febrero. Con relación a la orientación, la expresión relativa de MiFT fue en promedio de 0.81, 1.9 y 0.54 en el lado norte, oriente y poniente, respectivamente (Figura 2).
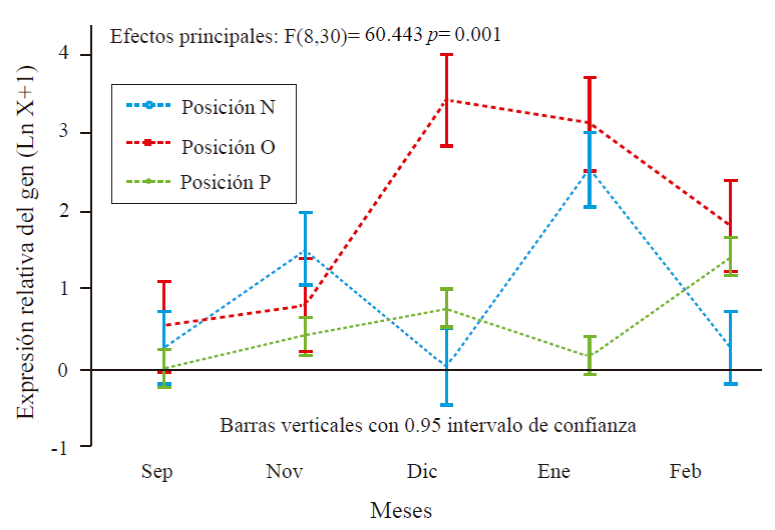
Figura 2 Expresión relativa de MiFT con relación a MiEF en hojas de mango ‘Ataulfo’ tratadas con PBZ. N, O y P, corresponden a norte, oriente y poniente del árbol.
Considerando la interacción se encontró que en el mes de septiembre la expresión fue MiFT fue de 0.25 y 0.53 en lado norte y oriente, respectivamente, en noviembre la expresión fue de 1.51, 0.8 y 0.4 en lado norte, oriente y poniente, en diciembre MiFT se expresó solo en lado oriente con 3.4 y poniente con 0.75, mientras que en enero la expresión fue de 2.5 y 0.15 en lado norte y poniente y de 3.1 en lado oriente. En febrero la expresión fue en lado norte, oriente y poniente de 0.25, 1.8 y 0.5, respectivamente.
En hojas tratadas con PBZ, la expresión de MiFT (gen de interés) fue observada en todos los meses de estudio, pero solo en hojas de brotes soleados durante la mañana se expresó en mayor cantidad respecto a las hojas de brotes soleado por la tarde y hojas completamente sombreadas. En hojas de brotes sombreados (lado norte), la expresión mayor expresión fue en los meses de noviembre y enero; pero fue mínima comparada con lado oriente. Lo anterior, indica que probablemente el gen MiFT está regulado por luz al expresarse en mayor cantidad del lado solado y una mínima expresión en lado norte donde los árboles siempre están sombreados por la unión de copas entre árboles (formación tipo seto).
Puede observarse que en el mes de septiembre (antes de la aplicación de PBZ), la expresión fue nula en hojas con orientación poniente, pero hubo una mínima expresión del gen en hojas soleadas del lado oriente; en los siguientes meses MiFT presentó una mínima expresión en hojas sombreadas probablemente por efecto del regulador PBZ, lo que dio lugar a que un pequeño porcentaje de brotes sombreados florecieran.
En manzano ‘Fuji’ (36° latitud norte, 139° longitud oeste y 747 msnm) no encontraron diferencias en la expresión del gen flowering locus T (MdFT1) (homólogo de MiFT) en yemas apicales de brotes sombreados y soleados pero la expresión de MiTFL1 (represor floral) fue mayor en brotes sombreados (Kittikorn et al., 2011), resultados que no coinciden con nuestro estudio, no obstante los resultados en manzano, se obtuvieron en diferente especie y tejido y el sombreo fue de solo 50%, y en el presente estudio realizado bajo condiciones de campo muy diferentes a las de manzano (21° latitud norte 105° longitud oeste, 150 msnm), al menos de lado norte, el sombreo fue cerca de 90 %.
La mayor expresión se encontró en diciembre y enero en lado soleado, lo que coincidió también con la presencia de temperaturas más frías y probablemente con el momento en que ocurrió la inducción e iniciación floral en mango, como lo reportado en mandarina ‘Satsuma’ por Nishikawa et al. (2007) donde el nivel del gen ortólogo flowering locus T (CiFT) incrementó con temperaturas frías durante el tiempo de inducción floral y en naranjo dulce LFY y AP1 incrementaron durante y después de la inducción floral (Pillitteri et al., 2004). Por otro lado, Nakagawa et al. (2012) identificaron un gene como el flowering locus T (MiFT) en hojas de árboles de mango ‘Irwin’ que desarrollaban bajo temperaturas inductivas a floración (15 °C). En nuestro estudio se observó una mayor expresión del gen mencionado en hojas de ‘Ataulfo’ en los meses de diciembre y enero, meses en los cuales las temperaturas fueron más bajas que en septiembre, octubre o noviembre (Figura 1).
En hojas soleadas y con aplicación de PBZ, se encontró que MiFT se expresó en la mayoría de los meses evaluados; aunque la expresión fue altamente incrementada en el mes de diciembre, enero y febrero. Lo anterior indica que el regulador favorece la expresión del gen probablemente mediante su efecto en la inhibición de síntesis de giberelinas; aunado a esto, los meses de diciembre a febrero fueron los más frescos comparados con septiembre, octubre y noviembre. Resultados similares se reportan en hojas de naranjo dulce ‘Salustiana’ donde PBZ estimuló la floración de genes homólogos a flowering locus T, CiFT (Muñoz et al., 2012).
Tipo de crecimiento emergido durante la época de floración. Durante la época de floración, del lado oriente (brotes soleados) 66% de brotes presentaron floración, 12% tuvo solo brotes vegetativos y 25% quedaron inactivos. Del lado poniente (sombreado por la mañana y soleado por la tarde), 40% de los brotes tuvieron floración, 50% solo crecimiento vegetativo y 12% quedaron inactivos. Del lado norte (lado sombreado) la mayoría de los brotes quedaron inactivos (76%), aunque 12% presentó floración (Figura 3).
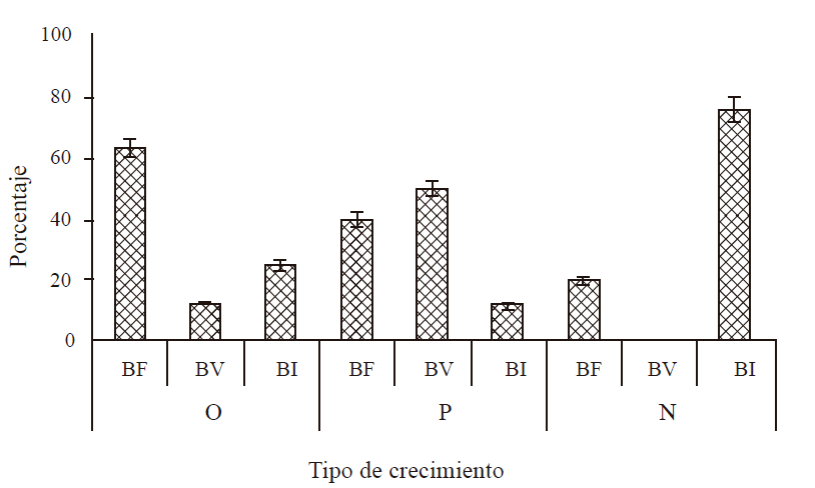
Figura 3 Porcentaje y tipo de crecimiento emergido durante el periodo de floración en brotes de mango ‘Ataulfo’ tratados con PBZ y en diferente orientación en el árbol. BF= brote floral; BV= brote vegetativo; BI= brote inactivo. Lado oriente (O), poniente (P) y norte (N) del árbol, 2014. Las barras en cada punto representan el promedio de 160 brotes por tratamiento ± error estandar.
En el periodo de floración, el porcentaje de brotes con flores fue mayor en el lado soleado cuando se aplicó PBZ, lo que coincide con la mayor expresión de MiFT. Además, es probable que PBZ al inhibir la síntesis de giberelinas favorecieron la expresión del gen encargado de la inducción floral como lo reporta Nakagawa et al. (2012). En lado poniente (soleado por la tarde) y norte (sombreo de 90% aproximadamente) el porcentaje del brotes con flores fue mínima, pero se tuvieron flores en ambos lados cuando se aplicó PBZ. Lo anterior indica que el regulador indujo, aunque en menor cantidad, la expresión del gen MiFT provocando la inducción de floración en este tipo de brotes y por lo tanto la presencia de flores; no obstante, la luz está regulando fuertemente su expresión.
Tanto en lado soleado como sombreado un gran número de brotes permaneció inactivo, lo cual podría deberse a que las condiciones ambientales durante noviembre, mes en que ocurre normalmente la inducción e iniciación floral en mango (Pérez et al., 2009), no fueron adecuadas para floración pues se registraron temperaturas arriba de 20 °C y presencia de lluvia; no obstante, con la aplicación de PBZ, se obtuvo un porcentaje adecuado de brotes florales en lado soleado, lo que coincidió también con la mayor expresión de MiFT en diciembre, tiempo donde la temperatura fue menor a 20 °C.
Experimento 2. Expresión de MiFT por efecto de reguladores de crecimientoLa expresión relativa en hojas con P-Ca fue de 0.02% en septiembre, de 1.1% en noviembre y se incrementó en diciembre a 4.7% y bajó en enero con 1.1%, en octubre y febrero la expresión fue de 0 (Figura 4). En hojas aplicadas con PBZ la expresión relativa de MiFT con relación a MiEF fue de 0.7% en septiembre, en noviembre la expresión fue de 2.8% aumentando en diciembre hasta 30.3 y 22.2% en enero, en el mes de febrero fue de 6.5%. En hojas testigo (sin regulador) la expresión fue de 0.06% en septiembre, cero en octubre, noviembre y diciembre, 0.87% en enero y cero en febrero; mientras que en hojas con AG3, la expresión fue 0 en todos los meses evaluados a excepción de febrero que tuvo 0.02% de expresión.
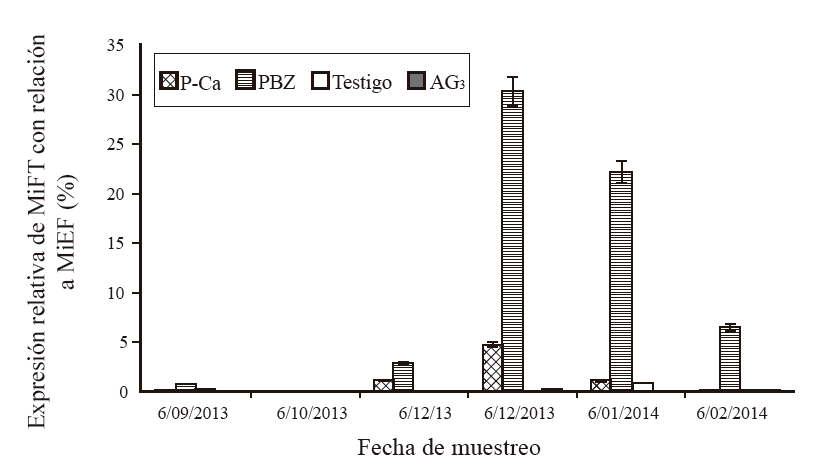
Figura 4 Expresión relativa de MiFT respecto a MiEF enhojas de mango ‘Ataulfo’ con y sin regulador de crecimiento. Las barras en cada punto representan el promedio de tres repeticiones por tratamiento ± error estandar.
Resultados similares a los obtenidos en PBZ se presentaron en hojas tratadas con P-Ca, otro inhibidor de la síntesis de giberelinas, aunque la expresión fue menor comparada con PBZ. En hojas aplicadas con AG3, la expresión fue prácticamente nula, lo que indica que este regulador inhibió la expresión de MiFT. Los resultados coinciden con los obtenidos en naranjo dulce ‘Salustiana’ (Muñoz et al., 2012) y mango ‘Irwin’ (Nakagawa et al., 2012), donde se reporta que las giberelinas reprimen la expresión de genes relacionados con floración como CiFT y MiFT, respectivamente.
Tipo de crecimiento emergido. Respecto al tipo de crecimiento emergido en el periodo de floración, se encontró un porcentaje de brotes florales de 36, 51, 0 y 12% por efecto de P-Ca, PBZ, AG3 y sin regulador (testigo), respectivamente. Los árboles tratados con AG3 presentaron el mayor porcentaje de brotes vegetativos. El resto de los brotes de cada tratamiento permanecieron inactivos con 57, 39, 74 y 73% en P-Ca, PBA, AG3 y testigo, respectivamente (Figura 5).
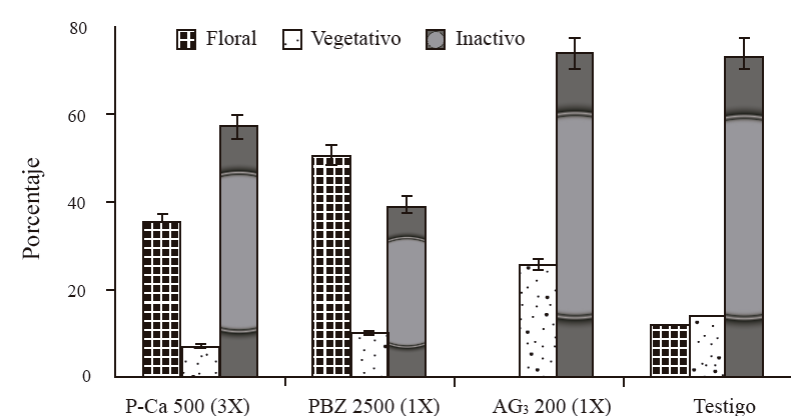
Figura 5 Porcentaje y tipo de crecimiento emergido durante el periodo de floración en brotes de mango ‘Ataulfo’ por efecto de reguladores. 2014. Las barras en cada punto representan el promedio de 160 brotes por tratamiento ± error estandar.
Durante el periodo de floración, el porcentaje de brotes con flores fue mayor cuando se aplicó PBZ, seguido de aquellos tratados con P-Ca, aunque el porcentaje fue menor comparado con PBZ. Lo que coincide con la expresión de MiFT en los dos reguladores. Probablemente al inhibir la síntesis de giberelinas, PBZ y P- Ca favorecieron la expresión del gen encargado de la inducción floral como lo reporta Nakagawa et al. (2012), estos autores demostraron también que MiFT está regulado por giberelinas al encontrar que el contenido de giberelinas activas como AG1 y AG4 se incrementó por la regulación inhibiendo la expresión del MiFT en las hojas y por lo tanto la floración en árboles frutales de mango ‘Irwin’ con alta producción.
Por otro lado, en todos los tratamientos un gran número de brotes permaneció inactivo, aunque el porcentaje fue 23 y 47% más en brotes tratados con AG3 y testigo respecto a P-Ca y PBZ. Bangerth (2009) menciona que en frutales la perenibilidad está dada por los meristemos que permanecen vegetativos, contrario a las plantas anuales donde todos los meristemos florecen al mismo tiempo con la inevitable muerte de las plantas; no obstante, en este estudio la mayoría permane-cieron inactivos, lo cual podría deberse a que las condiciones ambientales durante noviembre, mes en que ocurre normalmente la inducción e iniciación floral en mango (Pérez et al., 2009), no fueron adecuadas para floración (temperaturas arriba de 20 °C y presencia de lluvia).
Sin embargo, a pesar de estas condiciones ambientales, con la aplicación de los reguladores inhibidores de giberelinas, pero sobre todo con PBZ, se logró un porcentaje adecuado de brotes florales. En brotes con AG3, no hubo floración, lo que coincidió con la falta de expresión de MiFT, lo que corrobora el efecto antagónico de este regulador en la floración de mango y otros frutales como lo menciona Nakagawa et al. (2012) en mango ‘Irwin’ y Muñoz et al. (2012) en naranjo dulce ‘Salustiana’.
Conclusiones
En hojas maduras de mango ‘Ataulfo’, el gen MiFT se expresa en mayor cantidad del lado soleado, mientras que en el lado sombreado se expresa en menor cantidad por lo que podríamos decir que este gen está regulado por luz y que el sombreado inhibe su expresión.
La mayor expresión de MiFT se logró en los meses con presencia de temperaturas frías (≤ 20 °C). PBZ y P-Ca favorecieron la expresión del gen, probablemente mediante su efecto en la inhibición de síntesis de giberelinas, propiciando además una mayor floración
Un mayor porcentaje de floración se logró de lado soleado, coincidiendo con la mayor expresión del gen MIFT.
Se demostró, que la aplicación de giberelinas inhibió la expresión de MiFT y por ende la brotación floral.











 text in
text in 


