Introducción
México, es considerado un país mega diverso, incluyendo una fuente de enemigos naturales para plagas y enfermedades de plantas, que forman parte de programas de control biológico en el mundo, de echo nuestro país, aporta al mundo más organismos para el control biológico de plagas que los que recibe; sin embargo, solo cuatro géneros de hongos y uno de bacterias se utilizan ampliamente como control biológico de plagas. Aunado a lo anterior, existe la necesidad de protegerse de la aparición de nuevas plagas en México y otros países, por ello, es importante contar con organismos nativos con potencial para el control biológico de plagas (Williams et al., 2013).
Asimismo, la necesidad de mantener una agricultura sostenible, ha originado la investigación, desarrollo y adopción de métodos de control biológico, particularmente en nuestro país, ha ocurrido de manera acentuada en los últimos 20 años. Entre los hongos con un mayor potencial para el control biológico de insectos se encuentran las especies de Beauveria, Metarhizium y Paecilomyces, quien se caracterizan por ser cosmopolita y que algunas de sus especies atacan una gama amplia de órdenes de insectos (García y Mier, 2010).
Por otra parte, existen plagas de importancia para el nogal pecanero Carya illinoinensis (Wangenh.) K.Koch, como los barrenadores de la nuez (GBR) y el ruezno (GBN) Acrobasis nuxvorella (Neunzig) y Cydia caryana (Fitch), respectivamente (Nava y Ramírez, 2002), aunque poco se sabe de los hongos como enemigos naturales de ambas plagas. En contraste, en suelos agrícolas cultivados con caña de azúcar Saccharum officinarum L., frijol Phaseolus vulgaris L. y maíz Zea mays L., se han aislado hongos entomopatógenos (Barajas et al., 2009; Bautista et al., 2012; Hernández et al., 2011).
Comúnmente, se aíslan hongos entomopatógenos de suelos agrícolas o forestales utilizando como trampa larvas de la pililla de los apiarios Galleria mellonella L. (Hernández et al., 2011; Rodrígues et al., 2005; Sookar et al., 2008). Las larvas del GBR suelen dañar al ruezno (corteza exterior que recubre la cáscara de la nuez) de donde se alimentan y mudan a pupa y finalmente adulto, en el proceso, algunas nueces caen al suelo en donde las larvas podrían infectarse por hongos entomopatógenos. Por tanto, los objetivos del trabajo fueron: i) registrar la micobiota y encontrar hongos entomopatógenos en larvas del GBR dentro del ruezno y en larvas utilizadas como trampa en suelo cultivado con nogal; y ii) evaluar la patogenicidad de los entomopatógenos sobre larvas de GBR, el pulgón negro del nogal Melanocallis caryaefoliae Davis y otros insectos.
Materiales y métodos
El trabajo de campo se realizó durante el verano de 2013, en la huerta “Hormiguero”, ubicada en la Carretera Torreón - San Pedro km 16, municipio de Matamoros, Coahuila, cuyas coordenadas a la entrada de la huerta son +25° 41’ 23.98”, -103° 20’ 5.59”. El estudio de laboratorio, se llevó a cabo en el laboratorio de fitopatología del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) en Matamoros, Coahuila.
Rueznos y GBR. Tres fechas de recolección de rueznos se realizaron, en las dos primeras se recolectaron nueces para obtener sus rueznos con signos de entrada por el GBR, en la tercera fecha se recolectaron 100 kg de ruezno recién separado de la nuez por medio de maquinaria industrial (separadora del ruezno de la nuez). Todos los rueznos obtenidos se almacenaron en un cuarto frio a temperatura 5-8 °C hasta extraerles sus larvas y pupas de GBR (ruezno procesado). Las fechas de recolección y procesamiento de rueznos para extraer larvas y pupas del GBR y tiempo de almacenamiento antes de procesarlos se indican en el Cuadro 1.
Cuadro 1 Recolección, almacenamiento y procesamiento de rueznos de nogal pecanero, para obtener larvas y pupas del gusano barrenador del ruezno, durante 2013 en la huerta “Hormiguero” en Matamoros, Coahuila, México.

†= Los rueznos se almacenaron de 5-8 °C antes de procesarlos. ¥= El procesamiento consistió en extraer las larvas y pupas del barrenador del ruezno. £= Larvas y pupas expresadas como porcentaje con relación al número de rueznos procesados.
Colonización de larvas y pupas. En la huerta hormiguero, debajo de la copa de los nogales se recolectaron de la superficie del suelo muestras de 20 g, las que se colocaron en cajas Petri de plástico estéril. Al suelo de cada caja se le añadió agua destilada estéril al 80% de saturación. Enseguida, cinco larvas y pupas (vivas o muertas) obtenidas en las fechas 30-08-2013 y 06-09-2013 se colocaron por cada caja y se incubaron por siete días a 28 ºC. Larvas vivas obtenidas en las fechas 12-09-2013, 10-10-2013, 17-10-2013, 01-11-2013 y 11-11-2013 también se colocaron en cajas Petri con suelo e incubaron siete días a 28 ºC. Las larvas que fueron obtenidas el 12-11-2013, se colocaron en grupos de cinco en cada cámara húmeda (caja Petri con papel secante estéril húmedo) por diez días a 28 ºC e incubaron siete días a 28 ºC.
Aislamiento y purificación de hongos que invadieron larvas y pupas. Después de incubar las larvas y pupas, bajo condiciones asépticas, con una aguja hipodérmica estéril se tomaron los hongos que las invadieron, luego los hongos se trasfirieron a dos medios de cultivo: agar agua (AA) y papa dextrosa agar (PDA). Los dos medios de cultivo se les adicionaron 50 mg L-1 del antibiótico amoxicilina después de esterilizarlos. El AA y el PDA se prepararon adicionando por litro de agua destilada 17 g de agar para ambos medios y solo para el PDA, 20 g de fructosa grado alimenticio (Gold Bell®) y el líquido procedente de 200 g de papa cocida en un litro de agua destilada.
Cuando los hongos pudieron crecer en colonias únicas y visiblemente no contaminados con bacterias, se transfirieron a tubos con medio inclinado (PDA + 2 g L-1 de CaCO3) e incubaron hasta observar que colonizaron la superficie del medio a 28 °C. Los tubos con los hongos se almacenaron entre 5 a 10 °C, para su posterior resiembra en PDA e identificación a nivel de género (Domsch et al., 1980) excepto Metarhizium que se identificó hasta especies (Tulloch, 1976).
Prueba de patogenicidad de Metarhizium anisopliae. Las larvas del GBR utilizadas en esta prueba, se obtuvieron directamente de rueznos de nueces adheridas a los brotes. Directamente del suelo se obtuvieron larvas recubiertas por esporas M. anisopliae, estas larvas se tomaron con pinzas de disección y se pusieron en contacto directo con larvas recién obtenidas. Luego se incubaron en cámara húmeda por diez días a 28 ºC o en caja petri que tenía el papel secante estéril seco (cámara seca). En ambas, cámaras húmeda y seca se colocaron cinco larvas y se hicieron cinco cajas (repeticiones). Como tratamiento testigo, se colocaron larvas sin inocular en ambos tipos de cámaras. Toda la prueba se repitió siete veces, que se tomaron como tratamientos. Al tercer día de incubación se contabilizaron larvas vivas, muertas y esporulación del hongo sobre las larvas, esto último se repitió al décimo día.
Una segunda manera de inocular cada larva del GBR fue utilizando esporas de M. anisopliae con 100 uL de una solución de 108 mL-1, en este caso se usaron las mismas larvas por caja, cajas y repeticiones de la prueba anterior. La solución de esporas se obtuvo al raspar la superficie del medio de cultivo Sabouraud donde el hongo creció 30 d a 28 ºC, las esporas se colocaron en agua destilada estéril con 0.01% de Tween 80, y con una cámara Neubauer se ajustó una concentración de 108 mL-1. Para inocular de manera individual al ácaro rojo gigante Trombidium sp., el pulgón negro del nogal Melanocallis caryaefoliae Davis, la garrapata Rhipicephalus sanguineus Latreille, y la hormiga roja Solenopsis sp., se cortaron cilindros de 0.8 cm con esporas de la colonia de M. anisopliae que creció 30 d a 28 ºC en medio Sabouraud y se pusieron en contacto con cada espécimen. Se utilizó una cámara húmeda con cinco insectos por caja y cinco cajas (repeticiones), la prueba se repitió tres veces.
Análisis de datos. Los análisis se realizaron utilizando el programa SAS (2010). Los datos larvas de GBR muertas o colonizadas por M. anisopliae se compararon utilizando la prueba de chi cuadrada (ꭓ2). Los análisis se realizaron por separado para i) el tercer o décimo día; y ii) la inoculación por contacto o por esporas.
Resultados y discusión
Rueznos y GBR. Las larvas del GBR se recuperaron en mayor porcentaje (13-30%) a partir de las nueces con síntomas (barrenadas), en comparación a los rueznos recolectados de la limpia mecánica de la nuez (7-9%), asimismo, solo se pudieron recobrar pupas de nueces barrenadas Cuadro 1.
Colonización de larvas y pupas. El primer intento por aislar hongos entomopatógenos se realizó inoculando en suelo larvas y pupas vivas y muertas, en este caso aparecieron mezclas de hongos u hongos-bacterias. Sobre los cuerpos de las larvas vivas aparecieron los mayores porcentajes de hongos y bacterias (5-9%), ahí predominaron mezclas de Fusarium spp. con otros hongos y bacterias, así como los géneros Gliocladium y de la familia Dermateaceae que no esporularon ni se identificaron, Figura 1. En contraste, las larvas colocadas en cámara húmeda predominaron la aparición de la mezcla de Fusarium + Gliocladium 88%, Figura 2. Larvas del GBR se inocularon en suelo húmedo, donde aparecieron los géneros de hongos Fusarium, Metarhizium, Gliocladium y Aspergillus en un 40, 5, 4 y 4%, respectivamente Figura 3.

Figura 1 Microorganismos encontrados de larvas vivas (57%) y muertas (17%), pupas vivas (20%) y muertas (9%) de Cydia Caryana, después de colocarse en suelo e incubarse siete días a 28 °C. Las fechas de obtención de larvas y pupas fueron 30-08-2013 y 06-09-2013. A= Aspergillus spp. G= Gliocladium sp. D= Dermateaceae; T= Trichoderma sp.; F= Fusarium spp. B= Bacterias; V= Verticillium sp. AF= Aspergillus flavus.

Figura 2 Microorganismos encontrados (%) en 125 larvas vivas del barrenador del ruezno Cydia Caryana, después de colocarse en cámara húmeda e incubarse diez días a 28 °C. La fecha de obtención de larvas fue 12-11-2013. A= actinomicetos; G= Gliocladium sp. F= Fusarium spp. M= Mucoraceos; N= nada.
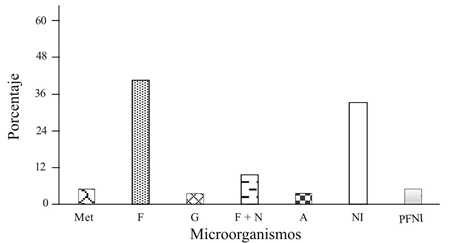
Figura 3 Microorganismos encontrados (%) en 292 larvas de barrenador del ruezno Cydia Caryana, después de colocarse en suelo húmedo e incubarse siete días a 28 °C. Las fechas de obtención de larvas fueron 12-09- 2013, 10-10-2013, 17-10-2013, 01-11-2013 y 11-11-2013. Met= Metarhizium anisopliae; A= actinomicetos; G= Gliocladium sp. F= Fusarium spp. N= nemátodos. NI= no invadidas; PFNI= pupas formadas no invadidas.
Prueba de patogenicidad de M. anisopliae. Las larvas del GBR sobrevivieron 100 y 92% después de 3 y 10 d de incubación, respectivamente; en contraste, murieron de 65 a 100% al inocularse por contacto o esporas de M. anisopliae e incubarse en cámara húmeda; en cambio, larvas inoculadas con ambos métodos e incubadas 3 d sobrevivieron 100% y las incubadas 10 d lograron sobrevivir de 87 y 73% al inocularse por contacto o esporas, respectivamente (Cuadro 2).
Cuadro 2 Supervivencia de larvas del gusano barrenador del ruezno Cydia Caryana después de tres días de haberse inoculado o no con Metarhizium anisopliae.

£= larvas sin inocular, promedio de tres repeticiones, con cinco larvas por repetición; §= las larvas se inocularon al ponerlas en contacto directo con larvas micosadas; ¥= las larvas se colocaron en cajas petri con papel secante estéril seco; valores promedio de siete tratamientos, cada uno con tres repeticiones y cada repetición con cinco larvas. †= las larvas se colocaron en cajas petri con papel secante estéril húmedo (saturado), valores promedio siete tratamientos, cada uno con tres repeticiones y cada repetición con cinco larvas; ¶= se inocularon las larvas con 100 uL de una solución de esporas de 108 mL-1.
Los tratamientos (testigo), cámara húmeda o seca fueron significativos para la forma de inoculación, así para larvas inoculadas en contacto o esporas a 3 d la (X2= 230, gl=14, p≤ 0.001) y (X2= 149, gl= 14, p< 0.001), respectivamente; asimismo, fueron significativos los tratamientos de inoculación para larvas inoculadas en contacto o esporas al 10 d con X2= 290, gl= 14, p≤ 0.001 y X2= 198, gl= 14, p< 0.001, respectivamente. M. anisopliae esporuló sobre las larvas del GBR de 63 y 100% después de inocularse con el hongo e incubarse en cámara húmeda 3 y 10 d, respectivamente; pero el hongo no esporuló sobre las larvas en cámara seca (Cuadro 3).
Cuadro 3 Esporulación de Metarhizium sp. sobre larvas del gusano barrenador del ruezno, las larvas fueron inoculadas por contacto directo con el hongo e incubadas a 28 °C hasta 10 días.

†= las larvas inoculadas se colocaron en cajas petri con papel secante estéril húmedo (cámara húmeda) o papel secante seco (cámara seca); valores promedio siete tratamientos, cada uno con tres repeticiones y cada repetición con cinco larvas.
A las 24 h después de inocular la larva del GBR con M. anisopliae el hongo genera micelio sobre el insecto, a las 36 h forma un micelio algodonoso y al tercer día se forma un micelio aéreo en forma de domo con las primeras esporas, finalmente, entre después del cuarto día el micelio en forma de domo genera las esporas Figura 4.

Figura 4 Proceso de micosado de M. anisopliae sobre la larva del GBR. A= invasión a las 24 h; B= invasión a las 36 h; C= producción de esporas a los tres días en la superficie del micelio algodonoso; y D= abundante esporulación después del cuarto día.
El al ácaro rojo gigante, el pulgón negro del nogal, la garrapata hembra como sus huevos y la hormiga roja permitieron la esporulación de M. anisopliae, en todos los casos el hongo esporuló en 100%. El micelio en forma de domo se formó también en el ácaro gigante y una capa de micelio poco profusa sobre los huevos de la garrapata y hormiga (Figura 5).

Figura 5 Insectos que atacó M. anisopliae. A y D= garrapata huevo y adulto, respectivamente; B= ácaro gigante; C= hormiga roja y E= pulgón negro del nogal.
Los nematodos, Fusarium spp. y Gliocladium sp. por si solos o asociados pudiesen ser entomopatógenos del GBR, aunque no fue posible asilar los nematodos, tampoco se corroboró que los hongos fuesen entomopatógenos; sin embargo, se muestra en la Figura 6 como fueron invadías las larvas por los microrganismos aludidos.
Discusión
Como máximo se recuperó 30% de larvas de rueznos obtenidos de la nuez, ese bajo porcentaje pudiese deberse al efecto del insecticida aplicado contra el GBR y la emergencia de algunos adultos que abandonan el ruezno barrenado; el porcentaje de larvas de 9% de los rueznos separado de la nuez por medio de maquinaria, podría explicarse a los efectos mecánicos y de descomposición de los rueznos. Para fines prácticos, se facilitó la obtención de rueznos de ésta segunda manera. El tiempo (13-46) y temperatura (5-8 °C) de almacenamiento muy probablemente impidieron la formación y obtención de pupas (Cuadro 1).
Cuando las larvas se obtuvieron de rueznos desprendidos de la nuez o rueznos separado por maquinaria no fueron colonizadas por microorganismos en 60 y 37%, respectivamente (Figura 1 y 3), lo que podría deberse a que las larvas adquieren algunos microorganismos durante su almacenamiento o adquieren susceptibilidad para ser invadidas por los hongos del suelo. El menor porcentaje (6%) de larvas no colonizadas se obtuvo en cámara húmeda (Figura 2) en donde presencia de Fusarium spp. predominó (88%); es decir, el hongo parece asociarse a la larva del durante su almacenamiento; no obstante, no fue posible asilar a Metarhizium anisopliae, lo que únicamente se logró hacerlo del suelo de larvas obtenidas de rueznos separado por maquinaria.
Algunas larvas fueron parasitadas y muertas por nematodos y asociación de estos con Fusarium spp.; sin embargo, no pudimos aislar los nematodos, aunque sí los Fusarium. En el año 2014, en la huerta Hormiguero, larvas del GBR fueron muy escasas, razón por la que no fue posible probar los asilados de Fusarium y otros hongos como entomopatógenos del GBR. Sin embargo, en el cepario del Laboratorio de Fitopatología se resguardan los aislados de M. anisopliae y los hongos mencionados.
Las larvas solo fueron micosadas en cámara húmeda (Cuadro 3) aunque algunas larvas inoculadas con el hongo murieron después de 10 días de incubación (Cuadro 2), M. anisopliae es capaza de matar insectos a través de toxinas y enzimas, pero no siempre esporula sobre el insecto muerto (Téllez et al., 2009), consideramos improbable que el hongo mato a las larvas del GBR en condiciones secas (cámara seca). La humedad relativa (HR) es determinante para la esporulación de M. anisopliae sobre los insectos que ataca, trabajos previos indican que el hongo esporula cuando la HR oscila entre un 50-100% (Magalhães et al., 2000), la temperatura también es un factor importante para la virulencia y adaptación de éste hongo, particularmente, cepas obtenidas tolerantes al calor (crecimiento > 25 °C) son virulentas y se adaptan regiones cálidas (García et al., 2010; Rodrígues et al., 2005; Toriello et al., 2008). El aislado de M. anisopliae obtenido tuvo su máximo crecimiento a 28 °C aunado a la virulencia mostrada en una gama aplica de insectos, le confiere características de uso potencial para el control biológico de plagas en el suelo.
Con anterioridad, se han consignado que distintos aislados de M. anisopliae atacan y matan hasta en 95% garrapatas Rhipicephalus microplus Canestrini (Ruvalcaba et al., 2011), el aislado evaluado en éste trabajo tuvo un comportamiento similar. Asimismo, la especie de hormiga Atta cephalotes L. y el pulgón negro del nogal M. caryaefoliae fueron micosados por M. anisopliae (Lemus et al., 2008; Shapiro et al., 2008), ambos trabajos indican la capacidad del hongo para atacar especies o géneros similares a los consignados en nuestro trabajo. Adicionalmente, se sabe que las especies de Metarhizium se han especializado en atacar o una gama muy restringida o muy amplia de insectos (Hu et al., 2014), en nuestro trabajo, para M. anisopliae, todo indica que ataca una gama aplica de insectos.
De manera práctica, las especies de Metarhizium, usualmente se ha utilizado para el control de plagas al incorporar sus esporas en el suelo, tales son los casos, del control de plagas del maíz y caña de azúcar Saccharum officinarum L, entre otros (Lezama et al., 2005; Matabanchoy et al., 2012), el uso del aislado obtenido en éste trabajo se podría usar al añadir sus esporas en el suelo para infectar larvas del GBR dentro de los rueznos que se encuentren en el suelo.
Finalmente, se sabe que distintas especies de Metarhizium poseen a la vez tres maneras de sobrevivir, una como saprobios en suelo, otra asociada a raíces y una tercer como entomopatógenos (Fisher et al., 2011; Barelli, 2013) lo que aumenta las perspectivas del uso de estos hongos para el control de plagas en el suelo, incluyendo C. caryana.
Conclusiones
Las larvas del GBR se pueden utilizar como trampa para aislar Metarhizium y probablemente otros entomopatógenos del suelo.
El aislado de M. anisopliae obtenido en este trabajo, ataca y mata distintos insectos, por que se considera no especializado.
Otros hongos recobrados y nematodos (no recobrados) mostraron capacidad de micosar las larvas del GBR, aunque no se confirmó tal efecto.











 texto em
texto em 



