Introducción
El fósforo (P) es uno de los nutrientes limitantes en el suelo, debido a su baja disponibilidad y por presentar una baja tasa de movilidad entre los macro nutrientes (Souchie et al., 2006). En la planta, el fósforo es requerido en la formación de ácidos nucleicos, fosfatos de azúcares y membranas, síntesis de proteínas y formación del nuevo protoplasma, por lo que es necesario un adecuado abastecimiento de este elemento en el suelo (Condron y Tiessen, 2005). La absorción de P en plantas se realiza a través de iones diácido o monoácido del sustrato, debido a la baja solubilidad de los compuestos fosfatados, se presenta una tendencia de desplazamiento del equilibrio hacia la fase sólida, por lo que la concentración de P en solución en un tiempo específico puede llegar a ser muy baja (0.02 a 0.1 mg.L-1) (Chesworth, 2008).
Estas características han propiciado que las plantas desarrollen distintos mecanismos fisiológicos (acumulación de carbohidratos en la raíz) y bioquímicos (exudados radiculares) para aumentar la adquisición de nutrientes, de P. Uno de esos mecanismos es la formación de la asociación simbiótica con hongos micorrízico arbusculares (HMA; Smith y Smith, 2011), pues se sabe que las plantas pueden adquirir P por: 1) absorción directa que ocurre a través de transportadores en la epidermis de la raíz; y 2) absorción micorrízica que transloca P desde las hifas extra radicales de los hongos hasta el interior de la raíz (Smith et al., 2004). En suelos con limitado contenido de fósforo las plantas pueden depender completamente de la asociación micorrízica para adquirir dicho nutriente (Smith et al., 2003).
Las micorrizas arbusculares son asociaciones del tipo mutualista entre plantas y una gran variedad de hongos (Smith y Read, 2008); los HMA son organismos del suelo que forman simbiosis con 80% de las plantas terrestres (Smith et al., 2004). Esta asociación beneficia a la planta al de poca movilidad en el suelo, tiene efectos de biocontrol contra algunos microorganismos patógenos, aumentando el status nutricional, tolerancia al estrés hídrico, entre otros beneficios (Smith et al., 2011) al mismo tiempo dicha asociación desempeña un papel importante sobre las características físicas del suelo, al incrementar la agregación de partículas y estabilidad del suelo (Khan, 2006).
En numerosos estudios se ha demostrado las ventajas de la inoculación con hongos micorrízicos arbusculares en suelos de baja fertilidad (Herrmann et al., 2015). El efecto más importante que producen los HMA en los cultivos es un incremento en la absorción y traslocación de nutrimentos del suelo como N, P, K, Ca, y Mg (Säle et al., 2015) que se traduce en un mayor crecimiento y desarrollo de las plantas, así como un mayor porcentaje de sobrevivencia al trasplante (Rodríguez et al., 2017).
Bajo esquemas convencionales de producción el desarrollo óptimo de cultivos demanda una elevada aplicación de fertilizantes minerales y plaguicidas (Weih et al., 2011). Algunas veces, la aplicación de fertilizantes fosfatados es superior a las necesidades de dichos cultivos, lo que da como resultado la acumulación excesiva de fosforo fácilmente disponible en el suelo (Withers et al., 2001). Por ello, es necesario conocer la dosis de fósforo óptimo para que la planta y la asociación micorrízica puedan desarrollarse de manera eficiente, de tal manera que se obtengan los beneficios que dicha simbiosis aporta (Taffouo et al., 2014).
México es el centro de origen del aguacate (Persea americana Mill; Gutiérrez et al., 2010) con una gran diversidad de especies, se han reportado hasta 20 diferentes y tres razas: mexicana, antillana y la guatemalteca (Chen et al., 2009). Ha sido documentado que el aguacate es un cultivo micotrófico que responde favorablemente a la inoculación micorrízica (Bárcenas et al., 2007; Bañuelos et al., 2013). Sin embargo, se sabe que existe una gran diversidad genética y funcional de especies de HMA (Helgason y Fitter, 2009), y que los géneros de HMA asociados a una misma especie de hospedero presentan diferencias en relación al nivel y capacidad de esporulación (Bever, 2002), habilidad para colonizar las raíces (Klironomos y Hart, 2002) y para adquirir fósforo (Smith et al., 2000).
Además, también las variedades de una misma planta pueden presentar diferencias en su respuesta a la micorrización. En trigo la colonización por Glomus intraradices varía entre 16 y 37% entre cultivares (Zhu et al., 2001) y en cebada, dos variedades inoculadas con G. intraradices difirieron en más de 100% en adquisición de fósforo inorgánico (Pi) (Zhu et al., 2003).
En el aguacate los resultados pueden ser constrastantes; por ejemplo, en un estudio realizado para evaluar las diferencias funcionales entre los hongos micorrízicos arbusculares Glomus intraradices, Scutellospora heterogama y su efecto en plantas de aguacate (Persea americana) se encontró que la inoculación conjunta con G. intraradices y S. heterogama redujo las tasas de crecimiento de las plantas y la absorción de P, zinc (Zn) y hierro (Fe) en relación con plantas inoculadas sólo con G. intraradices, evidenciando en este caso la ausencia de complementariedad funcional (Violi et al., 2008).
De manera contraria a estos resultados, la inoculación con consorcios de especies de HMA (Glomus fasciculatum, Glomus constrictum, Glomus tortuosum, Glomus geosporum, Acaulospora scrobiculata Glomus mosseae y Glomus cubense) propiciaron un mayor desarrollo en plantas de aguacate criollo mexicano (Persea americana var. drymifolia) respecto a las plantas testigo, incrementando la altura de planta hasta 54%, diámetro del tallo (hasta 36%), número y longitud de hojas (48% y 40% respectivamente), así como peso fresco de la raíz (hasta 85%) (Castro et al., 2013).
Se sabe que el cultivo de aguacate es susceptible al ataque causado por patógenos de la raíz, y que en la etapa de vivero generalmente se realiza la esterilización del suelo previo a la siembra, eliminando con ello todo tipo de microorganismos, por lo que la reintroducción de microorganismos benéficos como los hongos micorrízicos arbusculares puede jugar un papel importante en la producción de esta planta. Debido a lo anterior, el presente trabajo tiene como objetivo: evaluar el efecto de diferentes concentraciones de fertilización fosforada, en el desarrollo de plantas de aguacate con y sin inoculante micorrízico, expresado en variables de crecimiento.
Materiales y métodos
Material vegetativo
Se pre germinaron semillas de aguacate criollo (Persea americana) en arena estéril, en charolas con capacidad de 8 L.
Inoculante
Se utilizaron dos inóculos; el consorcio Rizofermic- UV que contiene doce especies de hongos micorrízicos arbusculares (Acaulospora morrowiae, Acaulospora scrobiculata, Acaulospora spinosa, Claroideoglomus etunicatum, Funneliformis geosporus, Funneliformis mosseae, Gigaspora decipiens, Gigaspora rosea, Glomus aggregatum, Glomus macrocarpum, Rizhophagus intraradices, y Scutellospora pellucida) producido por el laboratorio de organismos benéficos, FCAUV y Pacispora scintillans, producido, en el laboratorio de interacciones planta-microbio-ambiente del IIES, UNAM).
El aislado para ambos inóculos se obtuvo a partir de esporas extraídas del suelo cultivado con maíz. Se propagó en macetas con suelo andosol autoclavado y arena autoclavada 1:1 con alfalfa como planta hospedera durante ocho semanas, cuando presentó colonización de más de 50% se dejó secar y se almacenó a temperatura ambiente, ambos inóculos contenían esporas, micelio y fragmentos de raíz colonizada.
Esterilización del sustrato
Se utilizó un sustrato compuesto por arena, suelo y tepetzil (liparita) en proporción (25:50:25), esterilizado en autoclave a 120 °C (14 - 15 lb pulg-2 de presión de vapor) durante 1 h por tres días consecutivos.
Trasplante e inoculación
Se seleccionaron plantas de 15 cm de altura (30 días de germinación), se trasplantaron a contenedores de 2 L y se agregaron 10 g de los inóculos micorrízicos.
Descripción de los tratamientos
El experimento tuvo un diseño factorial completamente al azar; con dos factores. El primero: inoculante micorrízico con tres niveles (Rizofermic-UV, P. scintillans y sin inocular) y el segundo fertilización con fósforo, con cinco niveles (sin fertilizante, 20 ppm, 40 ppm, 80 ppm, 160 ppm), cada tratamiento con cinco repeticiones.
Fertilización
La fertilización se realizó a partir de un stock de ácido fosfórico H3PO4 al 85%, donde 26% es fósforo (P), mezclado con agua destilada para obtener las distintas concentraciones que se aplicaron a las plántulas (20, 40, 80, 160 ppm). La aplicación del fertilizante se realizó cada ocho días, iniciando la aplicación una vez establecida la colonización micorrízica, y se aplicaron 3 mL del fertilizante fosforado por planta
Condiciones de crecimiento
El desarrollo del experimento se realizó bajo condiciones de invernadero, fueron irrigadas con agua corriente a capacidad de campo, realizando esta actividad diariamente por los primeros cuatro meses posteriormente de esa fecha hasta concluir el experimento cada tercer día.
Características del suelo
El suelo utilizado, según la Norma Oficial Mexicana 021 RECNAT 2000, presenta las siguientes propiedades físico-químicas: migajón-arenoso con los siguientes valores arena (73.2%), arcilla (6.8%), limo (20%), pH 6.04 y materia orgánica 5.93%, N orgánico 22 ppm, P 4.4 ppm, K 885 ppm, Ca 13,575 ppm, Mg 237 ppm, Fe 6.7 ppm, Cu 0.5 ppm, Zn 1.2 ppm y Mn 3.9 ppm. Acorde con la NOM 021 RECNAT 2000 as-09 el suelo se clasificó como migajón arenoso.
Transcurridos 401 días después de la inoculación se realizó la medición de las variables evaluadas: altura, diámetro, número de hojas y área foliar por medio del programa adobe photoshop CS4 Extended versión 11 y un escáner HP Scanjet 5590, además se midió peso fresco y seco de parte aérea y raíz (las muestras se secaron a 70 ºC hasta obtener peso constante), y tasa de crecimiento con la técnica de Gujarati (2004) que consiste en utilizar los valores iniciales y finales de la serie de acuerdo a la siguiente ecuación:
Donde: r= es la tasa de crecimiento; Vf= valor final de la serie; Vi= valor inicial de la serie; n= número de repeticiones.
Muestras frescas de las raíces cosechadas (las más delgadas de cada sistema radical), se lavaron y cortaron en fragmentos de 2 cm. Antes de teñirse, las raíces se clarificaron en una solución de KOH al 10% durante 10 minutos a 120°C, seguido por la acidificación con HCl al 1% durante 1 min a temperatura ambiente. Las raíces se tiñeron en una solución de azul de tripano al 0.05% durante 5 min a 120 °C (Phillips y Hayman 1970).
Posteriormente, se colocaron en lactoglicerol y se observaron primero en un microscopio óptico (100x magnificación, Nikon PFX Optiphot-2) para verificar la presencia de estructuras de HMA, y posteriormente en un microscopio estereoscópico (60x magnificación, Nikon SMZ645) para determinar el porcentaje de colonización mediante la técnica del gradiente de intersección (Giovannetti y Mosse 1980). Se consideró como colonización la presencia de cualquier estructura fúngica interna en la raíz (arbúsculos, vesículas o hifas).
Resultados y discusión
Los inoculantes micorrízicos tuvieron efectos significativos, así como los distintos niveles de fósforo en variables medidas y sólo se encontró un efecto por interacción de ambos factores en altura y tasa de crecimiento (Cuadro 1).
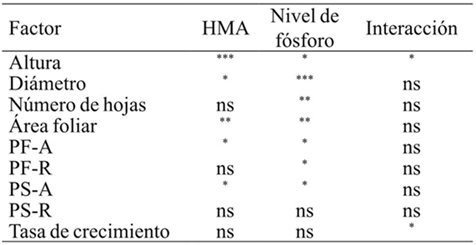
ns= no significativo; *= p≤ 0.05; **= p≤ 0.01; ***= p≤ 0.001; PF-A= peso fresco parte aérea; PF-R= peso fresco raíz; PS-A= peso seco parte aérea; PS-R= peso seco raíz; n= 4.
Cuadro 1 ANOVA multifactorial para cada variable de crecimiento.
Cuando no se adicionó fósforo, el inoculante Rizofermic- UV, mostró el mayor número de hojas y área foliar. Plantas inoculadas con P. scintillans tuvieron un incremento en el diámetro, altura, y área foliar a 20 ppm, en comparación con los demás tratamientos. Ambos inoculantes incrementaron el número de hojas, peso fresco de la parte aérea y tasa de crecimiento a 20 ppm, en comparación con el tratamiento no inoculado, aunque este efecto ya fue observado en dosis mayores de fósforo. En general, al comparar el efecto en el incremento de las variables medidas entre los inoculantes a distintas dosis de fósforo, el efecto de P. scintillans fue más notorio a 20 ppm, y el efecto de Rizofermic-UV, sucedía a 40 ppm (Cuadro 2).
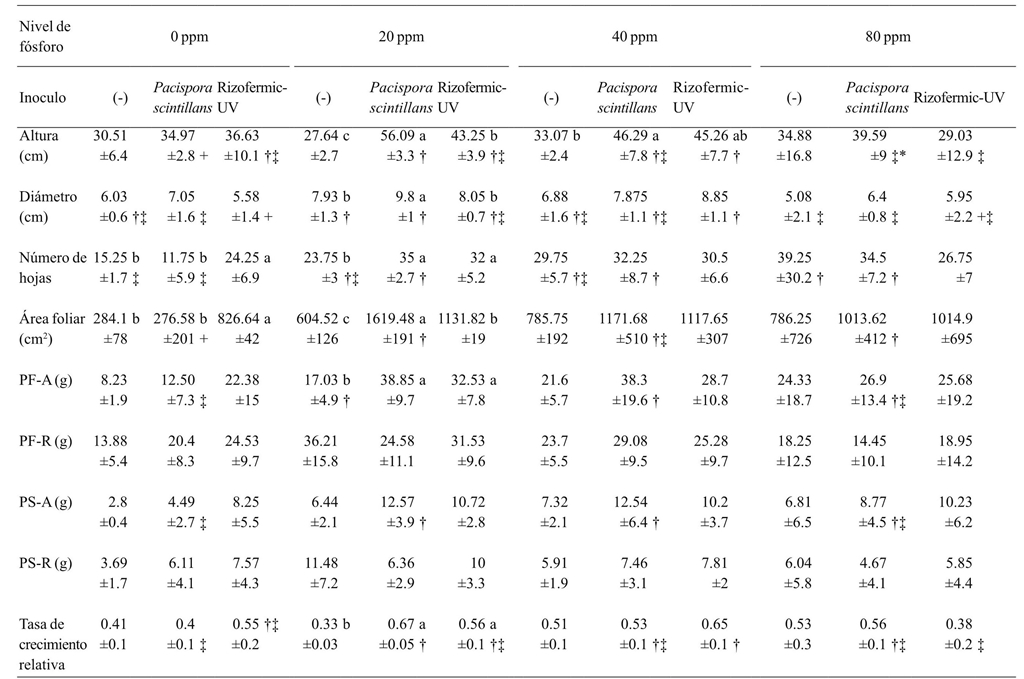
±= indica desviación estándar; PF-A= peso fresco parte aérea; PF-R= peso fresco raíz; PS-A= peso seco parte aérea, PS-R= peso seco raíz; n= 4. Letras distintas muestran diferencias estadísticas entre inóculos por nivel de fertilizante (Fischer, p≤ 0.05); †, ***; ‡, **; +, *= muestra diferencias entre los niveles de fósforo por inoculante.
Cuadro 2 Análisis de comparación de medias del efecto de la interacción de dos inoculantes micorrízicos y la aplicación de cuatro dosis de fósforo en el desarrollo de plantas de aguacate.
Se encontró que la colonización micorrízica disminuye con la adición de dosis P para ambos inoculantes. Se observaron diferencias estadísticas (p< 0.05) entre los inóculos para esta variable. Tanto el consorcio Rizofermic- UV y P. scintillans tuvieron una disminución significativa de la colonización micorrízica a partir de 80 ppm, siendo Rizofermic-UV el inoculante presentó los porcentajes más elevados de colonización radical a 20 ppm (78.34%) (Figura 1).
Discusión
De acuerdo a los resultados observados en este experimento, las altas dosis de P (160 ppm) provocaron el deceso de las plantas. Se ha reportado que la disponibilidad alta de P puede dar lugar a la depresión del crecimiento vegetal (Jiménez y Fernández, 2016). En este sentido, Marschner (2008) plantea que altos niveles de P producen toxicidad en la planta alterando la absorción de Zn y Fe. Por su parte, Li et al. (2004) indican que las deficiencias de Zn o de Fe son más frecuentes cuando existen altas concentraciones de P en el suelo, de este modo, es probable que estudios que han descrito deficiencias de micronutrientes sean en realidad, un reflejo de síntomas de toxicidad debido a altos niveles de P (Shane et al., 2003).
Se encontró que la adición de P y la micorrización promovieron el crecimiento vegetal. Dentro de las distintas dosis de P probadas, la dosis de 20 ppm de P tuvo un efecto en el incremento de la biomasa, coincidiendo con lo encontrado por Montoya (2007). De los dos inóculos de HMA probados, las plantas inoculadas con el consorcio Rizofermic-UV mostraron una tendencia en el incremento de las variables de crecimiento, esencialmente en área foliar (p< 0.05), a diferencia de Pacispora scintillans, la cual no tuvo un crecimiento en comparación del testigo.
Las diferencias de efectos entre las cepas de HMA probadas en las plántulas de aguacate, especialmente en el caso de área foliar pudiera deberse a que exista complementariedad funcional entre las distintas especies dentro del consorcio Rizofermic-UV y aguacate. Se sabe que las especies de HMA difieren ampliamente en sus estrategias para adquirir P y promover el desarrollo de la planta hospedera (Thonar et al., 2011). En este sentido Jaizme y Azcón (1995) N encontraron diferencias de complementariedad entre especies de HMA asociadas a plantas de aguacate.
Algunos estudios reportan que incrementos en el nivel de P reducen el desarrollo de la simbiosis micorrízica; sin embargo, los niveles a los cuales dicha reducción ocurre son variables (Almaca y Ortas, 2010) y están en función de la identidad de las especies de HMA y el genotipo de la planta (Lacerda et al., 2011). En este caso, las interacciones entre la inoculación micorrízica y la adición de fertilizante fosfatado mostraron efectos distintos. Por ejemplo, el tratamiento P. sintillans más 20 ppm de P, incrementó las variables de crecimiento más que los tratamientos de manera individual, resultados similares ha sido reportados por (Dutt et al., 2013). En este sentido, la adición de P. scintillans podría hacer más eficiente el uso de fertilizante y representar un avance en la reducción de las dosis actuales de fertilizante utilizadas para el cultivo de aguacate.
Se sabe que la colonización micorrízica empieza a darse a los tres días después de la inoculación y afianzarse desde los 21 días (Mustafa et al., 2010); sin embargo, ambos estudios concluyen que la inoculación micorrízica necesita tiempo para mostrar su efecto benéfico. Dado que las plantas de aguacate tienen una reserva rica en nutrientes, es posible que los beneficios de la asociación micorrízica no se manifiesten en una etapa temprana de inoculación (Osorio et al., 2012), por lo que la inclusión de estos simbiontes debe darse en un momento clave de baja lignificación (Leskovar et al., 1991) y alta susceptibilidad (Afek et al., 1990) de la planta.
Conclusiones
En el presente trabajo y bajo las condiciones experimentales aquí presentadas, se sugiere la fertilización con una mínima dosis de fosforo en interacción con HMA, ya que en los resultados aquí obtenidos fue la concentración donde se observó un incremento significativo en las variables y donde hubo un incremento en la altura y área foliar relativamente mayor.
El presente estudio expuso que la inoculación con los HMA, esencialmente con la cepa Pascispora scintillans, promueve un mayor crecimiento en plántulas de aguacate, cuando estas están fertilizadas con 20 ppm de fosforo.
Para el peso fresco y seco la interacción de los HMA con el P fueron los que tuvieron mayor relevancia. P. scintillans promovió que las plantas tuvieran mayor crecimiento en comparación con las plantas inoculadas con el consorcio Rizofermic-UV y con las plantas control.











 texto em
texto em 



