La mayoría de las variedades comerciales de algodonero actualmente utilizadas pertenecientes a la industria, están alteradas genéticamente, mediante la inclusión de Bacillus thuringiensis (Bt) Berliner proteínas Cry1A y Cry2Ab, para el control de larvas de diferentes especies de lepidópteros (Jain et al., 2006; Chaparro, 2011). Lo que contribuye a que la tasa de adopción de la tecnología, sea una de las más altas en diversos países (Chaparro, 2011). Sin embargo, se desconocen repercusiones positivas o negativas que pueden tener en diferentes aspectos (Orr, 2009), uno de ellos es el eventual efecto secundario sobre otras especies de insectos fitófagos, entomófagos, polinizadores u otros. En ese sentido el objetivo del presente trabajo fue identificar las especies parasitoides asociadas a mosca blanca y determinar el porcentaje de parasitismo que proveen y conocer el efecto de variedades de algodonero transgénico y convencional sobre su parasitismo en tres lotes de cultivo, en tres fechas de siembra, en el norte de Sinaloa.
El trabajo se desarrolló en el norte de Sinaloa, en tres lotes agrícolas comerciales ubicados en el municipio de Guasave, en el lote La Maroma N= 25°.69110 O= 108°.51027, en el lote El Coyote N= 25°.78130 O= 108°.68712 y en el Campo Experimental Miguel Leyson N= 25° 30 5.32 O= 108° 22 36.28, en cultivo de algodonero establecidos el 27 de octubre, 10 de noviembre y 01 de diciembre de 2011, en el orden citado. El manejo agronómico del cultivo estuvo a cargo de los productores propietarios de los predios agrícolas y las labores se registraron en su momento.
Se evaluaron tres variedades de algodonero: 1. DP 393 (convencional), 2. DP 167RF Solución Faena Flex® y 3. DP 0935B2RF Bollgard®II/Solución Faena Flex®; el estudio consistió en identificar los parasitoides de MB y estimar el número de ejemplares obtenidos de ninfas grandes (tercer y cuarto instar) presentes en 10 hojas de algodonero completamente desarrolladas, recolectadas del estrato medio de la planta en tres repeticiones; es decir, 30 hojas por tratamiento (variedades), a partir de la segunda semana de abril hasta la segunda, tercera semana de junio y primera semana de julio, de acuerdo al campo agrícola, en muestreos a intervalos semanales; en el lote El Coyote los muestreos iniciaron a partir de 50% de fructificación hasta 50% de capullos abiertos, en el Campo Leyson a partir de inicio de bellotas hasta 50% de capullos abiertos y en La Maroma en etapa fenológica de inicio de primeros cuadros (botones florales) (PC) hasta inicio de capullos abiertos. Las muestras se recolectaban por la mañana en los campos de algodonero y en bolsas de papel debidamente etiquetadas se trasladaban al laboratorio de Entomología del INIFAP-Campo Experimental Valle del Fuerte, en donde cada hoja se confinaba en un vaso de plástico desechable núm. 12 y se cubría con tela de polipropileno (Agribon®) atada con una liga (banda de caucho), para permitir la ventilación y evitar la salida o introducción de insectos, así se mantenían durante una semana y luego se revisaban al microscopio los insectos contenidos en el vaso para separar, identificar los parasitoides de acuerdo a claves taxonómicas de Werner (s/f) (una muestra de los ejemplares obtenidos se conserva el laboratorio de Entomología del INIFAP-CEVAF) y contar los parasitoides emergidos. Además se realizaron tres muestreos, en enero o febrero, mayo y junio, para medir la población de adultos del insecto plaga mediante inspecciones directas de hojas del quinto nudo apical, en el estrato superior de la planta, de acuerdo al muestreo binomial modificado (Ellsworth et al., 1994), revisando 20 hojas por repetición (una/planta), 60 hojas por tratamiento, con el fin de determinar la abundancia poblacional del insecto plaga con relación a la presencia de parasitoides.
Se utilizó un diseño experimental completamente aleatorio con tres repeticiones, en cada parcela experimental; los datos de los resultados se analizaron estadísticamente mediante el programa SAS V8 (Statical Analisys System, 2008), de acuerdo al diseño experimental empleado, se llevó a cabo un análisis de varianza utilizando cada fecha de siembra como repetición en las dos variables medidas y se realizó una prueba de comparación de medias de Tukey de los tratamientos a una p≤ 0.05.
Identificación de parasitoides y su abundancia
Se obtuvo un total de 771 especímenes parasitoides de MB en los tres lotes de evaluación, 136 de El Coyote, 270 en el Campo Leyson y la mayor cantidad 365 ejemplares obtenidos en La Maroma (Figuras 1, 2 y 3). En todos los casos la especie parasitoide identificada fue Eretmocerus eremicus (Rose y Zolnerowich) (=Eretmocerus sp. nr. californicus, Arizona strain) (Hymenoptera: Aphelinidae), el parasitoide más importante de MB en el norte de Sinaloa por su abundancia, el otro presente en la región pero no obtenido en éste estudio es Encarsia formosa Gahan (Hymenoptera: Aphelinidae) (Avilés et al., 2004; Cortez et al., 2005). Desafortunadamente no se midió el porcentaje de parasitismo inducido, sin embargo, debió ser interesante pues se llegaron a obtener promedios de casi 20 ejemplares parasitoides en promedio/hoja/fecha de muestreo (Figuras 2 y 3), a pesar de aplicaciones de insecticidas realizadas contra diferentes insectos plaga e incluso contra MB en la parcela La Maroma; en El Coyote se realizaron aspersiones de insecticidas contra lepidópteros y picudo del algodón, y en el Campo Leyson sólo contra lepidópteros.

Figura 1 Número promedio de parasitoides hoja-1 de MB obtenidos de ninfas, en tres variedades de algodonero en el lote El Coyote.
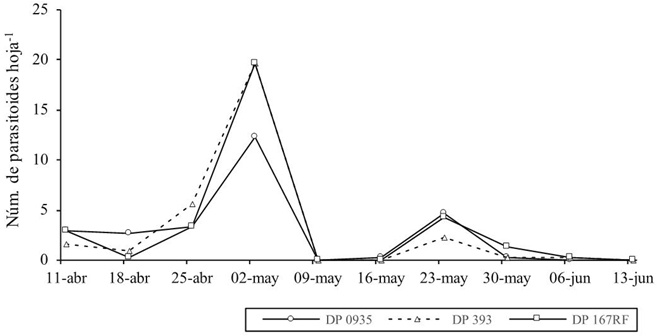
Figura 2 Número promedio de parasitoides hoja-1 de MB obtenidos de ninfas, en tres variedades de algodonero en el lote Campo Leyson.

Figura 3 Número promedio de parasitoides hoja-1 de MB obtenidos de ninfas, en tres variedades de algodonero en el lote La Maroma
No se observó diferencia significativa entre tratamientos (variedades) transgénicas y convencional (p> 0.05) respecto al número de parasitoides hoja-1 de algodonero de MB, lo cual coincide con Romeis et al. (2006) en el sentido de que los cultivares transgénicos no afectan la presencia y comportamiento de insectos no blanco; en El Coyote la mayor media de parasitoides por muestra fue para el tratamiento convencional DP 393 con 6.3 avispitas hoja-1, 4.9 y 4.4 avispitas hoja-1 para los tratamientos DP 0935 y DP 167RF (Figura 1), en el Campo Leyson la mayor media correspondió a la variedad transgénica DP 167RF con 9.7 avispitas hoja-1, 9.3 y 8 avispitas hoja-1 para las variedades DP 393 y DP 0935 (Figura 2), en La Maroma la mayor media fue para la variedad DP 0935 con 11eretmocerus hoja-1, 10.5 y 6.6 parasitoides/muestra para DP 393 y DP 167RF (Figura 3).
Lo anterior significa que la naturaleza de los tratamientos evaluados no tuvo efecto sobre el parasitismo de MB. Esto debido posiblemente a que la tecnología Bt no tiene un efecto directo sobre MB, en éste sentido Bernal et al. (2010) observaron que el maíz transgénico influye negativamente en la búsqueda de Cotesia marginiventris (Cresson) parasitoide de larvas del gusano cogollero Spodoptera frugiperda (J. E. Smith) alimentadas con tejido de maíz transgénico; además que las endotoxinas Bt presentes en las larvas de gusano cogollero así alimentadas afectan al parasitoide C. marginiventris (Ramírez et al., 2007). Por otro lado, aunque los valores reales de las poblaciones de adultos de mostraron mayor abundancia en la variedad convencional sobre las transgénicas en las tres parcelas experimentales (Figura 4), en el ANVA no se detectó diferencia significativa entre tratamientos (p> 0.05).

Figura 4 Número promedio de adultos de MB hoja-1 del Quinto nudo apical en tres variedades de algodonero, en tres parcelas comerciales.
Se desconoce a que se debió el mayor incremento uniforme del parasitoide durante la tercera fecha de muestreo de abril y primera semana de mayo en las tres parcelas y en las tres variedades, posiblemente está relacionado con las condiciones climáticas, sobre todo temperatura, en este sentido Weeden et al. (2012) mencionan que las temperaturas óptimas parael rápido desarrollo y producción de huevo de E. eremicus es de los 25-29 °C. En el municipio de Guasave, alrededor del área experimental la temperatura media histórica de abril y mayo es de 22.6 y 24.6 °C (Ruíz et al., 2005), las temperaturas de fines de mayo e incluso de junio todavía son propicias para el parasitoide, pero en este estudio las poblaciones del hospedero declinaron antes o al menos fueron más abundantes en fechas anteriores.
Abundancia y comportamiento de la mosca blanca
La abundancia de E. eremicus se relacionó positivamente con la abundancia del hospedero [respuesta numérica positiva (Rodríguez, 2007)] al incrementarse entre el primer y segundo lote experimental, conforme se incrementó el hospedero; mientras en la tercera fecha la abundancia de los parasitoides en los picos poblacionales fue semejante a la segunda fecha de siembra, posiblemente debido a la aspersión de insecticidas para el control de la misma MB; no obstante, el total de especímenes de avispita eremicus fue la mayor (365) porque el periodo de incremento del parasitoide fue por una semana más y para el 30 de junio ya no se obtuvo. De acuerdo a lo anterior, la mayor población de MB y del parasitoide fue en la parcela La Maroma, seguida por el Campo Leyson y El Coyote tuvo la menor población (Figura 4), correspondiendo el comportamiento poblacional del insecto plaga al efecto de la fecha de siembra, como ya se indicó el algodonero se sembró el 27 de octubre en El Coyote, el 11 de noviembre en el Campo Leyson y el 01 de diciembre en La Maroma, o sea, la densidad poblacional fue influida por la fecha de siembra (Cortez et al., 2005), entre otros factores, la cual a la vez fue influida por las condiciones climáticas, principalmente temperatura.
En las tres parcelas de evaluación el comportamiento fluctuacional del parasitoide E. eremicus fue parecido, salvo algunas excepciones, se detectó desde el primer muestreo y su población se incrementó en la tercera semana de abril, mostrando el máximo incremento en la última semana del mismo mes y en la primera semana de mayo, y para la tercera semana de mayo la población decreció practicamente al mismo nivel poblacional observado en el primer muestreo. Cabe señalar, que el comportamiento poblacional de la MB fue diferente en cada parcela, en tres muestreos realizados en las etapas de primeros cuadros (botones florales), 50% de floración y 50% de capullos, en El Coyote la mayor cantidad de adultos se observaron en el primer muestreo (PC) el 27 de enero, en el Campo Leyson la mayor abundancia de adultos de MB ocurrió en el segundo muestreo (50% de floración) el 16 de mayo y en La Maroma la mayor cantidad de adultos de MB se registraron igual que en El Coyote, en el primer muestreo (PC).
El 04 de abril, en cada parcela de evaluación la abundancia de la MB fue homogenea; es decir, las tres variedades de algodonero presentaron la mayor población del insecto en la misma fecha de muestreo, lo que denota que la etapa de desarrollo del cultivo fue determinante para el crecimiento poblacional de MB, lo cual está documentado (Cortez et al., 2005). No obstante lo anterior, el comportamiento fluctuacional del parasitoide, como ya se señaló, fue parecido en las tres parcelas (Figuras 1, 2 y 3) y en las tres variedades de algodonero evaluadas, con diferente fecha de siembra y diferente época de incremento poblacional de la MB.
Implicaciones de los resultados obtenidos
Los resultados permiten sugerir el control biológico por conservación y aprovechamiento de E. eremicus sobre MB en algodonero, estableciendo el cultivo temprano durante la fecha de siembra autorizada para el norte de Sinaloa por la Secretaría de Agricultura, Ganadería, Pesca y Alimentación (SAGARPA) (15 de noviembre al 15 de diciembre, CEVAF, 2003). El empleo de variedades transgénicas, efectivas para el control de lepidópteros plaga del algodonero, como se ha determinado en diferentes partes del mundo, así como en el norte de la entidad (Cortez-Mondaca y Martínez-Carrillo, 2007), está sujeto a la autorización del Servicio Nacional de Sanidad, Inocuidad y Calidad Agroalimentaria (SENASICA). El presente documento constituye el primer reporte formal de parasitismo de E. eremicus sobre MB en algodonero, en el norte de Sinaloa.
Conclusiones
La especie parasitoide de mosca blanca en algodonero fue Eretmocerus eremicus (Rose y Zolnerowich) (= Eretmocerus sp. nr. californicus, Arizona strain) (Hymenoptera: Aphelinidae). No se observó diferencia significativa en parasitismo de mosca blanca entre variedades de algodonero transgénicas y convencionales modificadas tradicionalmente. Así como tampoco entre las poblaciones de adultos de mosca blanca en variedades de algodonero transgénicas y convencional, y sus poblaciones fueron significativamente mayores en la fecha de siembra más tardía (01 de diciembre) en el lote La Maroma y las menores en la fecha de siembra más temprana (27 de octubre) en el lote El Coyote.











 texto em
texto em 


