Introducción
Los cítricos se desarrollan en las regiones tropicales y subtropicales del mundo. En México, la agroindustria citrícola representa una de las más importantes, generando una derrama económica superior a los 375 millones de dólares (SIAP, 2016). El mejoramiento genético de este cultivo constituye una actividad rutinaria que se lleva a cabo en varios países con el objetivo de mejorar la calidad de la fruta o conseguir tolerancia a estrés biótico y abiótico (Tozlu et al., 1999; Mendoza-Rodríguez et al., 2001; Machado et al., 2011; Omura y Shimada, 2016).
Las especies del género Citrus presentan poliembrionía y apomixis, que generan alteraciones en el proceso de reproducción sexual entre organismos vegetales, en el que múltiples embriones se encuentran en una semilla o donde varios embriones derivados del progenitor receptor del polen se origina del tejido nucelar que rodea al embrión cigótico (Koltunow et al., 1996; Kepiro y Roose 2007). La mayoría de los cítricos comerciales de todo el mundo se propagan como árboles injertados con la variedad de interés en un portainjerto (Wutscher y Hill, 1995; Khan y Kender, 2007).
La mayor parte de estos portainjertos son apomícticos, por lo que si se requiere mantener la homogeneidad genética puede resultar ventajosa esta condición como un proceso de multiplicación clonal. De esta forma, se pueden producir plantas uniformes a partir de semillas a bajo costo. Por otra parte, cuando es deseable generar variabilidad mediante recombinación genética para la obtención de híbridos, con resistencia a enfermedades por ejemplo, entonces la apomixis representa un obstáculo, ya que las plantas resultan genéticamente idénticas al progenitor receptor del polen (Khan y Kender, 2007). Para la identificación de plantas cigóticas en cítricos, se han utilizado marcadores fenotípicos, los cuales se basan principalmente en la morfología de las hojas.
Por otra parte, los ensayos isoenzimáticos y el empleo de la citometría de flujo también se han utilizado como herramientas para realizar este tipo de análisis (Anderson et al., 1991; Ruiz et al., 2000; Viloria et al., 2005); sin embargo, estas técnicas pueden presentar algunas limitaciones. En la actualidad, el uso de la biología molecular ha permitido ampliar las herramientas utilizadas para la identificación genética de especies vegetales mediante el uso de marcadores moleculares, entre los cuales destacan los ISSR (Inter Simple Sequence Repeat), RAPD (Random Amplification of Polymorphic DNA) y SSR (Simple Sequence Repeat) por sus siglas en inglés (Bastianel et al., 1998; Golein et al., 2011; Yildiz et al., 2013; Mondal y Saha, 2014; Mondal et al., 2015).
En Turquía se ha reportado el uso eficiente de los oligonucleótidos AG14 y TAA03 de marcadores SSR para identificar y eliminar individuos nucelares en poblaciones de híbridos, resultado de cruzamientos entre variedades de mandarinas (C. reticulata), naranjas (C. sinensis) y toronjas (C. paradisi) (Yildiz et al., 2013). Recientemente en la India se han empleado cuatro oligonucleótidos SSR con repeticiones AG: CCSM13, CCSM17, CCSM18 y CCSM147 para identificar plantas cigóticas y nucelares en una población de C. reticulata (Mondal et al., 2015).
En México, las especies de C. macrophylla y C. volkameriana son comúnmente utilizadas como portainjertos para la propagación y establecimiento de árboles de limón mexicano. En el año 2004, Andrade-Rodríguez et al. (2004), realizaron un estudio para determinar el origen cigótico o nucelar en C. volkameriana utilizando marcadores RAPD, obteniéndose resultados satisfactorios. De la misma manera, en el caso del limón mexicano (C. aurantifolia), se han utilizado exitosamente marcadores RAPD, destacando el uso del decámero OPH15 (Mondal y Saha, 2014); sin que existan reportes en los que se haya empleado otro tipo de marcadores moleculares, como los SSR.
En el programa de mejoramiento genético del INIFAP, se realizan rutinariamente cruzas entre limones mexicanos (C. aurantifolia) y limones italianos (C. limon), ya que se ha observado que la progenie presenta cierta tolerancia a la enfermedad bacteriana del HLB (Huanglongbing o enfermedad del dragón amarillo), la cual ocasiona uno de los principales problemas fitosanitarios que afectan la productividad en la región del Pacífico de México. A pesar de que existen muchos reportes para la identificación de plantas cigóticas en cítricos utilizando marcadores moleculares, en México no se han reportado estudios utilizando marcadores SSR para identificar plantas híbridas de C. aurantifolia. Con el objetivo de establecer las variaciones en los híbridos derivados de la polinización controlada entre C. aurantifolia var. “Colimex”×C. limon var. “Rosenberg” y su recíproca, se realizó el presente trabajo con el uso de marcadores SSR.
Materiales y métodos
Material vegetal
Se colectaron hojas con apariencia sana de árboles de limón de dos poblaciones progenie para identificar individuos de origen cigótico y confirmar la condición híbrida de las plantas. La cruza C. aurantifolia (♀)×C. limon (♂) consistió de 40 individuos, mientras que la cruza C. limon (♀)×C. aurantifolia (♂) la constituyeron 43 individuos. El muestreo se realizó en árboles de 12 meses de edad, los cuales se encuentran establecidos en el campo dentro del programa de mejoramiento genético de limón mexicano del INIFAP Campo Experimental Tecomán, Colima, México, ubicado a 60 msnm.
Extracción de DNA genómico
Se utilizó el método descrito por Bermúdez-Guzmán et al. (2016), con algunas modificaciones. Todas las centrifugaciones se llevaron a 4 °C y 13 500 rpm. Las hojas de las plantas se lavaron con agua y jabón corrientes. Enseguida se pesaron aproximadamente 100-200 mg de tejido foliar y se pulverizaron en un mortero conteniendo nitrógeno líquido y homogeneizados con 1 mL de solución amortiguadora CTAB [100 mM de Tris-HCl pH 8, 50 mM de EDTA pH 8, 1.4 M de NaCl, 3% (p/v) de CTAB y 1% (p/v) de PVP]. Posteriormente se adicionó 10 μL de 2-β-mercaptoetanol concentrado y 5 μL de proteínasa K (20 mg mL-1).
Las muestras se incubaron durante 45 min a 65 °C en baño maría, se mezclaron por inversión cada 5-10 min, después se centrifugaron durante 3 min. La fase acuosa se recuperó en un nuevo tubo y se agregó 5 μL de RNasa A 10 mg mL-1 (Sigma Aldrich) a 37 °C durante 10 min. Posteriormente se adicionó un volumen de la solución fenol:cloroformo:alcohol isoamílico (25:24:1), se mezcló vigorosamente usando un vórtex y se centrifugaron durante 10 min.
El sobrenadante recuperado se colocó en tubos de 1.5 mL y el DNA se precipitó con 0.6 volúmenes de isopropanol frío y 0.1 volúmenes de acetato de sodio 3 M pH 5.2 a -20 °C durante 30 min. La mezcla se centrifugó durante 10 min, el sobrenadante se decantó y el DNA se lavó con 500 μL de etanol al 70%; los tubos se centrifugaron durante 2 min la fase acuosa se decantó y se invirtieron los tubos sobre papel absorbente para retirar el exceso de etanol. Los DNA se secaron a temperatura ambiente, resuspendidos en 80 μL de amortiguador TE (10 mM de Tris-HCl, 1 mM de EDTA, pH,8) y finalmente, almacenados a -20 °C.
Cuantificación, pureza e integridad del DNA genómico
La concentración del DNA (ng μL-1) se cuantificó con un espectrofotómetro (NanoDrop Thermo Scientific). La pureza se midió considerando las relaciones de A260:280 y A260:230. La integridad de los ácidos nucleicos se verificó mediante electroforesis en gel de agarosa (Sigma Aldrich) al 1% cargando 5 µL de DNA genómico de cada muestra. El gel se tiñó con Bromuro de etidio 10 mg mL-1 (Sigma Aldrich) y visualizó con luz ultravioleta en un fotodocumentador (UVP).
Análisis de marcadores SSR
Los progenitores C. aurantifolia y C. limon se analizaron con ocho juegos de oligonucleótidos descritos por Kijas et al. (1997) (Cuadro 1) para identificar aquellos que generan polimorfismos diferenciales en ambas especies. Los oligonucleótidos seleccionados se utilizaron para analizar las dos poblaciones progenie de C. aurantifolia×C. limon y su recíproca.
Las reacciones de amplificación por PCR se realizaron en un volumen de 15 µL conteniendo 7.5 µL de REDTaq ReadyMixTM (Sigma Aldrich), 5 µL de DNA genómico (20 ng µL-1), 1 µL de cada oligonucleótido y 0.5 µL agua grado molecular. Las condiciones de amplificación para la PCR se llevaron a cabo en un termociclador MultiGene Labnet y fueron las descritas por Kijas et al. (1997) con algunas modificaciones: desnaturalización inicial a 94 °C por 5 min, seguido de 35 ciclos de 94 °C por 1 min, 55 °C por 30 s y 72 °C por 1 min. La extensión final fue de 72 °C por 10 min.
Se utilizó la electroforesis vertical en gel de poliacrilamida bajo condiciones no desnaturalizantes utilizando el sistema de dobles geles “PerfectBlue” (PeQlab). Se cargó 1 µL de marcador de peso molecular de 25 y 50 pares de bases (pb) (Bioline) y 3 µL del producto de PCR de cada muestra. Los geles se prepararon en un volumen de 30 mL conteniendo acrilamida/bis-acrilamida (29:1) al 6%, amortiguador TBE 1 X, 140 µL de APS al 25%, 35 µL de TEMED y agua destilada estéril, después se corrieron a 200 V durante 50 min. Finalmente se tiñeron con solución de plata de acuerdo Sanguinetti et al., (1994) con algunas modificaciones: 10 min en solución fijadora (10% de etanol y 0.5% de ácido acético), 1 enjuague con agua destilada, 10 min en solución de tinción (0.2% de AgNO3), 1 enjuague con agua destilada, 10-15 min en solución reveladora (3% de NaOH y 0.5% de formaldehído) y un último enjuague con agua destilada. Los geles se visualizaron en un transiluminador con luz blanca para su análisis.
Resultados y discusión
Se evaluaron ocho oligonucleótidos para detectar bandas diferenciales en los progenitores C. aurantifolia y C. limon utilizados en la investigación (Cuadro 1). Los oligonucleótidos TAA45 y cAGG09 se seleccionaron debido a que permitieron la amplificación de bandas polimórficas de fácil interpretación; cuatro de los oligonucleótidos amplificaron mayormente bandas monomórficas no informativas y de baja resolución, por lo que no se utilizaron para la detección de híbridos en las poblaciones analizadas. El iniciador TAA41 generó bandas muy difusas que no se registraron. Por otra parte, el cebador TAA52 no permitió la amplificación de algún segmento de DNA en las muestras analizadas (Figura 1).

Figura 1 Evaluación de oligonucleótidos de marcadores SSR a partir de DNA de progenitores. C= Citrus aurantifolia var. “Colimex”. R= Citrus limon var. “Rosenberg”. MPM= marcador de peso molecular 25 y 50 pb (Bioline).
Los oligonucleótidos de la serie TAA descritos por Kijas et al. (1997) se han utilizado ampliamente en la detección de híbridos entre cruzamientos de varias especies de cítricos como toronja (C. paradisi), naranjo trifoliado (C. trifoliata), naranjo dulce (C. sinensis) y mandarina (C. reticulata) (Ruiz et al., 2000; Ahmad et al., 2012; Yildiz et al., 2013; Mondal et al., 2015). Sin embargo, no hay reportes de su uso en limón mexicano (C. aurantifolia) y limón italiano (C. limon), por lo que estos resultados constituyen el primer reporte en estas especies para determinar su potencial como detectores de híbridos en los programas de mejoramiento genético.
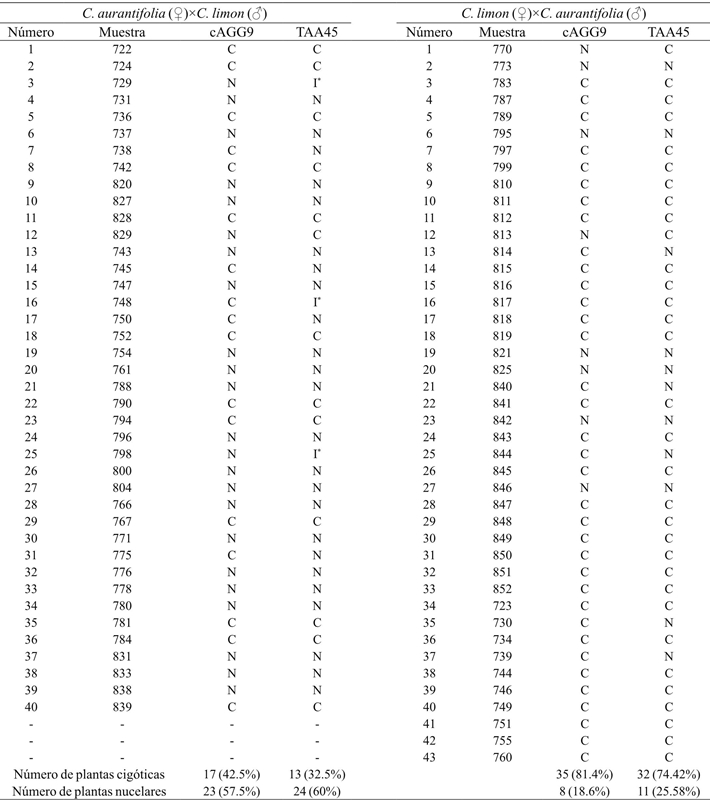
En las poblaciones de 40 y 43 individuos procedentes de las cruzas de C. aurantifolia var. “Colimex”×C. limon var. “Rosenberg” y su recíproca, respectivamente, se lograron detectar un total de 52 híbridos con los oligonucleótidos TAA45 y cAGG09 (Cuadro 2). El marcador TAA45 amplificó dos alelos polimórficos, uno presente en “Colimex” y ausente en “Rosenberg” de aproximadamente 100 pb y otro presente en “Rosenberg” y ausente en “Colimex” de 110 pb. Este último fragmento en algunos geles se visualizó como una única banda; sin embargo, se trataba de tres bandas polimórficas con pesos moleculares muy similares, por lo que en ocasiones no alcanzaban a separarse. En la Figura 2a se observan los híbridos detectados con el marcador TAA45 (722, 724, 736, 742 y 828), el cual también amplificó otras bandas polimórficas que no se tomaron en cuenta para la identificación de híbridos debido a su baja resolución.
*= no amplificó o presentó barrido el carril del gel.
Cuadro 2 Origen cigótico o nucelar de las poblaciones de C. aurantifolia×C. limon y su recíproca mediante análisis SSR utilizando dos pares de oligonucleótidos. C= cigótico; N= nucelar; I= indeterminado.

Figura 2 Perfiles electroforéticos obtenidos con los oligonucleótidos TAA45 (A) y cAGG09 (B). MPM:marcador de peso molecular 25 pb (Bioline). ♀=planta receptora de polen. ♂= planta donadora de polen. C= C. aurantifolia var. “Colimex”. R= C.limon var. “Rosenberg”. N= origen nucelar. C= origen cigótico (híbridos). Los números corresponden a diferentes muestras progenie.
El iniciador cAGG09 amplificó cuatro bandas polimórficas en las poblaciones analizadas, con pesos moleculares aproximados de 90, 100, 110 y 170 pb. En ambas poblaciones, con este marcador, se amplificó una banda monomórfica de 80 pb no informativa. Los híbridos de “Colimex” se identificaron por los alelos de 90 y 170 pb (Figura 2b, carriles 722, 724, 736, 738 y 742), los cuales están presentes en “Rosenberg” (donador del polen) y ausentes en “Colimex” (receptor del polen).
De manera similar, los híbridos de “Rosenberg” se identificaron por los alelos de 105 y 115 pb, los cuales están presentes en “Rosenberg” y ausentes en “Colimex”. En este sentido, se considera que un híbrido puede ser determinado identificando un solo locus codominante para el cual los progenitores no comparten alelos; es decir, cruzas de la configuración aa×bb, ab×cc o ab×cd. También se pueden usar marcadores dominantes, como RAPD e ISSR, si el progenitor receptor del polen es 00 (banda ausente) y el donador del polen es 11 (banda homocigótica presente) (Kepiro y Roose, 2007). Sin embargo, la confirmación con un segundo locus es siempre deseable para confirmar la condición híbrida del individuo, lo cual se realizó en el presente trabajo con el uso de los marcadores TAA45 y cAGG09, cuyos polimorfismos de cada progenitor segregaron en la descendencia según la población correspondiente.
Los marcadores SSR constituyen una herramienta útil para el estudio de la diversidad genética de cítricos por su eficacia e información (Amara et al., 2011; Biswas et al., 2011). Su empleo para la detección de híbridos (Ruiz et al., 2000; Oliveira et al., 2002; Ahmad et al., 2012; Yildiz et al., 2013; Mondal et al., 2015) resulta más práctico, efectivo y ventajoso, debido que los trabajos que utilizaron RAPD e ISSR (Bastianel et al., 1998; Andrade-Rodríguez et al., 2004; Golein et al., 2011) por lo general obtienen una gran cantidad de bandas monomórficas no informativas que pueden dificultar el análisis de los datos. Los RAPD e ISSR, al ser marcadores dominantes no permiten diferenciar individuos heterocigotos a diferencia de SSR que son marcadores codominantes.
Además, los RAPD presentan una baja reproducibilidad, ya que pequeñas modificaciones en la técnica tales como concentración de DNA molde, grado de pureza y fidelidad de la enzima DNA polimerasa, entre otros factores, pueden alterar el patrón de fragmentos amplificados de DNA generados para una muestra. Adicionalmente, los RAPD no son locus-específicos, por lo que perfiles electroforéticos de bandas no pueden ser interpretados en términos de loci y alelos, y fragmentos de tamaño similar pueden no ser homólogos (Martínez et al., 2010; Kumari y Thakur, 2014).
En este estudio se realizaron cruzamientos bidireccionales de C. aurantifolia×C. limon, obteniéndose 42.5% de plantas híbridas cuando se utilizó a “Colimex” como receptor del polen, y 81.4% cuando se empleó a “Rosenberg” con el mismo propósito (Cuadro 2). Las toronjas, naranjas y mandarinas presentan más de 90% de embrionía nucelar, dependiendo de la variedad. En limón mexicano, la proporción de plántulas nucelares es 78%, mientras que para limones italianos es 32-33% (Frost y Soost, 1968). Los resultados de este trabajo tuvieron porcentajes ligeramente inferiores, 57.5 y 18.6% de embrionía nucelar en “Colimex” y “Rosenberg”, respectivamente. Estos valores bajos a los reportados previamente, podrían deberse a factores nutricionales y a la interacción genotipo-ambiente (Kepiro y Roose 2007).
En este estudio se consideraron como híbridos aquellos individuos con origen cigótico, ya que las polinizaciones se controlaron, evitándose eventos de autofecundación. Ambos marcadores, cAGG09 y TAA45, coinciden en 80 y 83.72% en las plantas determinadas como híbridos para las poblaciones de C. aurantifolia×C. limon y su recíproca, respectivamente. Las muestras en las que ambos marcadores no coincidieron con el origen cigótico o nucelar de la progenie, se consideró el resultado del oligonucleótido cAGG09 debido a que amplificó bandas polimórficas bien definidas.
Por otro lado, se ha comparado la eficacia de las isoenzimas y marcadores SSR para detectar híbridos, concluyendo que los marcadores moleculares son más eficientes para este fin. En esta misma investigación utilizaron los oligonucleótidos empleados en este trabajo: TAA41 y TAA45 obtuviendo polimorfismos que permitieron identificar el origen cigótico en poblaciones de C. reticulata×C. sinensis y autopolinización de Poncirus trifoliata (Ruiz et al., 2000). Aunque en el presente trabajo el uso del iniciador TAA41 amplificó patrones de bandas difusas no informativas. En otro estudio, combinaron el empleo de marcadores morfológicos asistido por marcadores moleculares SSR de la serie CCSM para detectar híbridos derivados de C. reticulata y C. sinensis (Oliveira et al., 2002).
Sin embargo, únicamente confirmaron la condición híbrida de las plantas detectadas por morfología, por lo que queda en duda la posible existencia de más individuos con origen sexual que pudieran ser detectados por los marcadores SSR. Por su parte Ahmad et al. (2012) emplearon los iniciadores: TAA15, TAA27, TAA33 y otros más de la serie CCSM para detectar híbridos en tres poblaciones F1 de varias cruzas de naranjas y mandarinas, logrando detectar 23 y 5 híbridos de las cruzas de las variedades “NARC 05-18”דTarocco” y NARC 05-17דSanguinello”, respectivamente. Adicionalmente, identificaron 35 híbridos más de “Kinnow”דTarocco” con el marcador CCSM147. Yildiz et al. (2013) utilizaron los iniciadores TAA01, TAA3, TAA41, TAA45, TAA52, CAC33 y cAGG09 para detectar híbridos en varias poblaciones empleando como receptores del polen a las mandarinas y realizando cruzamientos con naranjas y toronjas.
De los 500 individuos que constituían las progenies de las diversas cruzas, los iniciadores AG14 y TAA3 fueron los más efectivos para identificar individuos cigóticos. Las mandarinas “Fremont” y “Robinson” produjeron 36.91 y 31.09% de plantas nucelares, respectivamente. Finalmente, Mondal et al. (2015) recientemente hicieron uso de los oligonucleótidos TAA15, TAA27 y TAA33 para detectar híbridos de C. reticulata y reportaron que ninguno de estos iniciadores permitió la identificación del origen sexual en la progenie evaluada, por lo que recurrieron a los iniciadores de la serie CCSM para su identificación.
A pesar de que los marcadores SSR proveen información útil para la identificación de plantas híbridas en diferentes especies de cítricos, para este propósito se requiere de la implementación de técnicas como tecnología de diversidad por arreglos (DArT, “diversity array technology”), polimorfismos de nucleótido simple (SNP, “single nucleotide polymorphism”) o fusión de alta resolución (HRM, “high resolution melt”); sin embargo, actualmente resultan muy costosas.
Conclusiones
Los marcadores SSR permitieron la identificación eficiente de plantas cigóticas y nucelares en poblaciones progenie de limón mexicano “Colimex” y limón italiano “Rosenberg”. Con el uso del cebador cAGG09 se identificó la amplificación de 4 alelos polimórficos, suficientes para determinar el origen sexual de las plantas de limón mexicano; sin embargo, la confirmación con un segundo locus es siempre deseable para confirmar la condición híbrida de los individuos.
Se lograron identificar un total de 52 híbridos en las poblaciones de las cruzas C. aurantifolia (♀)×C. limon (♂) y C. limon (♀)×C. aurantifolia (♂). Además, los híbridos identificados pueden ser infectados con HLB en condiciones de campo para determinar el nivel de tolerancia a la enfermedad.











 texto en
texto en 



