Introducción
El trigo es el principal cultivo en Sonora, aportando alrededor de 48% de la producción nacional (Servicio de Información Agroalimentaria y Pesquera, 2015); sin embargo, diferentes factores bióticos y abióticos en la región propician la incidencia de algunos organismos fitopatógenos, los cuales, a través de diferentes mecanismos y vías de infección, pueden causar enfermedades en distintas etapas del desarrollo vegetal. Las enfermedades más importantes que afectan al trigo en la región es el carbón parcial, causado por el hongo Tilletia indica (Mitra), el cual se caracteriza por infectar desde el embrión al resto del grano, evidenciando manchas de café a negras y afectando las propiedades organolépticas a partir de 3% de infección (Bhat et al., 1980).No tener un impacto significativo sobre el rendimiento del cultivo, ha sido una enfermedad de importancia cuarentenaria internacional que ha dificultado la exportación de las regiones donde la enfermedad se manifiesta, influyendo en la preferencia de los agricultores por el cultivo de trigo cristalino (Triticum turgidum subsp. durum). Lo anterior, debido a que notablemente se ha comprobado la alta resistencia de las variedades de trigo cristalino sobre las de trigo harinero (Triticum aestivum), generalmente susceptibles a la enfermedad (Camacho-Casas et al., 2010).
El mejoramiento genético es una de las mejores opciones para combatir la enfermedad, ya que no incrementa el costo de producción y disminuye la utilización de sustancias nocivas. Aunque no se ha detectado inmunidad en variedades comerciales actuales, se han observado diferencias genéticas en la susceptibilidad a la enfermedad, en los últimos años se han liberado variedades de trigo obtenidas por los programas de mejoramiento considerando factores de rendimiento, calidad y el grado de resistencia a carbón parcial (Fuentes-Dávila y Singh, 2007; Figueroa-López et al., 2012).
Las cistatinas son una familia de proteínas con actividad inhibitoria de proteasas; existe evidencia que las cistatinas juegan un papel determinante en la activación de los mecanismos de defensa de las plantas, habiéndose identificado en variedad cultivos (Margis et al., 1998). La expresión de cistatinas difiere en determinadas fases de desarrollo de la planta y en respuesta a condiciones de estrés debido a la interacción que realiza con el patógeno. Algunos estudios han relacionado la expresión de cistatinas con la inhibición de plagas (Santamaría et al., 2012) y enfermedades en diferentes cultivos como soya, arroz y papa (Azzouz et al., 2005; Munger et al., 2012). En trigo, varios autores señalan a las cistatinas como inhibidoras de patógenos como Microdochium nivale, causante del moho nival (Christova et al., 2006), Fusarium graminearum, causante de la fusariosis de la espiga (Gottwald et al., 2012) y Tilletia indica, agente causal del carbón parcial (Gupta et al., 2010; Purwar et al., 2010).
El mecanismo de defensa en el que participan las cistatinas comprende la inhibición de las cisteín-proteasas propias de T. indica, enzimas líticas cuya función es facilitar la nutrición del hongo a partir del grano; esta interacción afecta la viabilidad del desarrollo de la infección (Valdés-Rodríguez et al., 2010). Por lo anterior los patrones de expresión de cistatinas en trigo pueden dilucidar un mecanismo eficaz para explicar la resistencia a carbón parcial. Encontrar evidencias de la relación entre niveles de expresión génica de cistatinas con la resistencia a carbón parcial puede confirmar su aptitud para ser integrados como marcadores genéticos en programas de mejoramiento. El objetivo del presente estudio fue determinar los patrones de expresión de tres genes de la familia cistatinas y su correlación con el porcentaje de infección de T. indica durante tres etapas de desarrollo del trigo.
Materiales y metodos
Ensayo en campo
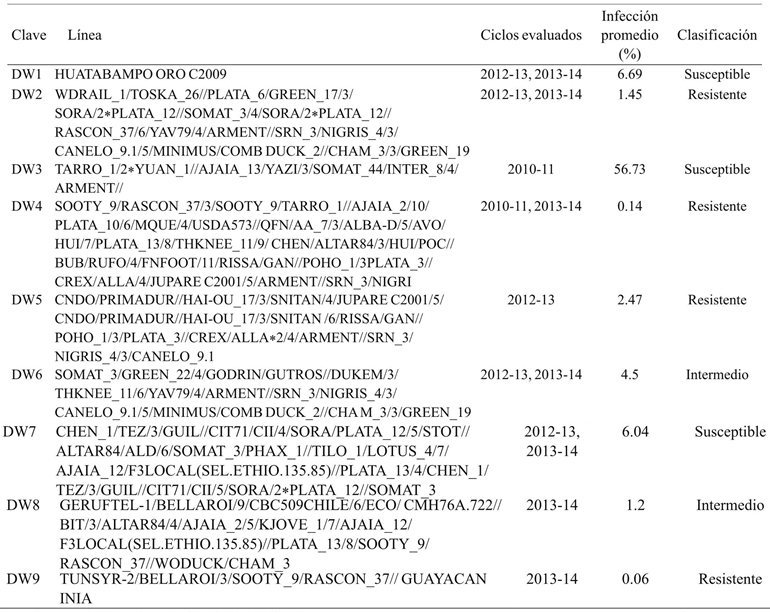
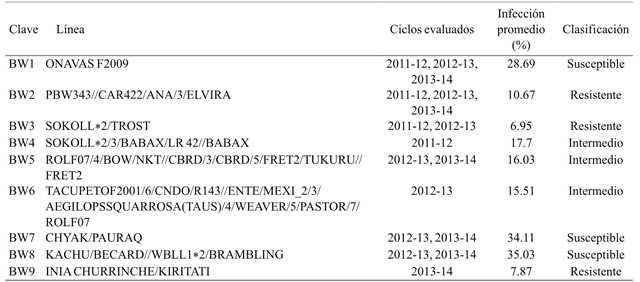
El experimento se llevó a cabo en el Campo Experimental Norman E. Borlaug (CENEB) ubicado en el valle del Yaqui, Sonora (27° 22’ 10.2” N, 109° 55’ 51.5” W) durante el ciclo otoño-invierno 2014-2015. El ensayo consistió en nueve líneas de trigo harinero (Cuadro 1) y nueve líneas de trigo cristalino (Cuadro 2) seleccionadas de acuerdo al grado de susceptibilidad a carbón parcial manifestado en tres ciclos anteriores. Estas fueron inoculadas con esporidios de T. indica durante la etapa de embuche ó GS41-45 de la escala de Zadoks et al. (1974). La producción del inóculo (aislamiento, propagación y concentración esporidial) se realizó con la metodología de Fuentes-Dávila y Figueroa-López (2009).
Fuente: Programa de Mejoramiento Genético de Trigo (CENEB).
Cuadro 1 Líneas de trigo harinero seleccionadas y su respuesta fenotípica histórica a T. indica.
Evaluación de respuesta fenotípica
A la cosecha se trillaron manualmente 30 espigas inoculadas por variedad y se determinó el porcentaje de infección mediante el conteo de granos infectados y sanos por espiga, por unidad experimental y por línea; el porcentaje promedio corresponde a la respuesta fenotípica de cada variedad.
Diseño de oligonucleótidos
Las secuencias de los oligonucleótidos utilizados se listan en el Cuadro 3. Se usaron diversos programas, para la edición y alineamiento de secuencias como CLC Sequence Viewer y la herramienta NCBI Primer Designing Tool, ajustando el tamaño de amplicón a 200 pb. Se incluyó parte de las regiones de la cadena 3’ no codificante para asegurar especificidad entre genes de cistatinas. Se probó la amplificación de los oligonucleótidos (sentido y antisentido) mediante RT-PCR punto final y electroforesis en gel de agarosa al 2%.
Muestreo
Se colectaron espigas y tejido foliar por duplicado para cada línea durante tres etapas del desarrollo fenológico, etapa vegetativa (SV), embuche post inoculación (S1Pi), y pos antesis (S2), correspondiente a GS16-19, GS41-45 y GS69 respectivamente. Dichas muestras se congelaron inmediatamente con nitrógeno líquido y se almacenaron a -80°C hasta su procesamiento.
Extracción de ARN
La extracción de ARN total de 100-200 mg de tejido vegetal congelado se realizó con el reactivo Trizol® (Invitrogen), siguiendo las instrucciones del fabricante con modificaciones. Estas consistieron en la adición de una solución salina (Citrato de Sodio 0.8 M+ NaCl 1.2 M) durante la fase de precipitación en proporción 1:1 v/v con isopropanol y durante la fase de purificación con LiCl (8 M) por hora a 4°C. El RNA fue analizado por electroforesis para verificar su integridad y su concentración y pureza se determinaron por espectrofotometría en el equipo NanoDrop 1000 (NanoDrop Products). Posteriormente, el ARN fue retrotranscrito para generar ADN complementario (ADNc) usando la enzima SuperScript (Invitrogen) de acuerdo a las instrucciones del fabricante.
Reacción en cadena de la polimerasa (PCR) tiempo real
Las amplificaciones se realizaron usando detección química con SYBR Green en reacciones de 20 μl en placas de 96 pozos en un termociclador C1000 con sistema de tiempo real CFX96 (Bio-Rad).
Análisis de expresión génica y correlación
La expresión normalizada de cada gen se calculó usando el método comparativo de Ct (Livak y Schmittgen, 2001). Los datos de abundancia de los transcritos fueron normalizados con la abundancia promedio de los transcritos de genes de referencia endógenos para obtener la expresión normalizada con la fórmula 2^-∆Ct, donde: ∆Ct= (Ct del gen blanco - Ct promedio de los genes referencia).
Se realizo análisis de correlación de Pearson, considerando los porcentajes de infección contra valores de expresión normalizada (2^-ΔCt) individual en tejido foliar y espigas. Se obtuvo el coeficiente de correlación (R), el coeficiente de determinación (R2) y el nivel de significancia al 95% con el paquete informático STATGRAPHIC Centurión XVI.
Resultados y discusión
Porcentaje de infección
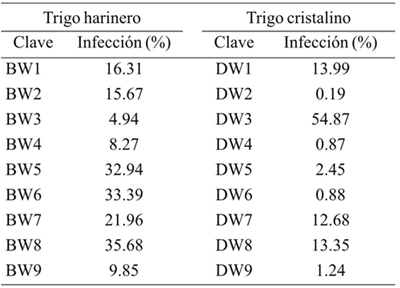
Se inspeccionaron 30 espigas por línea clasificando los granos en “infectados” y “sanos” de acuerdo a la presencia de daño típico por carbón parcial, posteriormente se calculó el porcentaje de infección por espiga y el porcentaje promedio por línea. El Cuadro 4 muestra que la línea de trigo harinero BW3 presentó el porcentaje más bajo de infección (4.94%), mientras la línea con mayor susceptibilidad fue BW8 con 35.68%. Además, las líneas clasificadas como de respuesta intermedia BW4, BW5 y BW6 se mostraron resistente (8.27%), susceptible (33.39%) y susceptible (32.94%) respectivamente.
El trigo cristalino ha mostrado históricamente menores niveles de infección a comparación con el trigo harinero. En el Cuadro 4 se muestran los porcentajes de infección de carbón parcial en trigo cristalino, en éstos se observa que la línea DW2 presenta 0.19% de infección. En contraste, la línea DW3 fue la más susceptible (60.33%). Es notorio el agrupamiento de las variedades en 3 niveles de resistencia a T. indica, resistentes (DW2, DW4, DW5 y DW9), susceptibles (DW1, DW3 y DW7) e intermedios, los cuales tienden a agruparse como resistente (DW6) y susceptible (DW8). Es posible atribuir las variaciones fenotípicas a interacciones genéticas en las líneas de trigo, estas variaciones pueden sugerir la dominancia parcial del atributo de resistencia a carbón parcial.
Expresión normalizada (∆Ct)
Para el cálculo de la expresión génica se requiere normalizar usando datos de expresión de uno o más genes endógenos. Estos se eligieron de la bibliografía con base en la homogeneidad en distintas etapas de desarrollo y tejidos; destacándose EF1A en diferentes tejidos bajo condiciones de estrés biótico y TaWIN1 por su estabilidad en hojas bandera hasta la formación de grano lechoso (Tenea et al., 2011).
Los transcritos de WC1, WC3 y WC5 fueron diferencialmente expresados en genotipos resistentes y susceptibles en todas las etapas de desarrollo evaluadas, asimismo los patrones de expresión normalizada fueron diferentes en tejido foliar y espigas, lo anterior fue determinado mediante pruebas de rangos múltiples Tukey al 95%.
En tejido foliar, las cistatinas se expresaron de forma diferencial durante el desarrollo de la planta (Figura 1). Los niveles de expresión de WC1 fueron significativos (p< 0.05) mayores en las líneas resistentes BW3 en SV (1.015) y BW2 en S1 (1.610) y S2 (1.132). Este patrón se repite en la expresión de WC3, con BW3 en SV (1.182) y BW2 en S1 (2.88) y S2 (2.186). Por otra parte, el comportamiento de los niveles de WC5 fue mixto, ya que la mayor expresión en SV corresponde a las líneas BW1 (0.003), BW3 (0.0026) y BW2 (0.002), teniendo la primera un valor de respuesta susceptible (16.31%). Por otra parte, en S1 la línea BW8 fue la que más expresó WC5 (0.007), siendo ésta la de mayor susceptibilidad (35.68%), mientras en S2 las líneas BW1 y BW2 mostraron los valores más altos, 0.0043 y 0.0036 respectivamente.
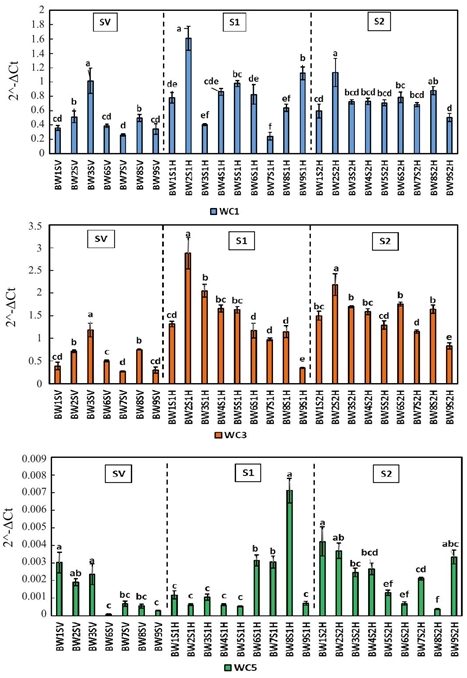
Figura 1 Expresión relativa de cistatinas WC1, WC3 y WC5 en hojas de trigo harinero durante las etapas SV, S1 y S2.Los literales indican diferencia significativa (p< 0.05).
La espiga constituye un punto focal de actividad en el trigo, hacia ésta se movilizan y regulan los nutrientes dirigidos a la formación del grano, además es donde T. indica encuentra las condiciones para reproducirse; por lo que el nivel de expresión de las cistatinas puede verse afectado, tanto por la etapa fenológica como por la presencia del patógeno. Como se observa en la Figura 2, la expresión normalizada de cistatinas fue comparativamente menor a la presentada en tejido foliar (Figura 1) para WC1 y WC3, mientras WC5 fue mayor.
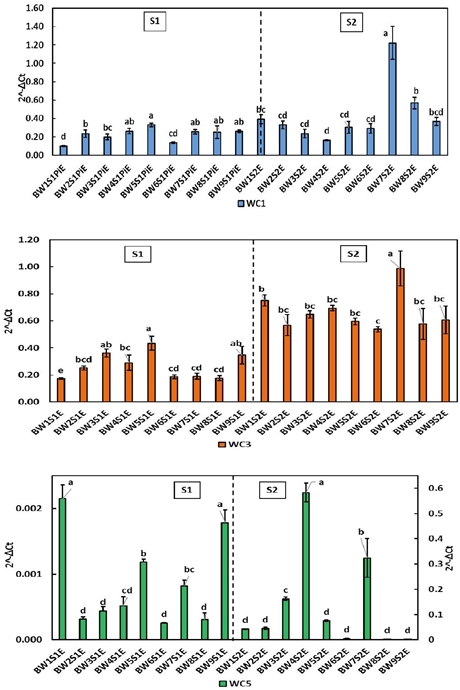
Figura 2 Expresión relativa de cistatinas WC1, WC3 y WC5 en hojas de trigo harinero durante las etapas S1 y S2.Los literales indican diferencia significativa (p< 0.05).
El gen WC1, se expresa más en la línea susceptible BW5 con 0.33 durante S1, a su vez durante S2 los mayores valores fueron en las susceptibles BW7 (1.222) y BW8 (0.568). En la expresión de WC3 se observa que durante S1 la línea susceptible BW5 seguida de las resistentes BW3 y BW9 fueron los valores más altos (0.434, 0.362 y 0.346 respectivamente). El incremento significativo de los valores de expresión normalizada en S2 (etapa de pos antesis) implica una actividad génica inherente al desarrollo de la planta en todas las variedades evaluadas. Sin embargo, dado que los valores de expresión normalizada de WC3 son mayores que los observados de WC1 y WC5 podría sugerir que la presencia del patógeno está afectando la expresión de WC3, probablemente como parte de un sistema defensivo en la planta. Por su parte, la expresión de WC5 disminuye de S1 a S2 en la mayoría de las líneas a excepción de la resistente BW4 (0.583), la susceptible BW7 (0.324) y la resistente BW3 (0.163). Al comparar estos valores con los testigos, se observó que en los testigos la expresión normalizada de WC5 es mayor, por lo que los niveles de WC5 disminuyen en presencia del patógeno.
En trigo cristalino (Figura 3), las líneas resistentes DW2, DW4, DW6 y DW9 presentan los niveles de expresión significativamente mayores en SV y S1 para WC1, WC3 y WC5. Durante la etapa S2 disminuyeron los niveles de expresión de WC1 y WC3 (incluyendo los controles) por lo que en trigo cristalino los niveles de WC1 y WC3 parecen verse más afectados por el desarrollo fenológico que por la interacción con el hongo. Los patrones de expresión de WC5 variaron poco de S1 a S2; se destacan las líneas resistentes DW4 y DW6 en S1, así como DW8 y DW5 en S2. Lo anterior, podría indicar una transcripción de fondo de WC5 inferior o similar a la de los genes endógenos.
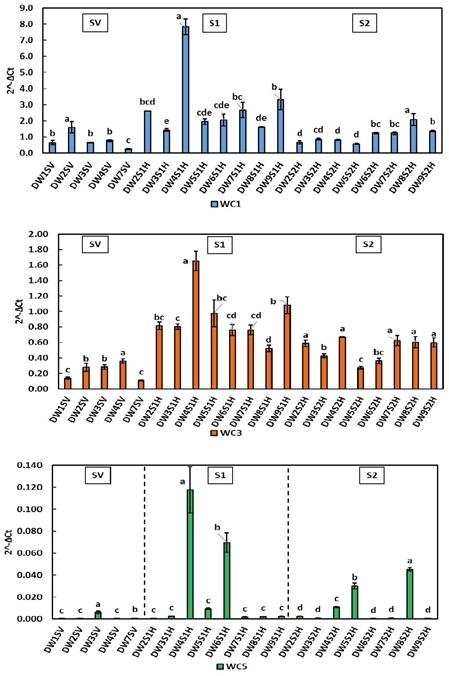
Figura 3 Expresión relativa de cistatinas WC1, WC3 y WC5 en hojas de trigo cristalino durante las etapas SV, S1 y S2. Los literales indican diferencia significativa (p< 0.05).
Los patrones de expresión de cistatinas en espigas de trigo cristalino (Figura 4) difieren marcadamente de la presentada en tejido foliar; WC1 como WC3 alcanzaron niveles significativamente inferiores. La expresión de WC5 en espigas superó los niveles alcanzados en tejido foliar durante S2, este comportamiento también se observó en los trigos harineros. Las líneas DW5 y DW9 sobresalieron en las dos etapas de crecimiento en los tres genes. Estos últimos son resistentes (2.45% y 1.24%).
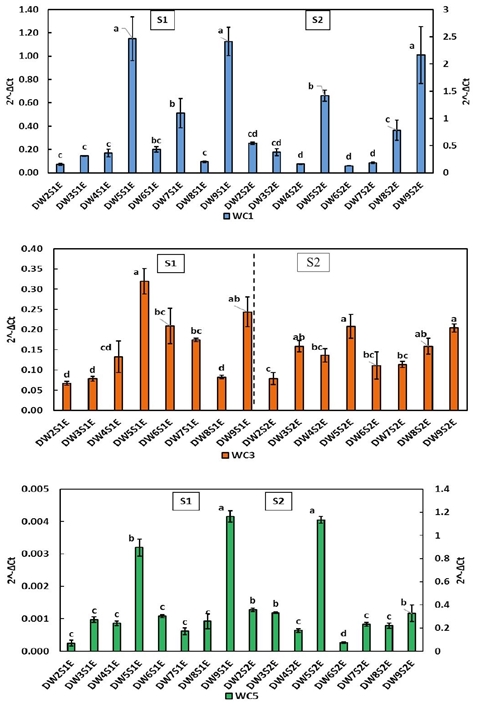
Figura 4 Expresión relativa de cistatinas WC1, WC3 y WC5 en espigas de trigo cristalino durante las etapas S1 y S2.Los literales indican diferencia significativa (p< 0.05).
Tanto en trigo harinero como en cristalino fue notable la intensa reacción producida durante S2, ésta concuerda con numerosas investigaciones que han reportado la ocurrencia de picos de expresión de cistatinas durante la etapa posterior a la fecundación; además esta expresión es significativamente más fuerte en los genotipos resistentes que en los susceptibles (Gupta et al., 2010, Purwar, et al., 2010). Estos resultados indican que la mayor expresión de WC1, WC3 (en espigas) y WC5 (en hojas) podría estar relacionada con la resistencia debido a su incremento en S2, la etapa de mayor vulnerabilidad a la infección de T. indica, ya que se forma el grano donde el patógeno colonizará.
Análisis de correlación
La etapa de embuche post inoculación (S1) se consideró punto focal de actividad génica de cistatinas; este comportamiento se vio correlacionado con el nivel de resistencia al carbón parcial en espigas de trigo harinero con el gen WC3. Esta correlación sigue el modelo lineal con un coeficiente de -0.709, un coeficiente de determinación de 50.30% y una ecuación de la recta WC3= 0.357966 - 0.0056264*(%) infección a 95% de significancia. Lo anterior permite atribuir 50.30% de la variación del porcentaje de infección a la expresión génica; es decir, el aumento de la expresión relativa de WC3 provoca un decremento del porcentaje de infección.
En la etapa post antesis, el comportamiento de la expresión relativa de WC5 en hojas de trigo harinero presentó correlación significativa (p< 0.05) con el porcentaje de infección, esta se ajustó al modelo lineal con una ecuación de la recta de la siguiente forma: (%) infección = 35.9286 - 4937.86*WC5. El coeficiente de correlación indica que existe una relación moderadamente fuerte en sentido inverso (-0.789) y un coeficiente de determinación considerable (62.34%).
Estos resultados evidencian una considerable relación entre la expresión de cistatinas y el atributo de resistencia a carbón parcial; además, sugiere cierta sinergia entre WC1, WC3 y WC5 al regular la actividad de las cisteín proteasas durante la maduración de la semilla (Purwar et al., 2012), cuando las proteínas deben ser acumuladas para el almacenamiento en respuesta a la infección de T. indica.
Conclusión
Los genes de cistatinas se expresan de forma diferencial en función de la etapa fenológica y el tejido, alcanzando una intensidad sostenida en el posterior a la fecundación. La presencia de T. indica induce una respuesta en la expresión de cistatinas a partir de las 12 h posteriores a la inoculación (S1), lo que sugiere que las cistatinas pueden formar parte del mecanismo de defensa de la planta.
Las cistatinas pueden ser buenas candidatas para considerarse como marcadores del mecanismo de defensa de las plantas, no solo a T. indica, sino a otros patógenos e incluso áfidos. Por lo tanto, es factible que los patrones de expresión de las cistatinas diluciden el mecanismo de resistencia al carbón parcial y una herramienta eficiente para el mejoramiento genético de trigo. No obstante, es necesario determinar cuáles cistatinas actúan solo sobre los patógenos y cuáles tienen actividad endógena, esto con el propósito de no erosionar la maquinaria genética inherente de la planta.











 texto en
texto en