Introducción
En México, el maíz (Zea mays L.) es el principal cultivo por la superficie que ocupa, ya que es sembrado en más de ocho millones de hectáreas, lo que representa 39% de la superficie agrícola del país (González-Estrada et al., 2008). El 72.1% de las unidades productoras de maíz en México son de 0-5 ha, conformadas por productores pequeños que operan con muy poca mecanización (SAGARPA, 2010).
Para producir maíz, las comunidades rurales emplean sistemas de manejo agrícola que son resultado de sus conocimientos y sus medios para la apropiación de recursos naturales (Toledo, 2010). Por ejemplo, en Napízaro, perteneciente al municipio de Erongarícuaro, Michoacán, dos de los sistemas de manejo agrícola que los productores utilizan son el monocultivo (MC) y la milpa o policultivo (PC), compuesta de maíz, frijol (Phaseolus vulgaris L.) y calabaza (Cucurbita maxima L.) (Del Val et al., 2013). El sistema de MC se caracteriza por la aplicación de fertilizantes e insecticidas sintéticos y la minimización de la diversidad de especies vegetales (Nicholls y Altieri, 2006). Esto trae como consecuencia la simplificación del sistema y la disminución de la diversidad de organismos benéficos (Andow, 1991).
Se ha documentado que dadas las características mencionadas, en el MC se favorece la proliferación de herbívoros (Nicholls, 2008) que aumentan su densidad hasta causar daños económicos en los cultivos, por lo que se les considera una plaga. Dicha proliferación es mayor a medida que se incrementa la superficie cultivada con MC (Brechelt, 2004; Altieri y Nicholls, 2005). En contraste, existen estudios que muestran cómo las especies plaga, particularmente los insectos, tienen menor impacto en la producción agrícola cuando se emplean sistemas de PC en comparación con los de MC (Altieri y Nicholls, 2013). Las principales razones de esta diferencia son la heterogeneidad del hábitat, que repercute en una menor colonización de herbívoros; una menor tasa de reproducción a consecuencia de sustancias químicas producidas por las diferentes plantas que conforman el sistema; camuflaje; inhibición de alimentación por parte de plantas no-hospederas y por una mayor diversidad de especies que actúan como enemigos naturales de los herbívoros (Andow, 1991).
No obstante esto no siempre se cumple. Altieri (1992) consideró que el efecto resultante de las estrategias de manejo agrícola depende en gran medida de la biología de la especie plaga, de la abundancia de sus enemigos naturales, de la duración del cultivo en el agroecosistema y de la vegetación alrededor del cultivo. Los hongos entomopatógenos (HEP) son enemigos naturales de la mayoría de insectos considerados plagas de importancia económica (Dent, 1999; Ames, 2004). Son escasos los estudios que han evaluado la distribución de insectos plaga y de sus HEP asociados en los cultivos. Es imprescindible el estudio de los componentes que involucran los tres niveles tróficos (planta, herbívoro y HEP), ya que estos componentes tienen implicaciones para el diseño de estrategias de manejo integrado de plagas (Altieri, 1995). Además los HEP se pueden utilizar como agentes de control biológico como parte del manejo integrado de plagas.
Los representantes de la superfamilia Acridoidea MacLeay (Orthoptera), conocidos como saltamontes o chapulines, son un grupo entre los insectos que afectan a los cultivos de México, debido que más de 12 especies presentan brotes poblacionales ocasionales, que provocan daños severos (Kevan, 1977; Barrientos-Lozano, 2001). Los HEP, como Beauveria bassiana. (Balsamo), Metarhizium anisopliae (Metchnikoff) Sorokin y Entomophaga grylli Fresen, son enemigos naturales de los saltamontes y en algunos casos pueden regular sus poblaciones (Uribe-González y Santiago-Basilio, 2012) cuando se usan como agentes de control biológico en agroecosistemas (Díaz et al., 2006).
El Estado de Michoacán se considera uno de los más afectados por plagas de saltamontes en México (Fontana et al., 2008). Sus brotes se presentan de forma cíclica en la temporada de lluvias, causando daños importantes en los cultivos, lo que demanda la implementación de campañas fitosanitarias, en las que la principal estrategia de control es la aplicación masiva de insecticidas sintéticos (Bahena-Juárez y Velázquez-García, 2012), a pesar de las consecuencias negativas que esto conlleva para la sustentabilidad de los agroecosistemas y el riesgo para la salud de los productores (Barrientos-Lozano y Almaguer-Sierra, 2009). A fin de desarrollar estrategias de manejo integrado para el control de estos insectos, es necesario conocer la respuesta de la plaga a la variación en las prácticas de cultivo de la región, por lo que este trabajo tuvo como objetivos evaluar el efecto del sistema de manejo agrícola (MC o PC) y la vegetación de los márgenes de los cultivos (VMM y VMP) sobre la riqueza y abundancia de saltamontes (CS) y sus HEP asociados en el municipio de Erongarícuaro, Michoacán.
Materiales y métodos
Zona de estudio y diseño de muestreo
El estudio se llevó a cabo en el municipio de Erongarícuaro, el cual forma parte de la Cuenca del Lago de Pátzcuaro en el estado de Michoacán. La región tiene un clima templado subhúmedo con lluvias en verano (Cw). El rango de temperaturas oscila entre 5 y 26 ºC con una precipitación pluvial promedio anual de 1 040.8 mm (INEGI, 2009). Cuenta con un tipo de vegetación de bosque de pino y encino (Díaz-Barriga et al., 1988).
Se seleccionaron tres sitios con parcelas para producción de maíz. El primer sitio se encuentra en la localidad de la Ex Hacienda Charahuén (19° 31’ 23”-19° 31’ 13” latitud norte y 101° 42’ 32”-101° 42’ 19” longitud oeste), y los dos restantes están en la localidad de Napízaro (19° 35’ 94”-19° 35’ 54” N y 101°41’ 85”-101° 41’ 51” longitud oeste y 19° 36’ 10”-19° 36’ 00” latitud norte y 101° 41’ 93”-101° 41’ 56” longitud oeste). En los tres sitios se verificó la presencia de saltamontes en el periodo de barbecho (mayo del 2015), cuando la mayoría de sus especies están en fase de huevo. Las observaciones se confirmaron mediante entrevistas con los productores.
En cada sitio se seleccionaron arbitrariamente dos parcelas con una superficie de 9×200 m, una con el manejo agrícola de MC de maíz y su vegetación al margen del monocultivo(VMM) y otra de PC compuesto de maíz, frijol, calabaza y su vegetación al margen del policultivo (VMP). Se realizaron tres réplicas de cada tipo de manejo agrícola, con su respetiva vegetación al margen, dando un total de seis parcelas, a ninguna se les aplicó insecticida.
En cada parcela se realizaron colectas de saltamontes una vez por mes durante el cultivo (julio a diciembre de 2015). Estas se realizaron en transectos cubriendo longitudinalmente la parcela, una para el interior del MC (MC-I), otro para el PC (PC-I) y otra para la vegetación marginal de cada una (VMM y VMP). Se realizaron la tercera semana de cada mes, con una red de golpeo de 33 cm de diámetro, entre las 10:00 y 13:00 h, mediante 200 golpes de red por transecto hasta una altura de 1.5 m. Los saltamontes se introdujeron vivos en recipientes de plástico de un litro y se trasladaron al laboratorio. Un ejemplar de cada morfoespecie fue fijado en alcohol a 70% e identificado a nivel de especie tomando como base criterios de Mariño et al. (2011). Algunos se identificaron hasta nivel de subfamilia, debido a la ausencia de especímenes machos en fase adulta. Las determinaciones fueron corroboradas por la Colección Nacional de Insectos del Instituto de Biología de la UNAM.
Aislamiento e identificación de HEP
Los saltamontes colectados en campo fueron confinados en recipientes de un litro a una densidad de diez ejemplares por recipiente a temperatura ambiente. Se les alimentó con hojuelas de avena comercial y lechuga desinfectada mediante inmersión en una solución de hipoclorito de sodio al 5% durante 20 min y posteriormente enjuagada con agua destilada. Este procedimiento se realizó durante un máximo de dos semanas. Los individuos muertos fueron colocados en cámaras húmedas individuales, consistentes en un recipiente de plástico de 3.5×4.5 cm con tapa y un papel filtro en el fondo, humedecido cada 2 d con 100 µL de agua destilada durante 10 d, con el fin de inducir la esporulación de HEP.
El aislamiento de HEP se realizó en una campana de flujo laminar y consistió en el raspado de conidias presentes sobre el cadáver y su siembra en medio de cultivo papa dextrosa agar (PDA) en cajas Petri, las cuales fueron incubadas a 27 °C durante cuatro a seis días. En este periodo se observó el crecimiento del micelio cada 48 h. Los cultivos puros se obtuvieron realizando reaislamientos del hongo a partir del cultivo original (Monzón, 2001). Los aislados obtenidos serán integrados a la colección de HEP del Centro Nacional de Referencia de Control Biológico (CNRCB).
La identificación de HEP de saltamontes se realizó mediante la observación macro y microscópica de la morfología del crecimiento y estructuras del hongo (micelio, conidios y conidióforos). Se utilizaron claves dicotómicas (Samson et al., 1988) para identificar los géneros de HEP. Se registró la riqueza de HEP y el número de saltamontes infectados.
Se realizó una matriz de Bray-Curtis con medidas de similitud de datos de la abundancia acumulada de seis muestreos de cada especie utilizando el paquete Biodiversity Pro versión 2 (McAleece, 1997), con el fin de obtener las distancias ecológicas que expresan diferencias en la estructura y composición de los saltamontes entre parcelas (Bray y Curtis, 1957), así como una matriz de distancias geográficas entre las parcelas transformadas con log+1 para homogeneizar las distancias extremas (Su et al., 2004; Manly, 2006). Con estas matrices se aplicó la prueba de Mantel (1967) con 10 000 permutaciones, mediante el software XLSTAT (Addinsoft, 2009) para Excel, para explorar la independencia espacial de las muestras y usarlas como réplicas en análisis estadísticos.
Para probar el efecto de los tratamientos sobre la riqueza de especies de saltamontes y sobre la abundancia de la especie dominante, se empleó un modelo lineal mixto usando el software estadístico R versión 3.2.3. (Pinheiro y Bates, 2000). El modelo se ajustó empleando la función “lme” de la biblioteca “nlme” para R (Pinheiro et al., 2007). Como predictores se incluyeron el tipo de manejo agrícola, el tiempo, tanto en término lineal (T) como cuadrático (T2) y su interacción. La riqueza observada de especies y la abundancia de la especie dominante en la vegetación marginal fueron incluidas como covariables (S) en los modelos de riqueza y abundancia, respectivamente. El sitio y la parcela fueron incluidos como factores aleatorios, con el fin de modelar la asociación espacial de los tratamientos y de las diferentes colectas en el tiempo, respectivamente. Las ecuaciones del modelo para riqueza y abundancia fueron:
Donde: S= covariables: riqueza de especies de saltamontes y abundancia de la especie dominante en la vegetación marginal del monocultivo y policultivo; T= tiempo.
En ambos casos la variable de respuesta se transformó con log (respuesta+1) con el fin de cumplir los supuestos de homogeneidad de varianza y de normalidad de los residuos. Finalmente, se exploró la asociación de la frecuencia de infección por HEP aislados en saltamontes con los tratamientos en los que fueron colectados, empleando una prueba de Chi cuadrada.
Resultados y discusión
Composición de la CS
Se colectaron 2 920 saltamontes pertenecientes a dos familias, cuatro subfamilias, diez géneros y 17 especies. El 97.8% del total de individuos recolectados pertenecieron a una sola especie, Sphenarium purpurascens purpurascens Charpentier (Cuadro 1).

Tratamientos: MC-I= interior del monocultivo, PC-I= interior del policultivo. Covariables: VMM= vegetación marginal del monocultivo y VMP= vegetación marginal del policultivo. Datos acumulados de muestreos con redes de golpeo realizados entre julio y diciembre de 2015.
Cuadro 1 Especies de saltamontes y su abundancia en dos tipos de manejo agrícola y la vegetación de los márgenes de las parcelas en Erongarícuaro, Michoacán.
La evidente dominancia de S. p. purpurascens en los sitios de estudio implica que ésta es la especie económicamente más importante para los productores de maíz en la región. La prueba de Mantel mostró que la estructura y composición de la CS en las parcelas no se correlacionaron con las distancias geográficas entre ellas (R= -0.178, p= 0.348) por lo que se consideraron muestras independientes para el análisis comparativo (Cuadro 2).
Evaluación del sistema de manejo sobre la riqueza de especies de saltamontes
La riqueza de las especies cambió estadísticamente significativa en el T, siendo el término cuadrático el que mejor describió dicho cambio (p< 0.05). El tipo de manejo agrícola no tuvo un efecto significativo sobre la riqueza de las especies (p> 0.05), ni modificó la tendencia temporal de la riqueza (p> 0.05). La riqueza de las especies en la vegetación marginal tampoco explicó la riqueza de especies en las parcelas (p> 0.05, Cuadro 3). La variación explicada por los efectos fijos del modelo fue del 29%. Los efectos aleatorios (sitio/parcela) no tuvieron una capacidad explicativa adicional.

Modelo lineal mixto tratamientos: MC-I= interior del monocultivo; PC-I= interior del policultivo. S: covariables T= tiempo; T2= tiempo cuadrático; gl= grados de libertad; F= de distribución F de Fisher. *= p< 0.05; **= p< 0.01.
Cuadro 3 Riqueza de saltamontes en dos tipos de manejo agrícola y la vegetación de los márgenes de las parcelas en Erongarícuaro, Michoacán.
Abundancia de S. p. purpurascens
La abundancia de S. p. purpurascens cambió significativamente en el T. El termino cuadrático fue el que mejor describió este cambio (p< 0.05). El tipo de manejo agrícola no tuvo un efecto significativo sobre la abundancia de S. p. purpurascens, no modificó la tendencia temporal de la abundancia (p> 0.05, Cuadro 4). La abundancia de esta especie en la VMM y VMP en los sitios determinó la abundancia en el MC-I y del PC-I (p< 0.05, Figura 1 y Cuadro 4). La variación explicada por los efectos fijos del modelo fue de 57%. Los efectos aleatorios no tuvieron una capacidad explicativa adicional.
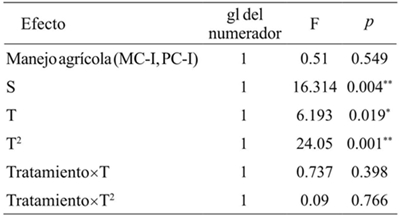
Tratamiento: MC-I0= interior del monocultivo; PC-I= interior del policultivo S= covariables (vegetación marginal del monocultivo y vegetación marginal del policultivo). T= tiempo; T2= tiempo cuadrático. gl= grados de libertad; F=distribución de Fisher; *= p< 0.05; **= p< 0.01.
Cuadro 4 Comparación de la abundancia de Sphenarium pupurascens purpurascens en dos tipos de manejo agrícola y la vegetación de los márgenes de las parcelas de Erongarícuaro, Michoacán.

Figura 1 Abundancia promedio mensual de S. p. purpurascens en dos tipos de manejo agrícola y la vegetación de los márgenes de las parcelas de Erongarícuaro,Michoacán, 2015. N= 72. Tratamientos: MCI=interior del monocultivo; PC-I= interior del policultivo. Covariables: VMM= vegetación marginal del monocultivo; VMP= vegetación marginal del policultivo.
El PC-I no dificultó el ataque de S. p. purpurascens, por lo que no se registraron bajas. De hecho en septiembre se registró mayor abundancia en este manejo agrícola que en el MC-I. Este insecto es considerado polífago (Cano-Santana y Oyama, 1994; Tamayo-Mejía, 2009), y de acuerdo con los resultados de este estudio la diversidad vegetal incrementó su abundancia, ya que VMM y la VMP presentaron mayores valores que los registrados en MC-I y PC-I. La abundancia de S. p. purpuascens en la vegetación de los márgenes influyó sobre la abundancia encontrada en el MC-I y PC-I (Cuadro 4).
Cerritos y Cano-Santana (2008) registraron que la densidad de huevos de S. purpurascens fue 14.9 veces mayor en los bordes de las parcelas de alfalfa que dentro de las parcelas. Esto contrasta con lo que plantea Andow (1991) acerca de que una determinada plaga encontrará menos posibles hospederos en un hábitat más diverso y, por tanto los insectos plaga son menos dañinos en los policultivos en comparación a los monocultivos. Sin embargo, insectos con un amplio espectro de hospederos usualmente no reducen su población por la diversidad en los cultivos (Andow, 1991). Por lo tanto, se deben utilizar otras estrategias para su control.
La abundancia máxima de S. p. purpurascens del PC-1 la VMM y la VMP se presentó en agosto, con excepción del MC-I que aumento en septiembre y posteriormente disminuyó. Cano-Santana (1994) reportó que las densidades máximas de S. purpurascens se presentaron a principios de julio en sitios abruptos y planos de la Reserva del Pedregal de San Ángel en la Ciudad de México en 1990 y 1991. En 1991 se observó que después de alcanzar la densidad máxima, la población descendió drásticamente en los meses posteriores.
La alta humedad combinada con temperaturas bajas pudo haber causado una alta mortalidad de los primeros estadios ninfales de S. purpurascens. Tamayo-Mejía (2009) reportó que los estadios ninfa 1 y ninfa 2 de saltamontes de Melanoplus differentialis (Thomas) y S. purpurascens presentaron una mortalidad en campo de 50%, causada por factores bióticos y abióticos. En base a los resultados de este estudio y de los citados anteriormente se infiere que la dinámica de poblaciones de S. p. purpurascens es afectada por las condiciones ambientales y de la vegetación herbácea de los sitios de estudio (Cano-Santana, 1994; Cerritos y Cano-Santana, 2008; Tamayo-Mejía, 2009).
Es necesario el estudio puntual de la interacción entre S. p. purpurascens y las arvenses que se encuentran en los márgenes de las parcelas, ya que puede ser útil para la manipulación de la composición de especies de arvenses en los bordes de los cultivos para que funcionen como vegetación trampa. Es importante realizar evaluaciones de plantas que han demostrado propiedades repelentes y manipular su presencia dentro de los cultivos, con el fin de alejar a S. p. purpurascens del cultivo principal. Entre las especies que se pueden evaluar se encuentran la higuerilla (Ricinus comunis L.) el ajo (Allium sativum L.) y el cempasúchil (Tagetes erecta L.) (Grainge y Ahmed, 1988; Rodríguez y Nieto, 1997; Vidal et al., 2008). Lo anterior permitiría tener áreas que concentren mayor diversidad de plantas con un propósito específico dentro del agroecosistema, con el fin de minimizar el daño que el saltamontes ocasiona al cultivo principal.
En el presente estudio la abundancia de S. p. purpurascens en la VMM y la VMP determinó la abundancia de esta especie en el interior de las parcelas independientemente del tipo de manejo agrícola utilizado (MC-I o PC-I). Además del manejo integrado de plagas, existe otra alternativa para regular las poblaciones de S. purpurascens, que consiste en su recolección para aprovecharlo como recurso alimenticio. En la actualidad este insecto se vende en mercados del Estado de México y de Valles Centrales de Oaxaca, donde forma parte de la gastronomía regional (Marcos et al., 2015).
Cerritos y Cano-Santana, (2008) compararon el impacto de la aplicación del insecticida malatión con la captura de S. purpurascens para el consumo humano sobre la densidad de ootecas m-2 en el interior del cultivo de alfalfa y de sus bordes en dos años. La densidad de ootecas fue menor en parcelas donde se aplicó malatión con respecto a las de control mecánico mediante recolección. Sin embargo, la densidad de ootecas del control mecánico fue menor en contraste con el control. La densidad de huevos en los bordes de las parcelas fue 14.9 veces mayor que los encontrados en el interior de las parcelas. Las áreas de ovoposición de las hembras de S. p. purpurascens se encontraron con mayor frecuencia en bordes de las parcelas, ya que en estas áreas el suelo es menos compacto (Cerritos y Cano-Santana, 2008). El método de control mecánico es una alternativa viable para regular las poblaciones de S. p. purpurascens, además de que es un producto rentable para las regiones antes mencionadas (Cerritos y Cano-Santana, 2008).
HEP aislados en S. p. purpurascens
De 2 920 individuos colectados, se encontraron 12 ejemplares de S. p. purpurascens infectados por algún HEP, lo que corresponde al 0.41% del total (Cuadro 5). Todos los HEP fueron aislados de individuos adultos, excepto dos ninfas en el sitio de la VMM infectadas con Metarhizium sp. Sorokin. El 75% del total de saltamontes infectados tuvieron Metarhizium sp. y 25% restante se encontraron infectados por Beauveria sp. (Balsamo) Vuillemin. El 16.7% de los saltamontes infectados por HEP fueron colectados en el MC-I, 41.7% en el PC-I, 16.6% en la VMM y finalmente 25% en la VMP. De manera general, el hongo con mayor frecuencia de infección en los saltamontes de la región fue Metarhizium sp., encontrándose una asociación entre la proporción de saltamontes infectados con este HEP en el PC-I, respecto a los que se encontraron infectados en la VMP (x 2 = 3.84, p= 0.04). Para el caso de los demás sitios no se encontró asociación significativa (p> 0.05) (Cuadro 5).
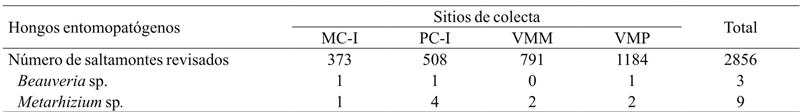
MC-I= interior del monocultivo; PC-I= interior del policultivo; VMM= vegetación de los márgenes del monocultivo; VMP= vegetación de los márgenes del policultivo.
Cuadro 5 Sphenarium purpurascens purpurascens infectados con hongos entomopatógenos en agroecosistemas de maíz de la región de la Cuenca del Lago de Pátzcuaro.
Los HEP que se encontraron infectando a S. p. purpurascens, tuvieron mínima presencia en los agroecosistemas de maíz. Es conocido que Metarhizium y Beauveria presentan niveles bajos de infección natural en las CS en comparación a E. grylli, la cual es una especie que se esperaba encontrar en este estudio, ya que se ha documentado infectando distintas poblaciones de saltamontes tanto en México como en otros países del continente americano (Sánchez et al., 2011; Uribe-González y Santiago-Basilio, 2012). No obstante, en este trabajo se presentó una asociación entre Metarhizium sp. y el PC-I, comparado con la VMP, por lo que la infección de Metarhizium parece verse favorecida por la diversidad vegetal, ya que en estos sistemas, el microclima cambia incrementándose principalmente la humedad relativa, favoreciendo la presencia de HEP (Van Huis, 1997).
Conclusiones
Se encontraron 17 especies, de las cuales la más abundante fue S. p. purpurascens. La abundancia de esta especie en la vegetación de los márgenes de los cultivos influyó sobre la abundancia del interior de los cultivos. La frecuencia de infección por HEP fue baja. Metarhizium sp. tuvo una mayor frecuencia de infección en el PC-I en comparación de la VMP. De los aislamientos de HEP tres correspondieron a Beauveria sp. y nueve a Metarhizium sp.
Los resultados del presente estudio muestran un efecto positivo de la diversidad vegetal sobre la comunidad de saltamontes y en particular sobre S. p. purpurascens, una especie económicamente importante por el daño que ocasiona al maíz en la región. Estos hallazgos muestran la necesidad de profundizar en la manipulación experimental de la composición de plantas dentro de estos agroecosistemas para minimizar el daño de este saltamonte, potenciar la presencia y acción de enemigos naturales tales como los HEP. De esta forma mejorar la sustentabilidad de estos sistemas de producción a través del manejo agroecológico de los recursos.











 texto en
texto en 



