Introducción
México tiene una gran diversidad en especies animales y vegetales, cuidar y preservar tal diversidad es muy importante. Al respecto, México alberga una notable riqueza de orquídeas, la cual ha sido registrada en 1 260 especies y 170 géneros (Soto y Salazar, 2004; Hágsater et al., 2005). De éstas: 181 se incluyen en alguna categoría de riesgo en la norma oficial vigente NOM-059-ECOL-2001 (Diario Oficial de la Federación, 2002), 72 son endémicas, 58 están en la categoría de amenazadas, 107 requieren protección especial, 15 están en peligro de extinción y una especie ya está extinta en la naturaleza (Laelia gouldiana Rchb. F.) (Diario Oficial de la Federación, 2002).
Laelia anceps Lindl. y Epidendrum sp. son dos especies de orquídeas que debido a sus flores llamativas han sido sometidas a una alta presión de colecta. Esta presión, aunada a la destrucción de su hábitat, ha provocado la disminución acelerada de sus poblaciones (Halbinger y Soto, 1997; Romero-Tirado et al., 2007).
Con respecto a su reproducción, la germinación en las orquídeas representa una de las mayores limitantes para su supervivencia, ya que el endospermo está reducido en algunas especies, mientras que en otras se encuentra ausente, por lo que para asegurar su germinación es necesario que las semillas se asocien con hongos micorrízicos que les provean de nutrimentos (Téllez, 2011).
El cultivo in vitro es una técnica que facilita la germinación y propagación de prácticamente cualquier orquídea, ya que se lleva a cabo en condiciones de asepsia, en presencia de una fuente de nutrimentos y condiciones físicas controladas, lo que potencializa su capacidad de reproducción y crecimiento (Zettler et al., 2001; Salazar et al., 2013). No obstante, el costo de los materiales utilizados en la elaboración de los medios de cultivo es alto, especialmente del agente gelificante (agar o phytagel) que puede representar hasta 70% del costo de las plantas. Además, el agar puede reducir la concentración de oxígeno e inhabilitar la difusión de nutrimentos del medio (Fujiwara et al., 1993; Ichimura y Oda, 1998).
Por otro lado, para algunas especies (Laelia halbigeriana Salazar & Soto Arenas, Agave cocui Trelease) se ha documentado que la concentración completa de las sales medio de Murashige y Skoog (1962) que comúnmente se utiliza en el cultivo de tejidos, sobrepasa los requerimientos nutrimentales de los tejidos (Raya-Montaño et al., 2011; González et al., 2012). Asimismo, el lento crecimiento de la mayoría de las orquídeas, contribuye al incremento en los costos de producción, al tener que mantener las plantas in vitro por más tiempo hasta que alcancen el tamaño que permita transferirlas al invernadero.
La reducción de los costos de producción podría lograrse con el uso de sustratos hidropónicos (perlita, vermiculita, fibra de coco), ya que pueden ser una alternativa para sustituir los agentes gelificantes caros. Al respecto, se tiene evidencia que el utilizar sustratos durante la fase in vitro ha permitido el crecimiento de especies como Limonium latifolium Lindl., Ipomoea batatas L., y Myrtus communis L. (Afreen-Zobayed et al., 1999; Afreen-Zobayed et al., 2000; Lucchesini et al., 2006; Xiao y Kozai, 2006).
De la misma manera, incluir fitorreguladores como el ácido giberélico en el medio de cultivo ha tenido un efecto positivo en el alargamiento del vástago y el número de hojas formadas en Cattleya loddigesii Lindl., Manihot esculenta Crantz, Cynodon dactylon Pers. y Cuscuta chinensis Lam. (Maheshwari et al., 1980; Bhagwat et al., 1996; Li y Qu, 2002; Ávila y Salgado-Garciglia, 2006; Rodrigues et al., 2009).
Dada la importancia de cuidar y preservar la diversidad de las orquídeas mexicanas y de proponer alternativas para reducir los costos de producción de su propagación in vitro, el objetivo del presente trabajo fue conocer el efecto de la composición del medio de cultivo y el uso de sustratos como sustitutos del agar, en el crecimiento in vitro de Laelia anceps Lindl. y Epidendrum sp. partiendo de la hipótesis de que los medios de cultivo diluidos suplementados con ácido giberélico, y los sustratos permitirán el crecimiento in vitro de ambas especies.
Materiales y métodos
Medios de cultivo
Los medios de cultivo evaluados para el crecimiento de brotes adventicios de Laelia anceps Lindl. y Epidendrum sp. de 1.1 ±0.1 cm, previamente regenerados in vitro, contenían las sales nutritivas del medio Murashige y Skoog (MS) al 50 y 100%, 30 g L-1 de sacarosa, 0 y 1 mg L-1 de ácido giberélico (AG3), agar (7 g L-1) ó 30 ml de las mezclas de sustratos: perlita-tezontle (PT) y fibra de coco-tezontle (FCT) en proporción 3:1 (tamaño de partícula de 0.5 mm). El pH de los medios se ajustó a 5.7-5.8.
Establecimiento de los cultivos
Los brotes adventicios se colocaron en frascos de vidrio de 250 ml que contenían 30 ml de los medios de cultivo descritos anteriormente más los sustratos PT, FCT o agar (Cuadro 1). Previamente, los frascos se esterilizaron en una autoclave durante 15 minutos a 120 oC antes del establecimiento de los brotes (explantes).
MS= Sales de Murashige y Skoog (1962).
Cuadro 1 Tratamientos probados en el cultivo in vitro de Laelia anceps Lindl. y Epidendrum sp.
Los cultivos se incubaron en un cuarto de crecimiento a 26 ±2 oC y un fotoperiodo de 16 h proporcionado por lámparas de luz blanca fría fluorescente (intensidad lumínica 25 µmol m-2 s-1).
Variables evaluadas
Después de 45, 90 y 135 días de iniciado el cultivo se evaluó la longitud del brote (desde el inicio de la raíz hasta la punta de la hoja más larga), el número de hojas y número de raíces; y el peso fresco se evaluó a los 60 días con ayuda de una balanza analítica.
Diseño experimental
El experimento se realizó en el Laboratorio de Biotecnología y Patología de Semillas del Campus Montecillo, Colegio de Postgraduados. Se usó un diseño experimental completamente al azar con tres factores: especie (2), sustratos (3) y medio de cultivo (4) resultando 24 tratamientos. Cada tratamiento tuvo 15 repeticiones y cada repetición consistió de un frasco con cinco brotes adventicios. A los datos de cada variable se les realizó un análisis de varianza (ANOVA) y la comparación de medias mediante la prueba de Tukey (≤ 0.05). Ambos procedimientos se hicieron con el programa estadístico SAS v.9.0 (SAS Institute, 2002).
Resultados and discusión
Efecto de la especie
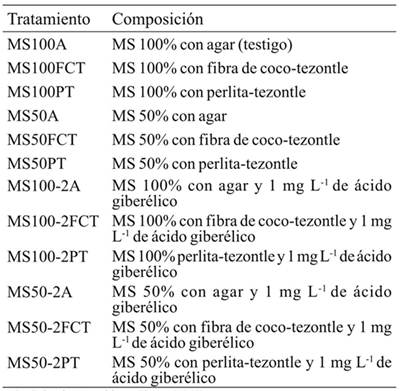
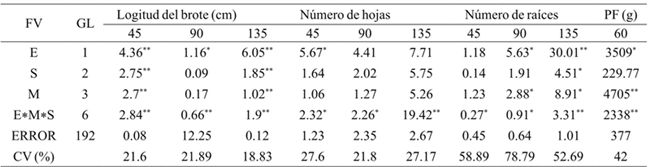
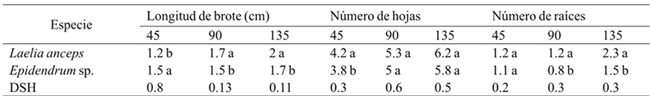
El análisis de los resultados reflejó que la especie tuvo un efecto significativo en la longitud del brote (45, 90 y 135 días), el número de hojas (45 días) y el número de raíces (90 y 135 días) (Cuadro 2). A los 45 días de cultivo, la especie Epidendrum sp., mostró mejor respuesta para longitud del brote; sin embargo, después de este tiempo fue Laelia anceps Lindl. la que presentó los valores más altos (Cuadro 3). El número de hojas de los brotes de Laelia anceps Lindl. después de 45 días fue más alto que en Epidendrum sp. pero a los 90 y 135 días ambas especies se comportaron de manera similar.
**= p≤ 0.01; *= p≤ 0.05; CV= coeficiente del variación; E= especie; M= medio; S= sustrato; PF= peso fresco.
Cuadro 2 Suma de cuadrados del análisis de varianza para el efecto de la especie, los sustratos y medios de cultivo en la longitud del brote, número de hojas, número de raíces y peso fresco de Laelia anceps Lindl. y Epidendrum sp.después de 45, 90 y 135 días de cultivo.
DSH= diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey≤ 0.05).
Cuadro 3 Efecto de la especie sobre longitud de brote, número de hojas y número de raíces a los 45, 90 y 135 días de iniciar el cultivo in vitro.
Por otra parte, para el número de raíces no hubo diferencias estadísticas durante los primeros 45 días entre ambas especies, pero después de este periodo L. anceps Lindl. mostró valores significativamente mayores que Epidenderum (Cuadro 3). En relación con estos resultados, el efecto del genotipo en el crecimiento in vitro también se observó en Cattleya aurantiaca Bateman, Encyclia adenocaula La Llave & Tex., Laelia speciosa Kunth., Epidendrum radicans Pav. Ex Lindl., Euchile citrina La Llave ex Lex., Laelia albida Bateman ex Lindl., Laelia autumnalis (Lex.) Lindl., Oncidium cavendishianum Bateman y Oncidium tigrinum La Llave & Lex. (Ávila y Salgado-Garciglia, 2006). Asimismo, Abdoli y Moieni (2003) encontraron que el genotipo influyó considerablemente en la inducción de la organogénesis en girasol (Helianthus annuus L.).
Efecto de los sustratos
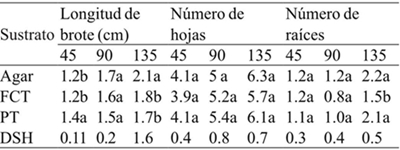
Los sustratos tuvieron efecto significativo en la longitud de brote (45 y 135 días) y número de raíces a los 135 días (Cuadro 2). Después de 45 días de cultivo, la longitud de los brotes fue estadísticamente superior en perlita-tezontle (PT), pero a los 135 días los valores más altos se registraron en los brotes cultivados en agar, en tanto no se encontraron diferencias significativas en los tratamientos con fibra de coco-tezontle (FCT) y PT (Cuadro 4) (Figura 1). Con respecto a número de hojas, no se observaron diferencias significativas entre los brotes crecidos en los distintos sustratos y agar durante los 135 días que los brotes permanecieron in vitro.
FCT= fibra de coco-tezontle; PT= perlita-tezontle; DSH= diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey≤ 0.05).
Cuadro 4 Efecto de los sustratos en la longitud de brote,número de hojas y número de raíces a los 45, 90 y 135 días iniciado el cultivo
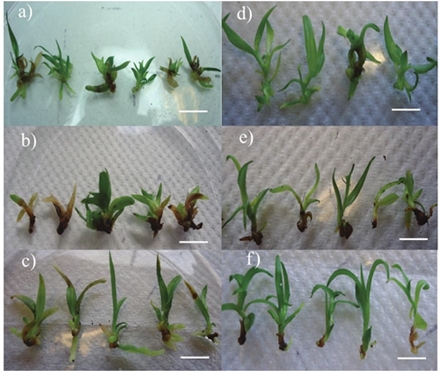
Figura 1 Brotes adventicios de Laelia anceps Lindl. (a, b, c)y Epidendrum sp. (d, e, f) 90 días después de iniciar el cultivo in vitro. Agar (a, d), fibra de coco-tezontle(b, e) y perlita-tezontle (c, f). Barra 1 cm.
Asimismo, se observó que el número de raíces fue estadísticamente similar en agar, FCT y PT a los 45 y 90 días de cultivo; sin embargo, después de 135 días los brotes cultivados en FCT tuvieron un número de raíces significativamente menor que aquellos crecidos en agar o PT (Cuadro 4). Al respecto, Keatmetha y Suksa-Ard (2004) encontraron que el uso de vermiculita y peat most durante el cultivo in vitro de Anthurium andraeanum L. no promovieron mayor número de raíces con respecto al uso de phytagel.
Por su parte, Afreen-Zobayed et al. (2000) usaron diferentes combinaciones de vermiculita y pulpa de papel para sustituir el agar en cultivo in vitro de Ipomoea batatas L. obteniendo los mejores resultados en vermiculita con 30% de pulpa de papel. Asimismo, Labrousse et al. (2012) evaluaron sorbarod (tampón de celulosa), turba y pulpa de papel como soportes alternativos al agar en la micropropagación de Nemesia denticulata (Benth.) Grant ex Fourc., ellos encontraron que los sustratos promovieron el mejor desarrollo de raíces y mayor supervivencia en la aclimatación. Asimismo, Hazarika (2006) indica que las raíces de Brassica oleracea L. desarrolladas en agar tienen baja funcionalidad, lo que limita la supervivencia de las plantas durante el proceso de aclimatación. De la misma manera, Kozai (2010) y Oh et al. (2012) encontraron que los sustratos vermiculita, pulpa de papel y perlita aumentan la conductividad hídrica, lo que favorece la absorción de nutrientes por las plantas.
Efecto de medio de cultivo
Fue posible observar diferencias significativas en la longitud el brote (45 y 135 días), y el número de raíces después de los 90 y 135 de cultivo por efecto del medio (Cuadro 2). A los 45 días de iniciado el cultivo, los brotes crecidos en el medio MS al 50% con AG3 (MS50-2) mostraron la mayor longitud, pero al final de la evaluación este medio y el que contenía las sales MS al 100% sin AG3 no fueron estadísticamente diferentes (Cuadro 5). Al respecto, Coello et al. (2010) encontraron que el ácido giberélico fue el factor que promovió el alargamiento de los brotes de Guarianthe skinneri Bateman. Por otra parte, el número de hojas no fue significativamente diferente entre los distintos tratamientos a lo largo del cultivo. En contraste, Rodrigues et al. (2009) encontró que el uso de AG3 en el crecimiento de Cattleya loddigesii Lindl. promovió un mayor número de hojas. Asimismo, sólo el número de raíces de los brotes crecidos en MS al 100% fue significativamente menor que el de aquellos que permanecieron en el medio MS al 50% y AG3 después de 90 y 135 días de iniciado el cultivo (Cuadro 5).
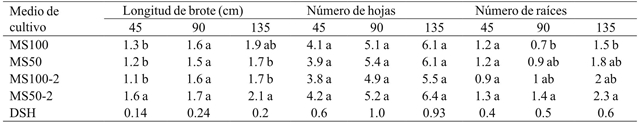
MS= sales de Murashige y Skoog; MS100= MS al 100%; MS50= MS al 50%; MS100-2= MS al 100% con 1 mg L-1 de ácido giberélico; MS50-2= MS al 50% con 1 mg L-1 de ácido giberélico; DSH= diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey ≤ 0.05).
Cuadro 5 Efecto del medio de cultivo en la longitud de brote, número de hojas y número de raíces después de 45, 90 y 135 días de cultivo.
Por su parte, Jara et al. (2007) utilizaron cuatro medios (MS 50%, MS 100%, medio Morel, medio Knudson para la germinación in vitro de Chloraea virescens (Willd.) Lindl., Chloraea lamellata Lindl. y Gavilea araucana Phil., encontrando que el medio MS 50% indujo los mejores resultados en las especies estudiadas. De igual manera, Dalzotto (2013) reportó que la altura de planta, número de raíces y materia seca a los 95 días del cultivo in vitro de Oncidium bifolium (Sims) Dumort. fueron mayores en el medio MS 50%. Los resultados de este trabajo muestran que medios menos concentrados que contenían sales MS al 50% no limitaron el crecimiento de los brotes de Laelia anceps Lindl. y Epidendrum sp. lo que concuerda con lo obtenido por Pervin (1997), quien observó que las orquídeas de los generos Vanda, Dendrobium, Aerides, Acampe y Apathoglottis pueden desarrollarse en medios con pocos nutrientes (peptona, inositol, extracto de plátano o agua de coco).
Por su parte, Flores-Escobar et al. (2008) observaron que los brotes de Oncidium stramineum Lindl. cultivados en medio MS suplementado con extractos orgánicos (agua de coco, peptona, carbón activado, polivinilpirrolidona) alcanzaron una longitud de 2.05 cm de longitud en 90 días, valor muy cercano al obtenido en el medio que contenía 50% de las sales MS y 1 mg L-1 de AG3 (MS50-2), en un intervalo de tiempo similar.
Efecto de los tratamientos
Diferencias significativas se encontraron para la longitud el brote, el número de hojas y el número de raíces a los 45, 90 y 135 días en la interacción de los factores (Cuadro 2). Después de 135 días de cultivo, la longitud de los brotes de L. anceps Lindl. de los tratamientos con sales MS al 50%, AG3 y agar (MS50-2A) y sales MS al 100% con agar (MS100-A) fue estadísticamente mayor que la de los otros tratamientos. No obstante, a los 90 días sólo se apreciaron diferencias estadísticas entre los tratamientos MS50-2A y MS50A (MS 50% sin AG3) y MS100-2PT (MS100%, AG3 y perlita-tezontle) (Cuadro 6).
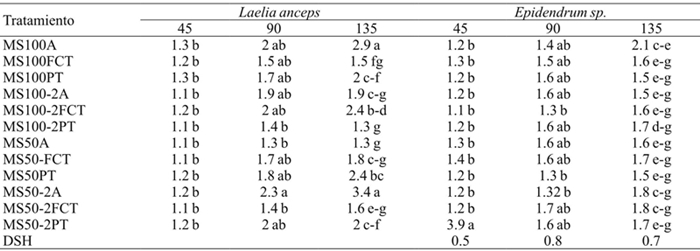
DSH = diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey ≤ 0.05).
Cuadro 6 Efecto de los tratamientos en la longitud del brote de Laelia anceps Lindl. y Epidendrum sp. a 45, 90 y 135 días del cultivo.
Lo anterior indica que los brotes de L. anceps Lindl. pueden crecer bien tanto en agar como en perlita-tezontle o vermiculita-perlita, y sales MS al 50 ó 100% con o sin AG3 durante 90 días, y después de este tiempo el crecimiento es mejor en los medios gelificados con agar, indistintamente de la concentración de sales o AG3. Estos resultados concuerdan con los de Martínez-Hernández et al. (2006) quienes evaluaron la germinación, multiplicación y enraizamiento de Citrus volkameriana Ten & Pasq., Citrumelo swingle (Citrus Paradise Macfad cv. Duncan x Poncirus Trifolia L.) y Citrange en vermiculita, perlita y tezontle, no encontrando diferencias estadísticas significativas entre estos y los tratamientos con agar.
Asimismo, estos autores mencionan que la supervivencia durante la aclimatación fue mayor en las plantas provenientes de sustratos, ya que las de agar sufrían estrés provocado por el rompimiento de raíces, causando su muerte. Afreen-Zobayed et al. (2000) observaron que los tratamientos a base de agar en la micropropagación de Ipomoea batatas L. quedaron por debajo de los tratamientos a base de vermiculita y pulpa de papel.
A diferencia de lo observado en L. anceps Lindl. en Epidendrum sp. no se encontraron diferencias significativas en la longitud de los brotes sometidos a los distintos tratamientos probados a lo largo del periodo de cultivo (Cuadro 6).
Por otro lado, no existieron diferencias significativas para el número de hojas formadas en los brotes de L. anceps Lindl. y los brotes Epidendrum sp. después de los 45 y 90 días, pero a los 135 días sólo Epidendrum sp. del tratamiento MS50A (MS 50%, agar) tuvo un número de hojas estadísticamente diferente, mientras que para L. anceps Lindl. el tratamiento MS50 PT (MS 50% perlita-tezontle) indujo la formación de un mayor número de hojas (Cuadro 7).
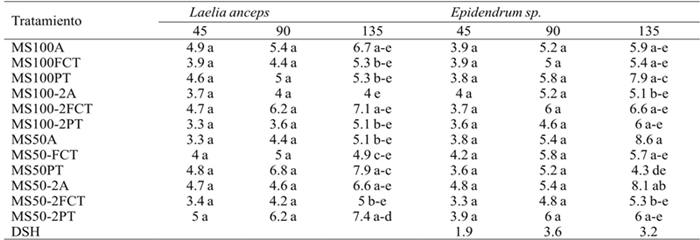
DSH= diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey ≤ 0.05).
Cuadro 7 Efecto de los tratamientos en el número de hojas de Laelia anceps Lindl. y Epidendrum sp. a los 45, 90 y 135 días después del inicio del experimento.
Estos resultados concuerdan con los obtenidos por Martínez-Hernández et al. (2009) investigadores que evaluaron vermiculita como sustituto de agar en Citrus volkameriana Ten & Pasq., Citrumelo swingle (Citrus paradise Macfad cv. Duncan × Poncirus trifolia L.) y C-35 y encontraron en sus valores obtenidos que el número de hojas no presentaron diferencias estadísticas significativas durante las primeras ocho semanas del crecimiento in vitro.
Por otra parte, Xiao y Kozai (2006) probaron un material poroso (Florialite) alternativo al agar en el crecimiento de Limonium latifolium Lindl. y encontraron diferencias estadísticas significativas en el área foliar, peso seco y fresco durante los primeros 25 días de cultivo. Al respecto, los resultados obtenidos en esta investigación indican que cultivar los brotes de L. anceps Lindl. y Epidendrum sp. en medios con el 50% de las sales y las mezclas de perlita-tezontle o perlita-fibra de coco y sin AG3 promueve un número similar de hojas al de aquellos cultivados en las sales MS al 100% y agar.
A los 135 días se observó que sólo los brotes de L. anceps Lindl. que se cultivaron en el tratamiento MS50-A formaron un número de raíces significativamente menor que el de aquellos del tratamiento MS50-FCT (Cuadro 8). Para Epidendrum sp. los tratamientos MS100FCT y MS50-2FCT indujeron un menor número de raíces. En ese mismo intervalo de tiempo, los brotes de Epidendrum sp. cultivados en el tratamiento MS100A-2A sólo mostraron ser significativamente más eficientes para formar raíces que los de los tratamientos MS50-PT, MS50-A, MS100-2PT, MS100-2FCT, MS100-FCT y MS100-A (Cuadro 8).
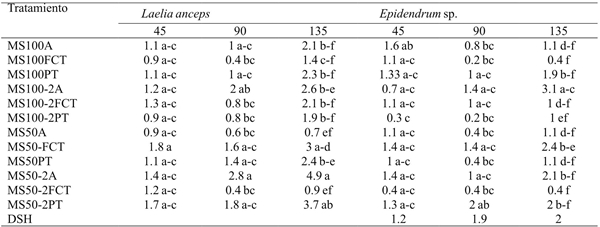
DSH= diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey ≤ 0.05).
Cuadro 8 Efecto de los tratamientos en el número de raíces de Laelia anceps Lindl. y Epidendrum sp. después de 45, 90 y 135 días de cultivo.
Al respecto, Xia y Kozai (2006) encontraron que los brotes de Limonium latifolium Lindl. formaron mayor número de raíces en Florialite, que en agar. Por su parte, Mohan et al. (2004) usaron residuos orgánicos de caña de azúcar como sustituto del agar en el enraizamiento in vitro de manzano (Malus prunifolia Borkh.) y obtuvieron un incremento de 63% en el número de raíces.
Se ha documentado que las raíces formadas en medios con agar suelen ser delgadas y frágiles, mismas que se dañan durante el transplante, lo que ocasiona la pérdida de individuos (Debergh y Maene, 1981; Roberts y Smith 1990).
En el Cuadro 2 se observan diferencias significativas para el peso fresco de los brotes a 60 días de cultivo. Asimismo, sólo se encontraron diferencias significativas entre los brotes de L. anceps Lindl. del testigo (MS100A) y los tratamientos MS100-PT, MS100-2PT, MS100A para la variable peso fresco (Cuadro 9). En tanto que para Epidendrum sp. el peso fresco de los brotes del testigo fue estadísticamente similar al de los tratamientos MS50-FCT, MS50-PT, MS50-2FCT, MS50-2PT. En relación con esto, al estudiar el efecto de la vermiculita como sustituto del agar en Carica papaya L. Kataoka (1994) encontró que el peso fresco de las raíces era mayor en los explantes desarrollados en agar. En el presente estudio el uso de sustratos, medios diluidos y la adición de ácido giberélico (AG3) no tuvieron efectos negativos en el peso fresco de L. anceps Lindl. y Epidendrum sp.
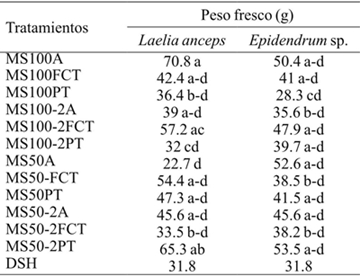
DSH= diferencia significativa honesta. Letras distintas en una columna indican diferencias estadísticas significativas (Tukey ≤ 0.05).
Cuadro 9 Peso freso de los brotes de Laelia anceps Lindl.y Epidendrum sp. después de 60 días de cultivoin vitro.
En el presente trabajo, los mejores tratamientos evaluados podrían formar un protocolo en el que se utilicen medios de cultivo diluidos y sustratos como sustitutos del agar. Este protocolo representa una alternativa para la propagación in vitro de L. anceps Lindl. y Epidendrum sp. eficiente y a un costo menor. Dicha disminución en el costo se atribuye a la reducción en la concentración de las sales nutritivas y AG3, pero sobre todo al uso de sustratos baratos, los cuales a diferencia del agar, sólo contribuyen con 13 a 17% del costo del mismo.
Conclusiones
El uso de medios de cultivo menos concentrados, sin AG3 y sustratos como soporte, permitió el crecimiento de las plantas de L. anceps Lindl. y Epidendrum sp. con la misma o mayor eficiencia que el método de cultivo convencional gelificado con agar. La sustitución del agar por sustratos y el uso de medios de cultivo con sales diluidas sin AG3, no sólo permite el crecimiento in vitro de los brotes de las especies de orquídea en estudio, sino que puede reducir los costos de producción de las plantas propagadas mediante esta técnica.











 texto en
texto en 


