Introducción
En los suelos se encuentran diferentes concentraciones y tipos de sal, derivados de los procesos de intemperismo y depósito por corrientes superficiales hacia las partes bajas, además de actividades antropogénicas en la que destaca el manejo inadecuado del agua de riego (Kovda, 1961; Ayers y Westcot, 1987). Las sales más importantes presentes en el suelo y el agua son las sales del ácido carbónico, del ácido sulfúrico y las del ácido clorhídrico (Kovda et al., 1973), las más comunes en los suelos de las áreas agrícolas son el cloruro de sodio (NaCl), el sulfato de sodio (Na2SO4) y en menor proporción el bicarbonato de sodio (NaHCO3) (Richards, 1990; Reginato et al., 2014).
Las sales NaCl y Na2SO4 por su alta solubilidad permanecen en la solución del suelo en condiciones de humedad residual (Sánchez-Bernal et al., 2012). Respecto al NaHCO3, esta es excesivamente tóxica para los cultivos agrícolas, sin embargo, la mayoría formará precipitados de CaCO3 y CaHCO3 (Sánchez-Bernal et al., 2008; Sánchez-Bernal et al., 2012). Por lo tanto, esta sal afectará más a las variedades de frijol. Por tanto, el NaHCO3 se estudió con especial atención, ya que gran parte de las áreas agrícolas en México se riegan con agua superficial de origen residual. El agua residual es rica en NaHCO3 (Velázquez-Machuca et al., 2002).
México ocupa el quinto lugar en producción de frijol (Phaseolus vulgaris L.) a nivel mundial (Reyes-Rivas et al., 2008). El frijol en México se produce en los ciclos agrícolas primavera-verano y otoño-invierno. El ciclo otoño-invierno se realiza bajo condiciones de humedad residual, condiciones que incrementan la salinidad (Miyamoto y Pingitore, 1992).
El frijol es sensible a las condiciones salinas y el rendimiento disminuye a partir de una conductividad eléctrica de 2 dS m-1 (Subbarao y Johansen, 1994). Mass y Hoffman (1977) demostraron que una conductividad eléctrica de hasta 1 dS m-1 da 100% de rendimiento de grano mientras que a 6.3 dS m-1 disminuye a 0%.
Strogonov (1964) y Mass (1990), mencionaron como efecto más común de la salinidad, el retraso general del crecimiento de la planta; cuando la concentración de sales aumenta, arriba del nivel límite, la velocidad del crecimiento y el tamaño de la mayoría de las especies decrecen progresivamente. Concentraciones altas de sal afectan la etapa y tasa de germinación, longitud del tallo, ramificación y tamaño de las hojas (Gutiérrez-Rodríguez et al., 2005; Gama et al., 2007). Los grados de afectación son diferentes entre variedades y tipo de sal (Rogers et al., 1998; Sánchez-Bernal et al., 2008).
En los suelos agrícolas con problemas de salinidad es necesario conocer la tolerancia de los cultivos a las concentraciones y tipos de sal presentes en la solución del suelo. Basándose en estos datos el productor puede hacer un manejo adecuado del suelo y del agua de acuerdo a los límites de tolerancia del cultivo a la sal y con esto hacer más rentable la producción. Por lo cual el objetivo del trabajo fue evaluar la respuesta a la salinidad inducida con NaCl, Na2SO4 y NaHCO3 de las variedades de frijol Negro, Pinto y Azufrado, en la etapa de germinación y plántula.
Materiales y métodos
Se trabajó con semillas de frijol Negro Jamapa, Pinto y Azufrado, recolectadas en el distrito de riego número 043 ubicado en la zona costera del estado de Nayarit, México. El experimento se estableció en invernadero, en la Unidad Académica de Agricultura de la Universidad Autónoma de Nayarit, ubicada entre los 21° 25’ 40.88’’ latitud norte y 104° 53’ 29.54’’ longitud oeste, a una temperatura promedio mensual de 28 °C a una altura de 974 msnm.
En macetas de color negro de 500 mL con agrolita como sustrato se sembraron 10 semillas de frijol a un centímetro de profundidad. Las semillas fueron esterilizadas con solución de hipoclorito de sodio al 5% y enjuagadas con agua destilada. Previo a la siembra se aplicó el riego hasta capacidad de retención de agua del sustrato con agua destilada como testigo (T0= 0 g L-1) y soluciones salinas (T1= 0.64; T2= 1.472; T3= 2.304; T4= 3.2; T5= 4.032 y T6= 5.76 g L-1). Una vez vertida la solución, las macetas se pesaron diariamente para conocer el agua evapotranspirada. El volumen evapotranspirado se repuso con agua destilada, para mantener la concentración de la sal constante en el tiempo. Después de germinada la semilla se procedió a dejar cinco plántulas por maceta, continuando con el riego con agua destilada.
Tratamientos
La concentración de las soluciones salinas de NaCl, Na2SO4 y NaHCO3 se calculó con base en la conductividad eléctrica (CE) teórica y la disminución del rendimiento de 0% a 150%, la ecuación utilizada fue propuesta por Mass y Hoffman (1977): Y= 100 - b(CEs - Su): donde: Y= rendimiento potencial (%); CEs= conductividad eléctrica de la solución (dS m-1); Su= salinidad umbral (dS m-1); b = es la disminución del rendimiento por aumento unitario de salinidad.
Los tratamiento investigados fueron testigo 0% (T0), 0% umbral (T1), 25% (T2), 50% (T3), 75% (T4), 100% (T5) y 150% (T6), donde las CE teóricas fueron: T0= 0 dS m-1; T1= 1 dS m-1; T2= 2.3 dS m-1; T3= 3.6 dS m-1; T4= 5 dS m-1; T5= 6.3 dS m-1 y T6= 9 dS m-1.
Preparación de soluciones
La cantidad de sal en los tratamientos, se calculó mediante la aplicación de las ecuaciones propuestas por el Laboratorio de Salinidad de los Estados Unidos de América (Richards, 1990).
Donde: mg L-1= concentración de las sales en solución; CE= conductividad eléctrica de la solución (dS m-1 a 25 °C).
Para fines de cálculo se consideró que 0.64 g L-1 de sal genera una conductividad eléctrica teórica de 1 dS m-1.
Diseño experimental
Se utilizó un diseño factorial A×B×C, completamente al azar con cinco repeticiones. Donde A= concentración de sal, B= variedad de frijol y C= tipos de sal. El primer factor tuvo siete niveles (T0= 0 g L-1; T1= 0.64 g; T2= 1.472 g; T3= 2.304 g; T4 = 3.2 g; T5= 4.032 g y T6= 5.76 g), el segundo tres (frijol Negro, Pinto y Azufrado) y el tercero tres (NaCl, Na2SO4 y NaHCO3). Como unidad experimental se consideró una maceta con 10 semillas germinadas para la primera etapa y cinco plántulas para la segunda.
Variables estudiadas
En la etapa de germinación se evaluó con la aparición del hipocótilo con los cotiledones sobre la agrolita y en la etapa de plántula cuando hubo efecto de la concentración de las sales en la primera hoja trifoliada. Para obtener el porcentaje de germinación se cuantificaron las semillas germinadas respecto al total. En la etapa de plántula, al término del experimento, a los 22 días, se midió la longitud en cm de la plántula y la raíz. La biomasa fresca y seca del vástago y la raíz, se evaluó con el peso fresco y seco en g, se usó una balanza analítica y estufa a 60 °C.
Análisis estadístico
Se aplicó análisis de varianza usando el programa SAS (SAS Institute, 1999). Las diferencias entre las medias fueron comparadas por Tukey (p≤ 0.05) y se realizaron análisis de regresión.
Resultados y discusión
Germinación
En la interacción factor frijol por concentración de sal se encontró que a una concentración de 2.304 g el frijol Negro disminuyó en mayor valor su germinación. En la interacción tipo de sal por tipo de frijol el frijol Azufrado y Pinto obtuvieron la mayor germinación con Na2SO4, pero con NaHCO3 Azufrado y Pinto disminuyeron hasta alcanzar valores cercanos al del frijol Negro.
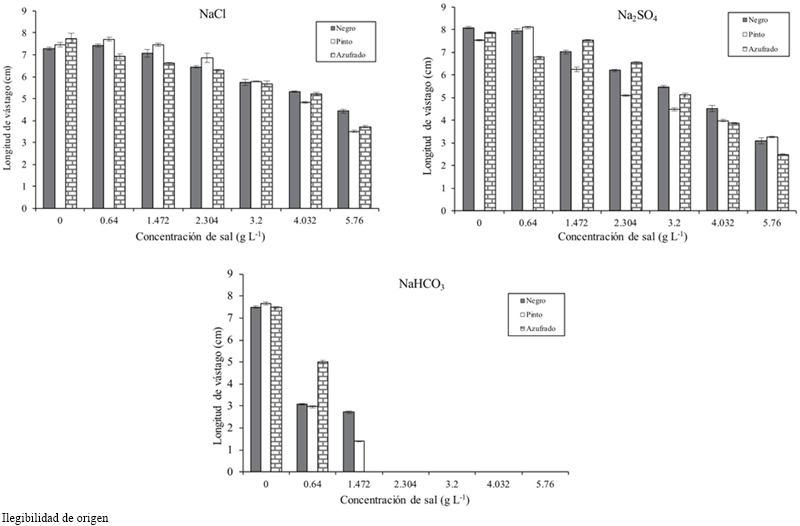
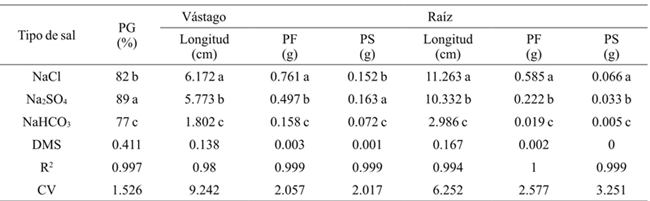
En general el porcentaje de germinación disminuyó conforme se incrementó la concentración salina (Cuadro 1), la CE teórica de 3.6 dS m-1 con 2.304 g de sal la disminuyó 7%, la concentración de 4.032 g 31% y con 5.76 g 49%, con respecto al umbral, para todas las concentraciones y tipos de sal. La variedad de frijol más resistente en la atapa de germinación a todas las concentraciones y tipos de sal fue el Azufrado, seguido del Pinto y del Negro (Cuadro 2). El tipo de sal afectó de manera particular a cada variedad, el NaCl afectó más al frijol Pinto, el Na2SO4 al frijol Negro y el NaHCO3 al frijol Pinto (Figura 1). El tipo de sal, a todas las concentraciones, que más disminuyó el porcentaje de germinación de todas las variedades de frijol fue el NaHCO3 (33%), seguido del NaCl (18%) y el Na2SO4 (11%) (Cuadro 3).
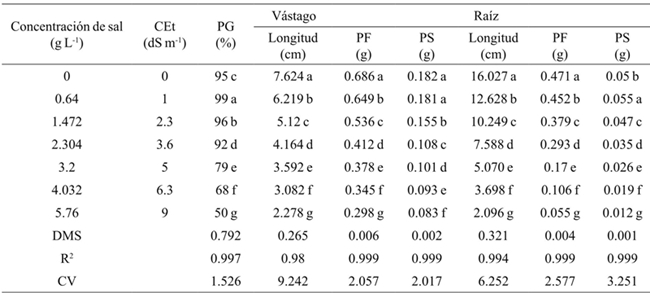
Promedios en una columna con la misma letra son estadísticamente iguales (Tukey, 0.05). CEt= conductividad eléctrica teórica; PG= porcentaje de germinación; PF= peso fresco; PS= peso seco; DMS= diferencia mínima significativa; CV= coeficiente de variación. Anova general, sin discriminar por tipo de sal ni variedad
Cuadro 1 Efecto de las concentraciones de sal en la germinación, longitud, biomasa fresca y seca del vástago y raíz en frijol.
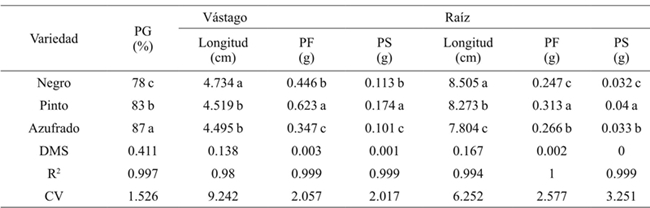
Promedios en una columna con la misma letra son estadísticamente iguales (Tukey, 0.05). PG= Porcentaje de germinación; PF= peso fresco; PS= peso seco; DMS= diferencia mínima significativa; CV= coeficiente de variación. Los valores corresponden a la respuesta de cada variedad al factor salinidad sin discriminar concentración y tipo de sal.
Cuadro 2 Efecto de las variedades en la germinación, longitud, biomasa fresca y seca del vástago y raíz en frijol.
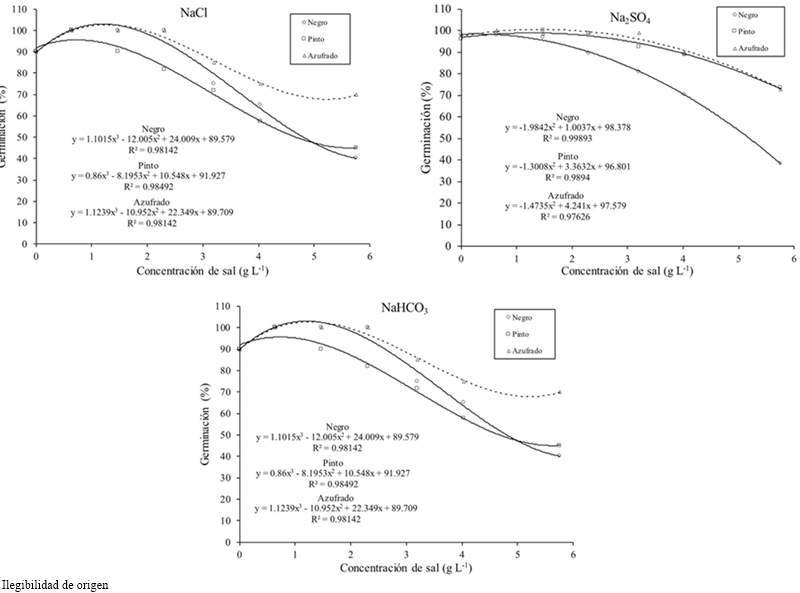
Figura 1 Germinación de variedades de frijol en condiciones de salinidad inducidas con NaCl, Na2SO4 y NaHCO3.
Promedios en una columna con la misma letra son estadísticamente iguales (Tukey, 0.05). PG= porcentaje de germinación; PF= peso fresco; PS= peso seco; DMS= diferencia mínima significativa; CV= coeficiente de variación. Los valores corresponden a medias generales para todas las variedades y todas las concentraciones usadas para cada tipo de sal.
Cuadro 3 Efecto de los tipos de sal en la germinación, longitud, biomasa fresca y seca del vástago y raíz en frijol.
Parte aérea
En la interacción factor frijol por concentración de sal se encontró que la longitud, biomasa fresca y seca del vástago de la concentración 0.64 a 2.304 el frijol Azufrado fue el más afectado con menor valor para estas variables. En la interacción tipo de sal por tipo de frijol la longitud, biomasa fresca y seca del vástago en frijol Azufrado fue de menor valor con NaCl y Na2SO4 pero con NaHCO3 las tres variedades disminuyeron drásticamente los valores de estas variables y fueron cercanos entre si.
El Cuadro 1 mostro conforme incrementó la concentración salina la longitud, biomasa fresca y seca del vástago disminuyeron. A una concentración de 4.032 g L-1 la longitud disminuyó 3.138 cm y a 5.76 g 3.942 cm, con respecto al umbral, para todas las concentraciones y tipos de sal. La variedad que alcanzó mayor biomasa fresca y seca para todas las concentraciones y tipos de sal fue el frijol Pinto (Cuadro 2). La etapa de plántula la sal que más afectó la longitud, biomasa fresca y seca de vástago y raíz de las variedades de frijol fue el NaHCO3 (Cuadro 3), a una concentración de 2.304 g de NaHCO3 ninguna variedad sobrevivió (Figura 2).
Parte subterránea
En la interacción factor frijol por concentración de sal se encontró que la longitud, biomasa fresca y seca de raíz de concentración 0.64 a 2.304 el frijol Azufrado fue el más afectado con menor valor para estas variables. En la interacción tipo de sal por tipo de frijol la longitud, biomasa fresca y seca de raíz en frijol Azufrado fue de menor valor con NaCl y Na2SO4 pero con NaHCO3 las tres variedades disminuyeron drásticamente los valores de estas variables y fueron cercanos.
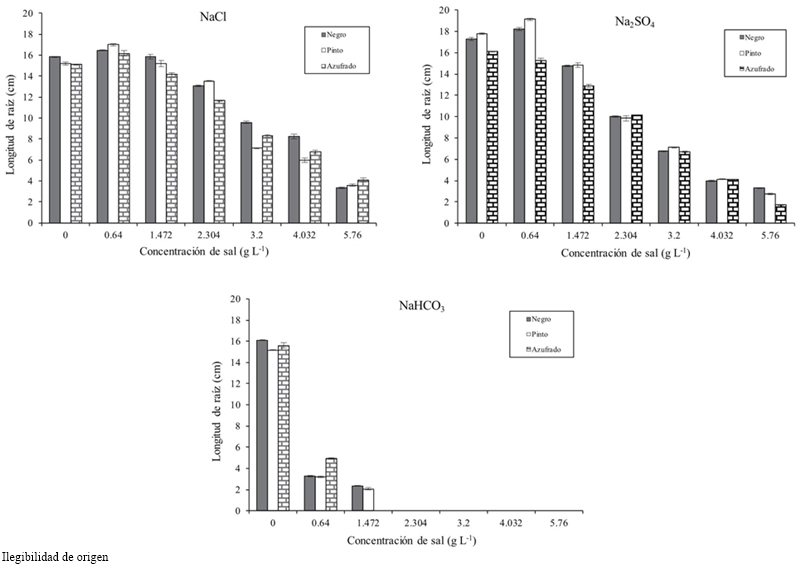
La longitud, biomasa fresca y seca de la raíz disminuyó conforme incrementó la salinidad. La longitud de la raíz en relación con el umbral tuvo una diferencia en promedio de 8.93 cm a concentración de 4.032 g L-1 y 10.532 a 5.76 g (Cuadro 1). El frijol Pinto obtuvo mayor biomasa fresca y seca para todas las concentraciones y tipos de sal, seguido del Azufrado y Negro (Cuadro 2). La Figura 3 muestra que el NaHCO3 a concentración de 2.304 g no permitió el desarrollo de la raíz. El NaCl afecta menos la longitud de la raíz que el Na2SO4.
Discusión
Germinación
Mass y Hofman (1977) establecen, con base al porcentaje de rendimiento relativo, como límite de tolerancia del frijol (umbral) en términos de conductividad eléctrica 1 dS m-1 (0.64 g L-1), los datos de este estudio coinciden, sin embargo el testigo (agua destilada) tuvo una germinación 4% menor al del tratamiento con 0.64 g de sal. La germinación en condiciones salinas donde no se utiliza agua destilada, condiciones de invernadero y sustrato inerte no reflejan esta diferencia. Sobre este resultado se infiere que la concentración de iones en las soluciones, hasta cierto límite superior e inferior, cumple una función importante en la activación del metabolismo de la semilla y funcionan como escarificadores para potenciar la germinación.
La tolerancia a la salinidad en la etapa de germinación es importante porque determina rápida implantación del cultivo y ventaja competitiva en el crecimiento y producción. La tolerancia a la salinidad entre variedades de frijol fue diferente y en general el incremento en salinidad disminuyó el porcentaje de germinación después del límite de tolerancia. Investigaciones sobre germinación en medios salinos demuestran esta tendencia, Yokoishi y Tanimoto (1994) con Suaeda japonica Makino y Chenopodium quinoa Willd, Madueño et al. (2006) con Rhynchosia minima L., Konak et al. (1999) y Bagci et al. (2007) con variedades y genotipos de Triticum aestivum L.
La semilla para germinar requiere absorber agua en cantidad suficiente para activar su metabolismo. La reducción en el porcentaje de germinación ocurre por estrés osmótico generado por las sales y la toxicidad de iones específicos. Un potencial osmótico menor en el medio de germinación debido a la presencia de altas concentraciones de sales promueve estrés osmótico. Mientras mayor sea la concentración de sales menor será el potencial osmótico, el potencial hídrico disminuirá y el agua estará menos disponible para la imbibición de la semilla.
El estrés osmótico con ciertas sales como el NaHCO3 ocasiona toxicidad, por lo que la disminución de la germinación es aún mayor. Nuestros resultados de germinación con el NaCl y el Na2SO4 coinciden con los de Huang y Redmann (1995) quienes en especies de cebada y canola, encontraron menos afecto por sales de sulfato en comparación con el NaCl.
Parte aérea
Si la concentración de sal del medio de crecimiento supera al límite de tolerancia de la planta, la altura, biomasa fresca y seca del vástago, así como el contenido de agua en la planta disminuyen (Cachorro et al., 1993; Hosseini et al., 2002; Bai et al., 2008; Keshavarzi, 2012; Habtamu et al., 2014). Algunas plantas para tolerar niveles altos de salinidad en el medio de crecimiento realizan un ajuste osmótico, que les permite generar potenciales menores al medio y poder absorber el agua y los nutrientes. El ajuste osmótico permite mantener o incrementar la turgencia celular y el crecimiento de la planta (Bai et al., 2008; Bahena-Betancourt et al., 2008; Pratap y Sharma, 2010).
Las plántulas para disminuir su potencial osmótico absorben los iones en solución y los acumula en el tejido, así contrarrestan el potencial tóxico que generan las sales. Algunos iones absorbidos tienen efectos tóxicos cuando superan los límites específicos de tolerancia de cada planta. El Na+, Cl- y SO42- contribuyen con el ajuste osmótico (Ottow et al., 2005). Bhivare y Nimbalkar (1984) encontraron que las sales NaCl y Na2SO4 propiciaron la suculencia de las hojas, sin embargo el NaCl reduce la altura y materia seca de la planta, además mejora el balance catiónico en comparación con el Na2SO4. Cachorro et al. (1993) concluyeron que Phaseolus vulgaris L. es sensible a la salinidad por NaCl y la inhibición del crecimiento se debió a efectos tóxicos de ión CI-. El bicarbonato a baja concentración tuvo efecto muy tóxico, en Picea glauca la biomasa aérea disminuyó con sodio en combinación con carbonato a bajas concentraciones (0.5 dS m-1) (Maynard et al., 1997).
El mayor efecto del NaHCO3 puede atribuirse al efecto osmótico y a la generación de pH alcalino que afecta la actividad de enzimas y procesos metabólicos en las células (Yildirim et al., 2006; Pratap y Sharma, 2010).
En el presente trabajo, al finalizar la germinación se observó que el hipocótilo y la radícula a 2.304 g de NaHCO3 resultaron fuertemente dañados, las que sobrevivieron a concentraciones menores a 2.304 g de NaHCO3 tuvieron una reducción en la longitud del vástago y la raíz en la etapa de plántula. La disminución de la biomasa fresca y seca del vástago del frijol se atribuye al estrés salino que pudo provocar una reducción en la absorción de agua.
La planta para realizar el ajuste osmótico bajo condiciones de salinidad activa mecanismos de adaptación para generar compuestos orgánicos. Además de la acumulación de Na+ y Cl- en los tejidos, la planta también genera prolina como respuesta al estrés osmótico (Misra y Gupta, 2005; Slama et al., 2007; Bai et al., 2008). Bahena-Betancourt et al. (2008) mencionan que también se generan carbohidratos totales en hojas y tallos, para mantener la turgencia en etapas iniciales del agobio salino.
Parte subterránea
La salinidad provocado por NaCl redujo la longitud, biomasa fresca y seca de la raíz lo cual fue más notorio conforme se incrementó la salinidad del medio y fue diferente entre variedades. Se observó que a partir de 2.3 g es el Na2SO4 más inhibitorio que el NaCl sobre la longitud de raíces. Esta tendencia se observó en especies forrajeras (Shen et al., 2003), en especies de Glycine max (Kao et al., 2006), en Amaranthus spp. (Omamt et al., 2006), en Phaseolus vulgaris L. (Gama et al., 2007; Bahena-Betancourt et al., 2008; Radi et al., 2013; Habtamu et al., 2014) y en Medicago sativa L. (Farissi et al., 2013).
Estudios en etapa de germinación de Lactuca sativa L. encontraron que la longitud de la plúmula y la radícula disminuyeron cuando aumento el nivel de salinidad (Keshavarzi, 2012). En este estudio, se encontró que a partir de 1.472 g de NaHCO3 el desarrollo del embrión se detuvo y a niveles más altos murieron. Reginato et al. (2014) en Prosopis strombulifera con NaCl y Na2SO4 encontraron que el SO42- tuvo un efecto más perjudicial sobre el crecimiento de la raíz que el Cl-. En la Figura 3 de nuestro trabajo se observó un efecto drástico inhibitorio del crecimiento de raíz con el NaHCO3 a concentraciones de 2.034 g L-1.
Bai et al. (2008) encontraron que el déficit de agua de los brotes fue mayor que el de las raíces y tuvo una correlación positiva con la concentración de sal. Bajo estrés salino el transporte de agua fue inhibido desde la raíz hasta la plántula y esto mantuvo al Na+ en las raíces. Hirpara et al. (2005) con Butea monosperma Taub y NaCl encontraron que el crecimiento de raíz fue mucho mayor que el vástago, y que el contenido de agua de todos los tejidos de raíces primarias y raíces laterales se redujo, resultando en déficit de agua interno y una inhibición de la suculencia. En esta investigación la biomasa fresca de la raíz con respecto al testigo fue menor y se atribuye al estrés hídrico que pudo causar una disminución del contenido de agua en la raíz.
Conclusiones
El porcentaje de germinación, longitud y biomasa del vástago y la raíz del frijol, se redujo con el incremento de la concentración en los tres tipos de sal.
En germinación el frijol Azufrado fue menos afectado por las sales. El NaHCO3 fue la que más disminuyó el porcentaje de germinación de todas las variedades de frijol.
En plántula el frijol Azufrado fue el más afectado y el Negro obtuvo mayor longitud de vástago. A 2.304 g L-1 (3.6 dS m-1 teórico) de NaHCO3 ninguna variedad sobrevivió.
El daño de las sales fue NaHCO3>NaCl> Na2SO4.











 texto en
texto en