Introducción
Vitis tiliifolia es una uva silvestre que aún no ha sido reconocida adecuadamente por investigadores y enólogos. Es un arbusto que puede ser pequeño a muy grande, con tallos leñosos que pueden medir entre 10 y 35 m de largo y hasta 20 cm de diámetro. Crece comúnmente en bosques húmedos, secos y matorrales, encontrándose a menudo en los bosques de pinos y encinos, aunque es más abundante en elevaciones bajas. Su presencia se extiende a 1 700 msnm. Esta uva es originaria de los estados del sur de México y crece en un rango desde las Antillas hasta Colombia (Fernández, 2009). En México, crece en los estados de Chiapas, Colima, Guerrero, Hidalgo, Nuevo León, Oaxaca, Querétaro, San Luis Potosí, Tabasco y Veracruz, donde es conocida por diferentes nombres de acuerdo a donde crece, tales como uva de montaña, liana cazadora de agua, broncadora, conduj, Gunhi, loobabi-chuli, sanalo todo, tecamate, xocomecatl, y otros más (Arellano et al., 2003). Vitis tiliifolia florea de mayo a junio y fructifica de agosto a noviembre (Ibarra-Manríquez and Sinaca, 1996). Sus frutos han sido utilizados como materias primas para elaborar jugos y vinos artesanales (Lascurain et al., 2010). Las uvas frescas se utilizan para hacer vinagre y bebidas no alcohólicas (Fernández, 2009), mientras que la raíz y las hojas se utilizan empíricamente contra las hemorroides. La uva contiene una sola semilla que puede ser considerada como una fuente no convencional de lípidos; pero hasta el momento esta semillas no ha sido explotada.
Las semillas de la uva usualmente son desechadas como parte del proceso de elaboración del vino; Sin embargo, la extracción y la venta de aceite de semillas de uva y extracto de semillas de uva puede ser un negocio rentable, así como un uso eficiente de los subproductos. El aceite de semilla de uva de otras variedades es conocido por los beneficios de su valor nutricional, debido a su alto contenido de ácido linoleico (aproximadamente 72-76%), este se utiliza comúnmente para freír alimentos (debido a su alto punto de humo) o se incluye en aderezos y salsas. Tambien se utiliza en cosméticos debido a sus propiedades humectantes de la piel (Da Porto et al., 2013). Las semillas de uva son una fuente rica de compuestos fenólicos monoméricos tales como (+)-catequina, (-)-epicatequina, (-)-epicatequina-3-O-gallate y dimeros, trimeros y tetrameros de procianidinas (Saito et al., 1998). Además, el aceite y la harina de uva contienen polifenoles y otros compuestos bioactivos que son atractivos para la industria debido a sus propiedades antioxidantes (Crews et al., 2006). Estos compuestos son de gran interés para las industrias farmacéutica y de alimentos ya que poseen propiedades anti-envejecimiento, anti-inflamatoria, anti-carcinogénica, anti-mutagénica, anti-ulceras y efectos anti-virales, además de estar asociados con un menor riesgo de enfermedades cardiovasculares (Da Porto et al., 2013).
Sin embargo, por lo que sabemos no existe información relativa a las propiedades fisicoquímicas y la composición del aceite de la semilla de Vitis tiliifolia. Por lo tanto, el objetivo de este trabajo fue evaluar la composición, propiedades fisicoquímicas y antioxidantes del aceite y la harina obtenida de la semilla de Vitis tiliifolia. Esta información es esencial para una evaluación completa del uso del aceite en posibles aplicaciones industriales.
Materiales y métodos
Reactivos
2,2’-difenil-1-picrilhidrazil (DPPH), Trolox (ácido 6-hidroxi-2, 5, 7, 8-tetrametilcroman-2-carboxílico), reactivo de Folin-Ciocalteu, 2,4,6-tris (2 piridil) -1, 3,5-triazina (TPTZ), ácido gálico, ácido 4-hidroxibenzoico, (+)-catequina, ácido vainillico, ácido clorogénico, ácido cafeico, (-)-epicatequina, vainillina, ácido-4-cumarico, quercetina-3-glucosido, quercetina, rutina, ácido ferulico, ácido trans-cinamico, mangiferina, umbeliferona, quercetina 3,4-di-O-glucosido, escopoletina, ácido ferúlico, quercetina-3-D-glucosido, luteolina 7-O-glucosido, kaemferol 3-O-glucosido, ácido 2,4-dimetoxi-6-metilbenzoico, cirsimarina, luteolina, angelicina, apigenina, kaempferide, piperina y ácido dehidroabietico fueron comprados a Extrasynthese (Lyon, France), y a Sigma-Aldrich (USA).
Los solventes utilizados para la extracción fueron grado analítico y los utilizados para los procesos de Cromatografía de Líquidos de Ultra Alta Resolución (UPLC) fueron comprados a Sigma-Aldrich (USA). Las soluciones de referencia, muestras, solventes y reactivos fueron filtrados a través de un filtro de membrana PTFE 0.20 µm (Phenomenex, USA) antes de la separación o inyección en el equipo.
Obtención de las muestras
Las muestras de Vitis tiliifolia fueron recolectadas del rancho el “Cafetal”, localizado en el estado de Veracruz, México. Situado en las coordenadas 19° 37’ 0.4” latitud norte y 96° 50’ 2.7” longitud oeste, a una eltitud de 734 m. Las variedades de uva fueron recolectadas en estado óptimo de maduración, con sólidos solubles fueron entre 12-14 °brix. Las semillas fueron obtenidas por separación manual a partir de 5 kg de muestra, fueron lavadas varias veces con agua, secadas en estufa de vacío (Shel Lab, USA) a 50 °C, posteriormente se pasaron a través de un molino (Glen Mills, USA) varías veces hasta obtener un menor tamaño de 0.5 mm. La muestra fue dividida en porciones de 100 g, colocadas en bolsas a vacío, congeladas a -40 °C y protegidas de la luz para su posterior análisis.
Determinación de propiedades fisicoquímicas de la harina
El contenido de nitrógeno total fue determinado por el método micro-Kjendahl y la proteína fue calculada utilizando el factor de 6.25, el contenido de cenizas fue determinado pesando el producto incinerado en una mufla a 550 °C. La acidez total titulable, azucares reductores y la concentración de fibra total dietaria fueron determinados de acuerdo a la metodología descrita en el AOAC (2000). El aceite fue extraído de la harina seca utilizando un equipo Soxhlet y hexano (60-80 °C) durante 6 h. Los extractos fueron filtrados y concentrados a vacío para obtener los extractos crudos los cuales fueron almacenados en un desecador hasta que fueron utilizados.
Determinación de parámetros fisicoquímicos de aceite
El índice de peróxido, porcentaje de acidez, índice de yodo, materia saponificable e insaponificable fueron evaluados de acuerdo con los Métodos Oficiales y Practicas Recomendadas de la AOCS (1998). El índice de refracción fue determinado con un refractómetro Abbe a 40 °C y la viscosidad fue medida con un viscosímetro Anton Paar a 25 °C. La acidez titulable, fue determinada por titulación de una solución de aceite disuelto en una mezcla de etanol: eter (1:1, v: v) con una solución de hidróxido de potasio 0.1 M en etanol. Los índices espectroscópicos, K232, K268, en la región UV, fueron determinados con un espectrofotómetro UV/Vis (JENWAY, modelo 6305, Japon), en el aceite diluido con isooctano [10]. La determinación del perfil de ácidos grasos del aceite de Vitis tiliifolia fue realizado de acuerdo al método descrito por López et al. (2001).
Análisis de actividad antioxidante
La actividad antioxidante fue analizada en los extractos metanol:agua (3:1; v: v) y metanol:0.1% HCl (v: v) obtenidos a partir de la harina. Alícuotas de 5 g de las muestras pulverizadas (harina) se pesaron en matraces Erlenmeyer y se extrajeron con 100 mL de los disolventes antes mencionados durante 24 h con agitación. Posteriormente se lavaron con nitrógeno con la finalidad de evitar la oxidación. Los extractos se centrifugaron (10 min, 5 366 g) y los sólidos se volvieron a extraer con 100 mL de los respectivos disolventes durante 60 min. Por último, los extractos se combinaron y se filtraron a vacío a través de filtros Whatman núm. 1, y a continuación se concentraron en un rotaevaporador a 35 °C (R-210; Büchi, Flawil, Suiza).
Contenido de fenoles totales
El contenido total de fenoles totales fue determinado usando el método Folin-Ciocalteu (Singleton y Rossi, 1965). Los extractos de uva fueron mezclados con reactivo de Folin-Ciocalteu y posteriormente se agregó solución de carbonato de sodio (10%). La mezcla se dejó reaccionar a temperatura ambiente en oscuridad durante 120 minutos, posteriormente se midió la absorbancia a 765 nm. El resultado se comparó con una curva de calibración (R2= 0.89) obtenida con un rango similar de concentraciones de ácido gálico, y se expresó como mg equivalentes de ácido gálico (EAG) por g de extracto.
Capacidad de captura de radical libre DPPH
La capacidad de captación de radicales libres DPPH se estimó mediante el método de Brand-Williams et al. (1995). Los extractos previamente obtenidos de las semillas se mezclaron con solución metanólica de DPPH y se mantuvieron en oscuridad durante 30 min. La absorbancia de la mezcla de reacción se midió a 517 nm en un espectrofotómetro UV/VIS (Jenway, modelo 6305, Japón).
Actividad antioxidante (%) expresada en porcentaje de oxidación de β-caroteno/linoleico
La actividad antioxidante fue evaluada a través del blanqueo de β-caroteno de acuerdo a lo reportado por Oboh et al. (2009). La absorbancia de las muestras y el control se midieron a 470 nm utilizando un espectrofotómetro UV/Vis (JENWAY, modelo 6305, Japón) contra una blanco que consiste en emulsión de β-caroteno libre.
Poder reductor
El poder reductor se determinó de acuerdo al método de Yen y Duh (1993). Una alícuota de 0.125 mL de la muestra a una concentración de 1 mg mL-1 se colocó en un tubo de ensayo y se añadieron 1.25 mL de búfer de fosfatos (200 mM, pH 6.6) y 1.25 mL de ferrocianuro de potasio (1%). La mezcla fue incubada a 50 °C durante 20 min. Después, se añadieron 1.25 mL de ácido tricloroacético al 10%, la cual se centrifugó a 650 x g durante 10 minutos. Una alícuota de 2.5 mL del sobrenadante se transfirió a un nuevo tubo y se añadieron 2.5 mL de agua destilada y 0.5 mL de cloruro férrico. La densidad óptica se midió a 700 nm en un espectrofotómetro UV/VIS (Jenway, modelo 6305, Japón).
Identificación y contenido de polifenoles en la harina de semilla de uva
Para el análisis fitoquímico, los extractos fueron preparados utilizando un sistema de extracción acelerada por disolventes (ASE 350, Thermo Scientific, EE.UU.), 3.0 g de material seco se dispersaron en 1 g de tierra de diatomeas y colocado en una celda de 34 mL. La celda se llenó con metanol hasta una presión de 1 500 psi y se calentó a 60 °C durante 5 min después las celdas se lavaron con 30% del volumen de la misma. El extracto se concentró con un rotaevaporador (Büchi RII, Suiza). 10 mg de extracto crudo se redisolvieron en 1 mL de MeOH con 0.1% de ácido fórmico (grado MS, Sigma-Aldrich), se filtraron y se colocaron en un vial de 1.5 mL. La muestra se analizó por triplicado. La identificación y cuantificación de compuestos fenólicos individuales, fue establecida por cromatografia de ultra alta resolución (UPLC) (Agilent serie 1290) y monitoreo dinámico multiple reacción de (dMRM) siguiendo las condiciones del protocolo de Durand-Hulak et al. (2015).
Resultados y discusión
Caracterización de harina obtenida de semillas de Vitis tiliifolia
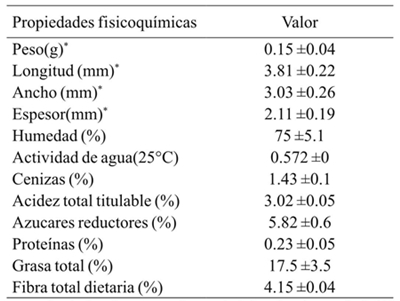
Algunos parámetros físicoquímicos de la semilla de la uva Vitis tiliifolia se describen en el Cuadro 1. Las semillas de Vitis tiliifolia son redondas, tienen una longitud promedio de 3.81 mm y una anchura de 3.03 mm. Su peso promedio es de 0.15 g, con un contenido de humedad de 75%. El porcentaje de acidez total titulable (3.02%) es inferior a lo reportado para otras variedades de uvas (Jiang-Fei et al., 2012). Esta semilla tiene una menor cantidad de fibra dietética total (4.15%) que lo reportado para otras variedades de semilla de uva (Bravo y Saura-Calixto, 1998) y el contenido en aceite de las semillas de la uva fue 17.5%, lo que está en el rango de 9.9 a 20% reportado para otras variedades de uva (Bravo y Saura-Calixto, 1998; Ohnishi et al., 1990).
Análisis de compuestos químicos presentes en la harina de la semilla
Con el fin de obtener los compuestos que contribuyen de la alta actividad antioxidante, fueron identificados y cuantificados los polifenoles presentes en la harina de semilla (Cuadro 2). Se aislaron siete compuestos, y sus estructuras químicas se identificaron con las bases de los datos espectrales de cromatografía de ultra alta resolución- espectrometría de masas (UHPLC-MS). Se usó un protocolo de espectrometría de masas en modo de operación de monitoreo de reacciones múltiples (del inglés, MRM, MS), en un rango de tiempos de retención de 1.5 a 46 min, energía de colisión entre 10 y 30, con valores de R2> 0.971 de linealidad en el rango de concentración de 0.1 a 14 mM. Del extracto metanólico, los dos compuestos principales fueron: (-)-epicatequina (1 318.66 µg g-1) y (+)-catequina (703.12 µg g-1), seguido de trans-resveratrol (32.88 µg g-1), quercetina-3-glucósido (14.65 µg g-1), ácido gálico (3.32 ±0.49 µg g-1), quercetina-3-D-galactósido (1.38 µg g-1) y por último vainillina (0.83 µg g-1), todos ellos contribuyen a la actividad antioxidante en otros tipos de uvas (Maier et al., 2009).
Cuadro 2 Compuestos polifenólicos (µg kg-1) identificados en harina de Vitis tiliifolia usando cromatografía de ultra alta resolución-espectrometría de masas
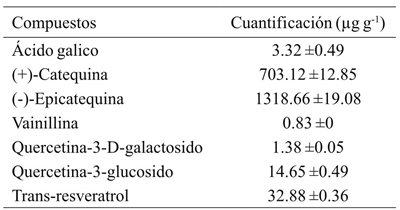
Los datos son expresados en promedio ± desviación estándar (n=3).
Se ha reportado que los grupos fenólicos presentes en productos naturales son responsables de la deslocalización electrónica a la cual se atribuye la capacidad de captura de radicales libres (Rice-Evans et al., 1996). Asimismo, la actividad antioxidante de los polifenoles se atribuye principalmente a su potente actividad como quelatante de metales y actividad antirradical. Frecuentemente se ha reportado que estos compuestos antioxidantes están presentes en uvas y proporcionan actividad antimutagénica, anti-inflamatoria y antiproliferativa. De igual manera, se ha demostrado que el resveratrol es un inhibidor de la ciclooxigenasa y los hidroperóxidos en varios sistemas experimentales (Aziz et al., 2003).
Propiedades fisicoquímicas del aceite
El Cuadro 3 muestra las propiedades fisicoquímicas y de calidad del extracto de aceite que fueron preparados usando el extractor Soxhlet. Los parámetros de color de L*, a* y b* fueron de 1.64, 1.06 y 1.72, respectivamente. No existen estándares de color para aceite de semilla de Vitis y estos valores podrían ser utilizados para la evaluación de su calidad. El parámetro a* está en el mismo rango que lo reportado para el aceite de semilla de chía (Ixtana et al., 2011). Las muestras mostraron valores positivos para el parámetro b*, característico de colores de color amarillo claro. Este color está asociado con el contenido total de pigmentos, tales como carotenoides. La densidad del aceite de semillas de Vitis tiliifolia fue de 0.909 g mL-1. Este valor es similar a lo reportado para el aceite de soya, pero es ligeramente menor al rango de densidad (0.92-0.926) para el aceite de las semillas de Vitis vinifera L. (FAO/OMS, 1999). Esta diferencia en la densidad de los aceites pudiera deberse al método de extracción o a la diferencia al origen y tipo de semilla (Tsaknis et al., 1999). La actividad de agua (0.65) y el peso específico (0.926 g mL-1) fueron mayores que los reportados para otros aceites como el aceite de canola y linaza (Yin y Sathivel, 2010).
Cuadro 3 Parámetros fisicoquímicos del aceite extraído por Soxhlet de Vitis tiliifolia
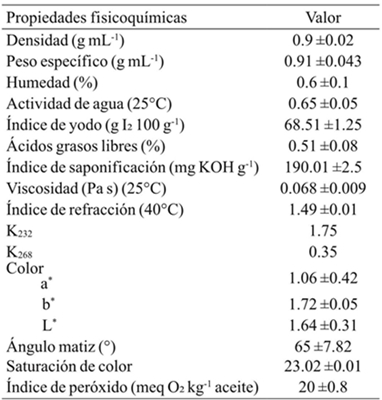
Los datos son expresados en promedio ± desviación estándar (n= 3).
El contenido de humedad (0.6%) del aceite fue ligeramente mayor que lo reportado (0.4 a 0.58%) para aceites comestibles, lo que indica mayor susceptibilidad a la degradación tal como la hidrólisis de los lípidos que pueden causar reacciones de oxidación indeseables (Bhattacharya et al., 2008; Adedokun y Onuegbu 2011). El índice de refracción del aceite de la semilla de Vitis tiliifolia fue similar al de aceite de Chía (1.49) y aceite de Jatropha (1.47), lo que indica que contienen cantidad similares de ácidos grasos libres (Eromosele y Pascal, 2003; Iztaina et al., 2011). Por otro lado, el índice de saponificación del aceite de Vitis tiliifolia fue 190.01 mg KOH g-1, este valor es similar al valor de saponificación de aceite de canola (Eskin et al., 1996). La viscosidad a 25 °C encontrada para este aceite (0.068 Pa s) se encontró en el rango reportado para algunos aceites comestibles (Hernández et al., 2013). El aceite tuvo un índice de acidez (1.02%) ligeramente mayor que el reportado para otros aceites tales como el aceite comestible de Dacryodes edulis (Adedokun and Onuegbu, 2011), pero menor a la de los aceites refinados y los aceites prensados en frío (FAO-OMS, 1999).
Champe y Harvey (1994) reportaron que la medición de acidez está en relación a la cantidad de ácidos grasos libres y sugiere un buen manejo poscosecha y un bajo contenido de humedad en el aceite. El índice de yodo encontrado (68.75 g I2/100 g) es menor al que se tiene como referencia para los aceites de semillas de uva (FAO-OMS, 1999), pero es mayor al reportado para otros tipos de aceites comestibles (Adedokun and Onuegbu, 2011), y para aceites de uva silvestre Vitis spp. (57.9 g I2/100 g) (Franco-Mora et al., 2015), lo que podría suponer que este comportamiento es característico de este tipo de uva. A su vez, el valor de peróxido mide los hidroperóxidos producidos por la oxidación de los aceites (Abbas et al., 2008).
Los valores obtenidos para el índice de peróxidos fueron mayores a los mínimos establecidos como estándar de referencia (hasta 10 meq O2 kg-1 de aceite) y que a los valores establecidos para los aceites prensados en frio y virgenes (hasta 15 meq O2 kg-1 de aceite) (FAO-OMS, 1999). De acuerdo a esto, algunos autores reportan que es importante refinar los aceites con el fin de obtener productos con propiedades deseables y aceptables que extenderán su vida útil (Yin y Sathivel, 2010). Por otro lado, los coeficientes de extinción específicos tuvieron valores de 1.72 y 0.35 para K232 y K268, respectivamente, revelando el deterioro oxidativo del aceite (Yoon et al., 1985). El coeficiente de extinción específica a 232 nm (K232) está relacionado con el grado de oxidación primaria del aceite. Este coeficiente es también un indicador de la conjugación de ácidos grasos poliinsaturados, mientras que K268 está relacionado con los productos de oxidación secundarios responsables de malos sabores.
Perfil de ácidos grasos del aceite
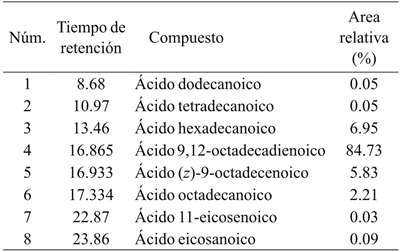
El Cuadro 4 muestra la composición de ácidos grasos de aceite de semilla de Vitis tiliifolia. El contenido de ácidos grasos saturados totales fue aproximadamente (9.35%). Sin embargo, en el aceite se encontró un alto nivel de ácidos grasos insaturados (90.59%). La concentración de ácidos grasos saturados fue de ácido palmítico (6.95%), ácido esteárico (2.21%), ácido araquidónico (0.09%), ácido láurico (0.05%) y ácido mirístico (0.05%). Entre los ácidos grasos poliinsaturados, se encontró en proporción más alta el ácido linoleico (Ω-6, 84.73%), seguido de ácido oleico (Ω-9, 5.83%), y ácido gondoico (Ω-11, 0.03%). El contenido de ácido linoleico fue cercano a lo reportado para aceite de semilla de Oecopetalum mexicanum (Hernández et al., 2013). Sin embargo, para su uso como aditivo o suplemento alimenticio es necesario considerar que debe haber un balance determinado entre ácidos grasos (Ω-6/(Ω-3) (Pisani et al., 2015).
Compuestos y actividad antioxidante del aceite
El Cuadro 5 muestra los componentes químicos y las propiedades antioxidantes de los extractos realizados con etanol: agua [3:1; v:v] y metanol: HCl (0.01%). La actividad antioxidante in vitro del aceite de semilla de Vitis tiliifolia se evaluó a través de la capacidad de captura del radical DPPH; actividad antioxidante se expresado como el porcentaje de oxidación de β-caroteno/linoleico y a través del poder reductor.
Cuadro 5 Composición química y actividad antioxidante semilla de Vitis tiliifolia en los extractos obtenidos usando diferentes mezclas de disolventes.
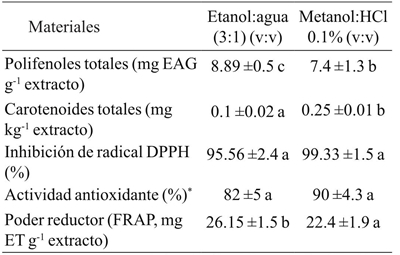
* = expresada como porcentaje de oxidación of β-caroteno/linoleico. EAG= equivalentes de ácido gálico; ET= mg equivalentes de Trolox. Valores con letras diferentes en la misma fila indican diferencias significativas (p< 0.05).
Concentración de polifenoles
Los compuestos fenólicos totales son un grupo importante de metabolitos secundarios presentes en las semillas. Por lo general, son abundantes en las uvas y desempeñan un papel importante en la calidad y el valor nutricional de las semillas de uva. El rango de compuestos fenólicos totales en el extracto de etanol:agua (8.89 mg EAG g-1 de extracto) fue mayor que en el extracto metanol:HCl (7.4 mg EAG g-1 de extracto). Estos valores fueron más bajos que lo que se ha reportado para extractos de aceite de Vitis vinifera y aceite de la variedad de uva roja (Apostolou et al., 2013). Estas diferencias en la concentración de compuestos fenólicos en los extractos líquidos podrían depender de la afinidad de los compuestos polifenólicos a un disolvente particular, que a su vez depende de la variedad de uva. Además, ésta concentración puede ser influenciada por factores climáticos y geográficos, prácticas culturales, y el estado de maduración (Burin et al., 2014), así como por el tipo y proporción de disolventes utilizados en la extracción, el tipo de extracción y el tratamiento utilizado.
Concentración de carotenos
Otra clase importante compuestos derivados del aceite de semilla de uva son los carotenoides. Estos compuestos poseen actividad antioxidante y están presentes en cantidades que variaron de 0.25 mg kg-1 a 0.1 mg kg-1 para el extracto etanol:agua (3:1; v:v) y metanol:HCl (0.01%) respectivamente. Estos valores son similares a los reportados para soya (0.3 mg kg-1), girasol (0.1 mg kg-1) y semillas de linaza (0.7 mg kg-1), pero inferior a la semilla de colza (1.9 mg kg-1) (tuberoso et al., 2007).
Inhibición de radical DPPH del aceite
La actividad de captura de radicales DPPH fue 95.56% y 99.33% para el extracto de etanol:agua y metanol:HCl, respectivamente. Ambos extractos no mostraron diferencias significativas en la captura de radical DPPH, lo que puede esperarse de las concentraciones de los compuestos bioactivos, tales como los polifenoles y carotenoides totales. Por lo tanto, los datos obtenidos revelan que estos compuestos actúan como inhibidores de radicales libres y confieren actividad antioxidante en este aceite de semilla de uva.
Actividad antioxidante del aceite (oxidación de β-caroteno/ácido linoleico)
Se determinó la actividad antioxidante basada en la inhibición de la oxidación de β-caroteno y ácido linoleico. Esta actividad varió desde 82% hasta 90% en los extractos etanol:agua y metanol:HCl, respectivamente, indicando en ambas muestras que la presencia de compuestos antioxidantes pueden obstaculizar el grado de la decoloración de β-caroteno por la neutralización del radical libre de linoleato y otros radicales libres formados en el sistema (Jayaprakasha et al., 2001).
Poder reductor (FRAP) en el aceite
El ensayo FRAP mostró los valores altos para ambos extractos de aceite de semillas. Los valores de FRAP variaron 22.40 a 26.15 mg ET g-1 de extracto de etanol:agua y metanol:HCl, respectivamente. Los resultados indican que la actividad antioxidante de los extractos de Vitis tiliifolia parece ser debido a la presencia de polifenoles. Estos polifenoles pueden actuar de manera similar a las reductonas, mediante la donación de electrones y reaccionar con los radicales libres para convertirlos en productos más estables y terminando con ello la reacción en cadena de los radicales libres (Jayaprakasha et al., 2001). De la misma manera, el poder reductor fue mayor en el extracto etanol:agua, lo que indica la presencia de compuestos que actúan como agentes reductores, demostrada por la reducción del ion férrico (Fe3+) a ion ferroso (Fe2+). Se encontró una alta correlación entre el contenido de polifenoles con la capacidad de captura del radical DPPH (R2= 0.86) y con la actividad antioxidante estimada a través de la oxidación β-caroteno-ácido linoleico (R2= 0.89). Ambos extractos mostraron actividad antioxidante estadísticamente iguales (p> 0.05), indicando que los compuestos presentes en ambos extractos tienen la capacidad de atrapar el radical DPPH e inhibir la peroxidación lipídica. Los datos obtenidos revelan que los compuestos presentes en los extractos son inhibidores de radicales libres y antioxidantes primarios que reaccionan con los radicales libres.
Conclusiones
El aceite y la harina obtenida de las semillas de Vitis tiliifolia poseen compuestos con propiedades funcionales que lo proponen para posibles usos comerciales e industriales. El aceite es rico en ácido linoleico y otros compuestos que le confieren actividad antioxidante. Las propiedades fisicoquímicas son adecuadas para su uso en la industria de alimentos y otras áreas afines. La harina de la semilla es rica en polifenoles, tales como catequina, epicatequina y trans-resveratrol quienes fueron los más abundantes. Estos antioxidantes presentes en la semilla pueden extraerse utilizando, ya sea, una mezcla de etanol:agua (3:1; v:v) o metanol:HCl (0.01%).











 texto en
texto en