El objetivo del presente trabajo fue hacer una caracterización foliar de la anatomía de la hoja del agave e identificar las vías de penetración del fertilizante foliar. Con base a metodologías utilizadas para estos fines (Nava et al., 2003; García et al., 2013), se utilizaron dos plantas de Agave tequilana de 1.5 años de edad, provenientes de la empresa Casa Herradura, en Amatitán Jalisco, México. Tomando en consideración las partes de la hoja que mayormente captan las soluciones aplicadas, las muestras se obtuvieron de la parte media y ápice de las hojas totalmente expandidas, localizadas tanto en la parte central como radial del cogollo. La investigación se desarrolló en el laboratorio de Histopatología Vegetal en el Colegio de Postgraduados Campus Montecillo, México, de agosto a septiembre de 2013. En la primera etapa, se caracterizó la estructura foliar y en la segunda se determinó la vía de penetración foliar del fertilizante.
Se disectaron fragmentos foliares de la parte apical y media de la hoja de aproximadamente 0.5 mm2, los cuales se cortaron en un micrótomo de congelación (American Optical, modelo 880), a un grosor de 25 μm (Sandoval, 2005). Para medir el grosor de la cutícula, las secciones obtenidas se tiñeron con Sudan IV (C24H20N4O) durante 25 min y se montaron con agua en portaobjetos y cubreobjetos. El Sudan IV se caracteriza por dar color a los lípidos al solubilizarse en ellos (Martínez y Gragera, 2008). Asimismo, otras secciones se tiñeron con Azul de Toluidina (C15H16N3S+) durante 20 min para diferenciar los haces vasculares (D’Ambrogio, 1986). Se tomaron fotografías con una cámara digital integrada a un microscopio de luz (marca Velab modelo Ve-B6); la medición cuticular se hizo con el software Motic Imágenes Plus 2 M1, considerando tres campos visuales por sección y corte (Guerrero et al., 2008; Alejo-Plata et al., 2011).
El fertilizante foliar utilizado en este experimento fue un 4-17-17, a base de urea, fosfato de amonio y fosfato potásico a l 1%, complementado con DAP-PLUS® como tensoactivo. Se utilizaron los colorantes verde rápido (C37H34N2O10S3Na2) + azul negro de naftol (C22H14N6Na2OS2) a una concentración de 0.05% como trazadores no fluorescentes para la ubicación de la solución fertilizante y calcofluor (Fluorescent Brightener 28, C40N42O10S2Na2) al 0.01% como un trazador fluorescente, estos colorantes se prepararon independientemente del fertilizante (Sandoval, 2005). Se asperjaron individualmente estos colorantes con el fertilizante y a la planta testigo se asperjó solo agua.
Después se muestrearon las hojas a los 30, 60, 90 y 120 min de haber aplicado el fertilizante foliar y de éstas se disectaron fragmentos de 0.6*0.4 cm (Sandoval, 2005), y se cortaron transversalmente con un microtomo de congelación (American Optical, modelo 880) a 25 μm de grosor. Los cortes se montaron en portaobjetos y cubreobjetos. Las muestras se trataron con fertilizante más los colorantes verde rápido + el azul negro de naftol (F-VR+ANN) y se observaron en un microscopio de luz marca Velab modelo VE-B y las asperjadas con el fertilizante más el calcofluor (F-C) se observaron en un microscopio de fluorescencia Carl Zeiss para visualizar la penetración a través de la fluorescencia de las estructuras anatómicas de la hoja (Nava et al., 2003; Sandoval, 2005; García et al., 2013); cabe señalar, que el calcofluor es un colorante fluorescente inespecífico que se enlaza a la celulosa y a la quitina de las paredes celulares, por lo que en caso de que haya penetración en la hoja de la solución, habrá una fluorescencia azul en las estructuras anatómica de la misma.
Los resultados muestran que la hoja de agave es isolateral, ya que en las dos superficies de la lámina se presentaron estratos pluriestratificados de parénquima en empalizada, mientras que en la porción central del mesófilo se observaron células parenquimatosas de apariencia isodiamétrica, entre las cuales se distribuyeron los haces vasculares. En la fotomicrografía A (Figura 1) (10 X), las flechas muestran la posición de los haces vasculares en la porción central del mesófilo (PCM) y las fibras que rodean a los haces vasculares, así mismo se puede observar que la hoja es anfiestomática. La fotomicrografía B (Figura 1), muestra los haces vasculares de menor diámetro en el límite interno del parénquima en empalizada (PE) y en la parte central del mesófilo (PCM) (40 X).
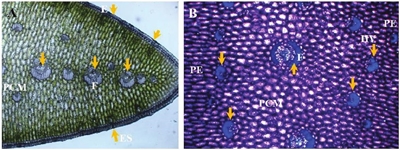
Figura 1 Fotomicrografías de sección transversal de hoja de agave. A= haces vasculares en la porción central del mesófilo (PCM), fibras (F), epidermis (E) y estomas (ES). B= haces vasculares (HV) en el límite interno del mesófilo (flechas), fibras (F), porción central del mesófilo (PCM), parénquima en empalizada (PE).
Por otra parte, ambas fotomicrografías evidencian que el tejido epidérmico estuvo formado por un estrato de células ligeramente alargadas en dirección perpendicular a la superficie de la hoja; no se observaron plastos, que son orgánulos celulares característicos de las plantas en el que se acumulan lípidos, proteínas, pigmentos, etc., según de qué tipo sea (cloroplastos, amiloplastos y proplástidos), y que es una característica típica de plantas adaptadas a condiciones de aridez (Nobel, 1988). La fotomicrografía A de la Figura 2, muestra que la pared tangencial externa presentó una cutícula gruesa (C) proyectada hacia las paredes periclinales y sobre una capa de células epidérmicas (CE).
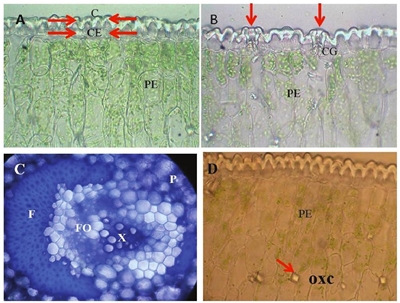
Figura 2 Fotomicrografías de sección transversal de hoja de agave. A= epidermis uniestratificada con células ordinarias sin plastos; cutícula (C), célula epidérmica (CE), parénquima en empalizada (PE). B= aparato estomático; célula guarda (CG), parénquima en empalizada (PE). C= tejido vascular; fibras (F), parénquima (P), xilema (X), floema (FO). D= parénquima en empalizada (PE) se señalan estructuras prismáticas, que pueden ser cristales cuya composición química probable sean de calcio (OXC).
Las células guarda (CG) se distribuyeron ligeramente más abajo que el resto de las células epidérmicas ordinarias, tal como se muestra en la fotomicrografía B (Figura 2). Aparentemente, las células del parénquima en empalizada (PE) presentaron mayor número de cloroplastos que las células parenquimatosas de la región central de la lámina (fotomicrografía A y B, Figura 2). Cada haz vascular presentó un gran número de fibras (F) y estuvo rodeado por células parenquimatosas de pared delgada (P), asimismo, se pueden observar el xilema (X) y el floema (FO) (fotomicrografía C, Figura 2); también se observan estructuras prismáticas no abundantes que probablemente sean cristales de oxalato de calcio (fotomicrografía D, Figura 2).
Las imágenes anteriores muestran cómo la hoja de agave tiene una cutícula gruesa, con revestimiento ceroso y una acumulación probablemente de oxalato de calcio en forma de cuerpos, lo que le permite aislar la superficie foliar e impenetrable a gases como el CO2 y vapor de agua, así como la protección ante agentes adversos del medio ambiente. También se puede notar que las células contienen grandes vacuolas para la acumulación de los ácidos orgánicos y agua.
En el mesófilo, en las células en empalizada, se observaron lo que probablemente sean cristales prismáticos de oxalato de calcio (Figura 2, fotomicrografía D). En plantas de 1.5 años de edad, el grosor promedio de la cutícula adaxial varió según la región en donde se tomó la muestra: en el ápice fue de 17.1μm, mientras que en la parte media fue de 19.1μm.
Respecto a las rutas de penetración, a los 30 min después de la aplicación del fertilizante foliar con verde rápido y azul negro de naftol (F-VR-ANN), el F-VR-ANN se acumuló en la cutícula, capa que se encuentra arriba de la epidermis (E) (fotomicrografía A, Figura 3), a los 60 minutos en los ostiolos de los estomas (ES) (fotomicrografía B, Figura 3), y a los 90 y 120 min en la cámara estomática y células del parénquima en empalizada (PE), respectivamente (fotomicrografía C y D, Figura 3). El empleo de los colorantes verde rápido y azul negro de naftol como trazadores permitió observar la acumulación de los mismos en los estomas y en la cutícula, para posteriormente encontrarlos en las células del parénquima, con estas evidencias se puede señalar que la penetración de solutos es vía estoma y cuticular; sin embargo, es necesario realizar más pruebas que permitan obtener información más consistente respecto a estas vías de penetración en Agave tequilana.

Figura 3 Fotomicrografías de secciones transversales en hojas de agave asperjadas con el fertilizante 4-17-17 más verde rápido y azul negro de naftol. A= la flecha indica la presencia del fertilizante a 30 min después de la aplicación en la superficie de la hoja; epidermis (E), parénquima en empalizada (PE). B: a 60 min el fertilizante se ubicó en los estomas (ES), parénquima en empalizada (PE). C= a 90 min el fertilizante se ubicó en el parénquima en empalizada (PE), estomas (ES). D= a 120 min el fertilizante se mantuvo en este mismo lugar; estomas (ES), parénquima en empalizada (PE).
En la aplicación del fertilizante foliar con calcofluor (F-C), en las fotomicrografías A y B de la Figura 4, se muestran cortes transversales de hoja, vistas en el microscopio de luz y de fluorescencia, respectivamente; se puede observar la cutícula (C) y el parénquima en empalizada (PE). A 30 minutos después de haber asperjado la hoja, el F-C se acumuló en la cutícula después de haber realizado la aplicación y hubo poca fluorescencia en las células del mesófilo (fotomicrografía C, Figura 4). A 60 min, la fluorescencia se observó en las células epidérmicas (fotomicrografía D, Figura 4). A 90 min después de la aplicación, se observó un ligero incremento de fluorescencia en algunas células del mesófilo (fotomicrografía E, Figura 4); y a 2 h, en todos los tejidos del mesófilo, incluyendo las cámaras subestomáticas (fotomicrografía F, Figura 4).
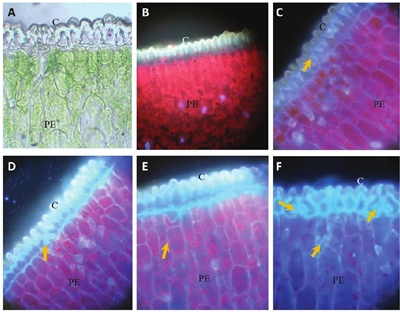
Figura 4 Fotomicrografías de secciones transversales en hojas de agave asperjadas con el fertilizante 4-17-17 con el calcofluor. A= sección de hoja sin aplicación del fertilizante observada con microscopio de luz; cutícula (C), parénquima en empalizada (PE). B= sección de hoja sin aplicación del fertilizante observada con microscopio de fluorescencia; cutícula (C), parénquima en empalizada (PE). C= Las flechas señalan la fluorescencia donde la solución fertilizante más calcofluor se encuentra a 30 min, cutícula (C), parénquima en empalizada (PE). D= a 60 min; cutícula (C), parénquima en empalizada (PE). E= a 90 min; cutícula (C), parénquima en empalizada (PE). F= a 120 min después de la aplicación; cutícula (C), parénquima en empalizada (PE).
Los estomas se encuentran tanto en el haz como en el envés de la hoja y los haces vasculares de mayor tamaño se encuentran en la porción central del mesófilo, mientras que los de menor tamaño en el límite interno del parénquima en empalizada. En el parénquima en empalizada se observó la probable presencia de cristales, quizas de oxalato de calcio, en forma de prismas.
Hay diferencias en el grosor de la cutícula, la cual varío en función de una región a otra de la hoja; en la región apical con un valor promedio de 17.1 μm, mientras que en la parte media fue de 19.1μm.
Conclusiones
Se observó penetración de la solución de fertilizante-verde rápido + azul negro de naftol a través de los estomas y posteriormente se visualizó en el parénquima. Con el fertilizante-calcofluor se observó penetración de la solución, ya que se tiñe prácticamente la cutícula, los estomas, la epidermis, las células en empalizada y las células del parénquima esponjoso.











 texto en
texto en 


