Introducción
Los cultivos genéticamente modificados (GM) son el resultado de un proceso de mejoramiento genético a través del cual se introducen rasgos o características como resistencia a ciertos insectos y tolerancia a herbicida en cultivos comerciales como el algodón (Gossypium hirsutum L.) (Gatehouse, 2008). El algodón Bt comercial presenta la bacteria del suelo (Bacillus thuringiensis) como fuente de toxina insecticida, esta cepa presenta diferentes efectos en su actividad hacia insectos plagas y constituye una reserva de genes que codifican para proteínas insecticidas (Silva, 2005).
Esta tecnología es considerada como un instrumento alternativo para modificar y mejorar los cultivos, especialmente de algodón donde las pérdidas por insectos y malezas son altamente significativas. La implementación de los cultivos (GM) ha traído consigo numerosos beneficios al avance de la agricultura; sin embargo, el desarrollo y comercialización de estos ha sido objeto de un gran debate y de posiciones encontradas (Conner et al., 2003).
Una de las principales preocupaciones es la posible pérdida o reducción de la diversidad asociada a estos cultivos especialmente por el impacto ecológico que pueden causar estas plantas, la preocupación se centra especialmente en la hibridación de los cultivos GM ya que estas pueden invadir a otras especies a través de ciclos repetitivos de hibridación causando su contaminación genética (Singh et al., 2006). Otro riesgo ecológico importante de la liberación de los cultivos transgénicos es el posible efecto negativo que pueda tener sobre los organismos que no son plaga y por el contrario generan beneficios para el cultivo y la agricultura en general por lo que se hace necesario e importante plantear algunas alternativas para minimizar el riesgo de cultivos Bt sobre insectos no blanco (Singh et al. 2006; Wisniewsky et al. 2002).
Cabe anotar que estudios previos no reportan efectos negativos sobre la diversidad de la artropofauna que se encuentra asociada a estos tipos de cultivo. Un buen modelo para analizar efectos negativos de cultivos GM sobre especies no blanco, son los estudios del efecto de maíz GM con tolerancia a insectos lepidópteros sobre la mariposa monarca. Angharad et al. (2002), reportaron una serie de estudios realizados para evaluar rigurosamente el impacto de polen de maíz GM sobre larvas de mariposa monarca para cuantificar riesgo. Los resultados mostraron que el cultivo a gran escala de híbridos de maíz Bt no produce gran riesgo para las mariposas monarcas.
En este contexto Colombia, no es ajena a esta problemática la cual se enmarca en un componente biológico y social complejo debido al impacto sobre la diversidad que estaría reflejado en la disminución de la comunidad de artrópodos benéficos asociados al cultivo. De esta manera se esperaría poder determinar el impacto sobre la artrópofauna asociada al algodonero transgénico con relación al convencional. En este trabajo se evaluó la artropofauna en agroecosistemas de algodonero transgénico y convencional para establecer si existen diferencias en la diversidad de la artropofauna cuando se implementa esta tecnología.
Materiales y métodos
Sitio de estudio
El estudio se llevó a cabo durante la temporada algodonera en el periodo comprendido entre octubre de 2013 a marzo de 2014 en los municipios de Cereté (8°53’11” N y 76°12’35” W) y San Pelayo (8°75’39” N y 76°09’51” W) del departamento de Córdoba-Colombia. Esta región presenta una época de lluvias que van de mayo a noviembre y una época seca que va de diciembre-abril, con una temperatura anual promedio de 28°C, precipitaciones de 1 380 mm, evapotranspiración potencial de 1 240 y con una humedad relativa promedio de 81%.
Toma de datos
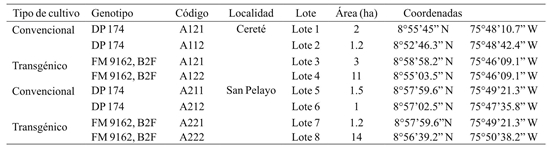
Se colectaron artrópodos en lotes comerciales de algodón Bt y convencional en los municipios de Cereté y San Pelayo. El material vegetal evaluado fue: (1) línea isogénica (DP 174) tolerante al glifosato y (2) un genotipo con tecnología Bt (FM 9162 B2F). en cada localidad se dispuso de cuatro lotes (Cuadro 1).
Muestreo
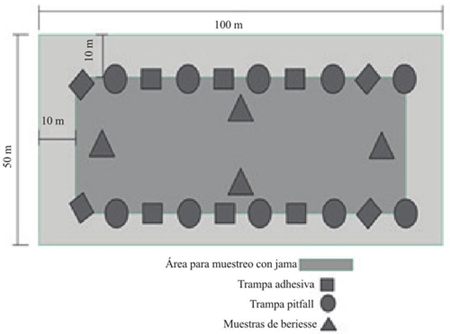
En cada lote se implementaron cinco métodos de muestreo acorde al micro hábitat (Figura 1), para la artropofauna del suelo se utilizó el método de Berlesse y Pitfall. En el primer método la muestra se tomó en cuatro sitios de muestreos para cada lote, con un barreno tipo “Cup Cutter” con capacidad para extraer 1 500 g de suelo y profundizar uno 20 cm, luego se llevaron a los embudos Berlesse por 24 h, las trampas Pitfall se ubicaron en diez puntos sobre el surco y entre plantas, este método consistió en instalar a nivel del suelo un vaso plástico de 12 onzas perforado, que se fijó durante todo el ciclo del cultivo y que correspondió a la base de la trampa Pitfall. Dentro de esta base se colocó un vaso de 3.5 onzas; las colectas se iniciaron a los siete días después de emergido el cultivo (DEC), a las 24 h después de instaladas las trampas, durante 15 días consecutivos (Secretaría del Convenio sobre la Diversidad Biológica, 2000).
Para la captura de artrópodos aéreos y en estratos herbáceos se utilizaron redes entomológicas, trampas adhesivas y trampas de luz. Para el muestreo con redes entomológicas se escogieron aleatoriamente 10 puntos en cada lote, en los cuales se realizaron diez pases dobles de jama (pdj); esto se repitió semanalmente hasta que el cultivo alcanzó una altura promedio de 1.5 m. En las trampas adhesivas se utilizaron placas plásticas amarillas (PPA) de dimensiones 20*10 cm y con cuadriculas de 2 cm2 fijadas en una vara de madera de 2.2 m de longitud, como adhesivo se untó grasa mecánica. Estas trampas adhesivas se ubicaron en diez puntos en cada lote a la altura del cultivo a partir de los siete días después de la emergencia. Por último, se instalaron en cada localidad una trampa de luz, las lecturas se realizaron durante siete días consecutivos por mes durante el desarrollo del cultivo.
Identificación del material biológico
Las muestras colectadas fueron llevadas al laboratorio en bolsas plásticas, debidamente selladas y rotuladas, donde fueron identificadas hasta la categoría taxonómica más específica posible con ayuda del estereoscopio (Advanced optical JSZ6S con cámara incorporada Infinity 1) y utilizando claves taxonómicas (CSIRO, 1970; McAlpine et al. 1981; Borror y White, 1998; McGavin 2001; Triplehorn y Johnson, 2005; Fernández y Sharkey 2006). El material biológico fue preservado en seco de acuerdo a la naturaleza de los ejemplares y se encuentran disponibles en colecciones del laboratorio de entomología de la universidad de Córdoba.
Análisis de datos
El análisis de la diversidad de artrópodos se realizó utilizando el método propuesto por Jost (2006), mediante los números efectivos de especies, este análisis permite evaluar directamente la magnitud de cambio entre las comunidades estudiadas y expresarla en términos del número real de especies. La diversidad y el grado de recambio de especies reales se calculó a través de tres valores de q= 0, 1 y 2, utilizando el paquete iNEXT según Chao y Jost (2012). El valor q= 0 es la diversidad de orden cero (0D), donde no se consideran las abundancias de las especies, por lo que equivale a la riqueza de especies, q= 1 es la diversidad (1D), donde todas las especies son incluidas con un peso proporcional a su abundancia en el ensamblaje, siendo el índice de diversidad (1D) el exponencial del índice de entropía de Shannon y q= 2 es la diversidad (2D), que es el inverso del índice de Simpson, que tiene en cuenta a las especies dominantes y excluye a las raras de acuerdo al estudio propuesto por Jost (2006); Moreno et al. (2011).
La completitud del muestreo se estimó mediante el análisis de coberturas estandarizadas de las muestras (IC= 95%), utilizando el paquete iNEXT. Este análisis permite obtener estimaciones de riqueza a través del número de individuos colectados teniendo en cuenta el porcentaje de error o déficit de cobertura, se generaron intervalos de confianza al 95% (Chao y Jost, 2012). Se construyeron curvas de rango-abundancia o curvas de Whittaker según Magurran (1998); Feinsinger (2003), en las que se usó el número de especies y de individuos por especie registrados en cada tipo de cultivo. La curva se graficó de acuerdo con el logaritmo de las abundancias observadas y los datos se ordenaron desde la especie más abundante a la menos abundante. Se realizaron las pruebas de comparación de muestras independientes T-student y Mann-Whitney U para verificar si existe una diferencia entre la diversidad de especies y los tipos de cultivos.
Resultados y discusión
Se recolectaron 23 787 individuos durante la fase de muestreo, en total se registraron 240 taxones agrupados en 25 especies y 215 morfoespecies (4 identificadas hasta orden, 151 hasta familia y 60 hasta género). Para el cultivo transgénico se registró el mayor número de individuos con 12 286 (51.7%), registrando 237 taxones agrupados en 25 especies y 212 morfoespecies, para el cultivo convencional 11 501 individuos (48.3%) registrando 240 taxones agrupados en 25 especies y 215 morfoespecies. Entre los órdenes más abundantes se encuentra hemiptera representando el mayor número con 6 241 individuos, siendo 50.8% para el cultivo transgénico (CT) y para el cultivo convencional (CC) 5 513 individuos con 47.9%, seguido por el orden coleoptera con 1 660 individuos para 13.8% CT y 1591 siendo 13.5% en CC, seguido del orden hymenoptera con 1 224 individuos, lo que equivale a 10.2% para (CT) y 1174 individuos; es decir, 10% en CC, finalmente el orden diptera registro 9.5% con 1 168 individuos en CT y 9.5% con 1 093 individuos en el CC.
En cuanto a la riqueza el orden coleoptera registró 22 familias (20%), siendo el grupo que evidenció la mayor riqueza. De esta manera la artropofauna estuvo representada en su mayoría por los grupos considerados más importantes que fueron coleópteros, hemípteros, dípteros, himenópteros, arácnidos, y lepidópteros. La diversidad entre el cultivo convencional y transgénico no fue diferente, la abundancia y riqueza de especies no mostraron diferencias significativas entre los dos tipos de cultivo, lo que coincide con lo reportado por Almada et al. (2011) al comparar la comunidad de arañas en cultivos de algodón Bt y convencional en el norte de Santa Fe (Argentina), no se observaron diferencias significativas entre los cultivos, solo la abundancia de arañas se incrementó en los cultivos Bt, lo que podría indicar que estos cultivos no afectaron a la población de arañas.
La alta abundancia y riqueza reportada en este estudio se pudo deber a que el cultivo de algodón tanto el convencional como el transgénico proporcionan condiciones que favorecen al establecimiento de artrópodos, teniendo en cuenta que las variaciones que se producen estarían influenciadas por la etapa del desarrollo fenológico del cultivo, las pequeñas diferencias que se evidenciaron entre los dos tipos de cultivos siendo el cultivo transgénico quien tuvo mayor abundancia se puede atribuir al menor uso de insecticidas y herbicidas comparados con el cultivo convencional, hecho que favorece a la diversidad de artrópodos en su desarrollo y comportamiento natural en el cultivo transgénico, lo que coincide con los reportados por diversos autores (Novillo et al., 1999; Durán et al., 2000; Pérez-Guerrero et al., 2009; Benamú, 2010), quienes argumentan que la aplicación de insecticidas para el caso del cultivo convencional ejerce un efecto negativo sobre la disminución de la diversidad en poblaciones de artrópodos.
De acuerdo al comportamiento y hábitos alimenticios de los artrópodos presentes durante el desarrollo fenológico del cultivo, teniendo en cuenta el número de familias presentes en los dos tipos de cultivo solo se graficó las más abundantes y se observó que en ambos cultivos se expresaron de igual manera, aunque sus valores fueron diferentes, es por ello que se realizó una agrupación teniendo en cuenta el hábito alimenticio (fitófago, predador y parasitoide) se hace limitado a unas pocas familias , siendo las más comunes: Aleyrodidae, Thripidae, Cicadellidae, Aphididae, Chrysomelidae, y Agromizidae para el grupo de fitófagos, se observó una marcada diferencia entre las familias representadas en cuanto a la abundancia, siendo la más representativa la familia Aleyrodidae en ambos agroecosistemas. La prueba de Mann-Whitney no mostró diferencias significativas entre la diversidad de familias y el tipo de material genético (U= 188, p= 0.7453).
En cuanto al grupo de predadores la abundancia fue mayor en el cultivo transgénico, y en ambos agroecosistema se observó a las familias Formicidae, Coccinellidae, Anthocoridae, Carabidae, Staphylinidae y Syrphidae, siendo la más representativa la familia Formicidae por presentar 881 individuos; es decir, 7.7% para el cultivo convencional y para el cultivo transgénico 969 individuos lo que equivale al 7.9%. Esto se puede relacionar con el tipo de acción que los predadores ejercen sobre sus presas (fitófagos) y a la simbiosis que pueden compartir, caso de muchas especies que excretan exudados que atraen a las hormigas y que ellas a su vez le brindan protección de otras especies predadoras, en cuanto a estos resultados se puede inferir que el cultivo transgénico, dependiendo de la estrategia de manejo que se implemente ofrece una mayor variedad y disponibilidad de recursos, lo que coincide con lo reportado por Almada et al. (2011). La prueba de Mann-Whitney no mostró diferencias significativas entre la diversidad de familias y el tipo de cultivo (U= 156, p= 0.8494).
Para el grupo de los parasitoides las familias Eulophidae, Braconidae y Scelionidae presentaron la mayor abundancia en ambos cultivos, con valores más altos en el cultivo convencional en comparación con el transgénico. La prueba de t-Student no mostró diferencias significativas entre la diversidad de familias y el tipo de cultivo (t-value= 1.6394; p= 0.1153), podemos decir que este comportamiento se debe al número de hospederos que se encuentran asociados al cultivo y por la disponibilidad de presas en cada uno, la presencia de los parasitoides puede estar ligada al complejo lepidóptera, agrupado dentro de los principales fitófagos a los cuales va dirigida la tecnología Bt, notando que los predadores se mantuvieron similares para ambos cultivos; lo que coincide con estudios realizado por Lobos et al. (2003), en donde argumenta que esta tendencia puede estar influenciada por la ecología nutricional, atributos biológicos como especificidad y estacionalidad, características del agroecosistema, particularidades de sus huéspedes y presas de preferencia.
Lo que también es respaldado por varios autores que en sus investigaciones afirman que las variedades transgénicas de algodón que producen toxinas del B. thuringiensis, tienen atributos insecticidas que pueden además de afectar a las poblaciones de las plagas objetivo de esta tecnología, influir en la dinámica de la fauna benéfica que se encuentra asociada, tal es el caso de muchos benéficos como los predadores y parasitoides a quienes se ha atribuido importancia en el control de los fitófagos asociados al cultivo considerados plagas (Novillo et al., 1999; Durán et al., 2000; Pérez-Guerrero et al., 2009; Benamú, 2010).
La marcada diferencia en cuanto al número de individuos pertenecientes a grupos considerados como beneficiosos en el cultivo transgénico con relación al convencional nos permite creer que los cultivos genéticamente modificados favorecen la diversidad de la atropofauna fomentando una gran disminución de las aplicaciones de insecticidas y evitando la aparición de nuevas plagas que se desarrollan bajo algunas condiciones actuales lo que coincide con Whitehouse et al. (2005) al comparar comunidades entre cultivos Bt y convencionales, demuestra que los cultivos Bt generan efectos indirectos debido a la reducción de aplicaciones de insecticida de amplio espectro que permiten la presencia de enemigos naturales y estos controlan las plagas que puedan aparecer. Estudios propuestos afirman que la reducción de insecticidas favorece la diversidad de artrópodos y el mantenimiento de una distribución más uniforme de especies, también reportan que una mayor abundancia y riqueza de especies asociadas al cultivo depende en gran medida de la estructura de la vegetación y de la que se encuentra alrededor (Romeis et al., 2004).
En cuanto a la riqueza de familias presentes en los dos tipos de cultivo la familia Formicidae fue la más representativa, seguida de Chrysomelidae, Cicadellidae y Coccinellidae con mayor número de géneros, caso contrario de las familias Agromyzidae, Aleyrodidae y Anthocoridae siendo las de menor riqueza.
Al ordenar las especies por su abundancia en cada cultivo y comparar el grupo de los fitófagos los géneros Bemisia y Frankliniella fueron los que predominaron para ambos cultivos, mientras que el género aphis presentó mayor número de individuos en el cultivo transgénico, siendo menor para el convencional, lo que en parte se puede explicar por el menor uso de insecticidas en el cultivo con tecnología transgénica. La prueba de Mann-Whitney no mostró diferencias significativas entre la diversidad de géneros y el tipo de cultivo (U= 638.00 p= 0.9103).
Para el grupo de los predadores los géneros en su mayoría presentaron actividad sobre el cultivo con valores de abundancia representativos para ambos (CC y CT) siendo el caso de sthetorus, solenopsis, brachimirmex, paratrechina, dorymyrmex y orius. La prueba de Mann-Whitney, no mostró diferencias significativas entre la diversidad de géneros y el tipo de cultivo (U= 442.5, p= 0.5926). Para el grupo de los parasitoides se evidencia que los géneros telenomus y architas presentaron mayor abundancia en el cultivo convencional, caso contrario para euplectrus y casinaria cuya abundancia se vio reflejada con valores más altos en el cultivo transgénico. La prueba de t-Student no mostró diferencias significativas entre la diversidad de géneros y el tipo de cultivo (t-value= 2.4019, p= 0.5315).
Al analizar la comunidad de artrópodos presentes para los dos tipos de cultivo; convencional y transgénico mediante las curvas de rango-abundancia (Figura 2), en general se observa que la pendiente de las gráficas indican una tendencia entre las especies, las curvas estuvieron dominadas por las más comunes para el agroecosistema algodón como es el caso de Bemisia tabaci, Frankliniella occidentalis, Sthetorus sp., Aphis gossypi, Brachimirmex sp. y Solenopsis sp., que por lo general se encuentran en agregaciones características de sus grupos; las cuales fueron reportadas como abundantes en un estudio realizado por Sosa et al. (2015). En su trabajo sobre la diversidad de una comunidad de artrópodos en variedades de algodón transgénico, por medio del cual se concluye que los cultivos de algodón Bt y convencional albergan artrópodos sin expresar diferencias en la comunidad de estos.
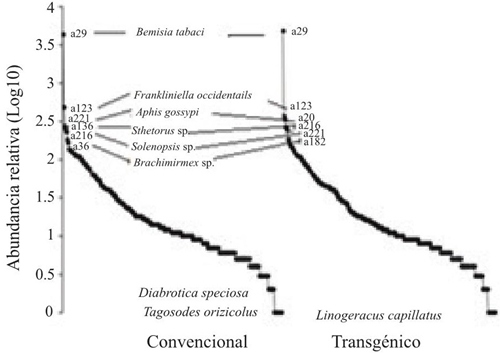
Figura 2 Curvas de rango abundancia de artrópodos capturados en cultivos de algodón los dos tipos de cultivo convencional y transgénico. Córdoba- Colombia, 2013-2014.
Para el caso de Bemisia tabaci, y Aphis gossypi por ser insectos gregarios y además por el crecimiento de sus poblaciones con una tendencia exponencial tienden a ser capturados en grandes cantidades de individuos, estos resultados van de la mano a los reportados por Carapia et al. (2013). Estudio en el cual se afirma que estas agregaciones pueden encontrarse por muchos factores como lluvias, temperaturas altas o bajas, humedad relativa, y también a efectos relacionados con la ecología del insecto. Por otra parte, la mayor abundancia de A. gossypi se puede ver influenciada por la presencia de orugas que se alimentan de estructuras de la planta lo que induce a la producción de terpenoides (Sosa et al., 2015).
Por su parte las hormigas Brachimirmex sp. y Solenopsis sp. fueron muy abundantes ya que ellas generalmente se encuentran en colonias y están estrechamente relacionadas con la vegetación del lugar, en este caso con el cultivo de algodón por alimentación o refugio, resultados que se asemejan a los descritos por Casanova (2014), quien indica que las hormigas pueden ser benéficas al consumir semillas de malezas que pueden afectar al cultivo y también consideradas como bioindicadores de la calidad ambiental de la evaluación del estado ecológico de los ecosistemas (Sosa et al., 2015).
Las especies raras o poco comunes representadas en la Figura 2, reportaron para el cultivo convencional dos especies Diabrotica speciosa y Tagosodes orizicolus y una para el cultivo transgénico Linogeraus capillatus, lo que pudo ser ocasionado por el impacto de las actividades humanas afectando la dinámica poblacional de las comunidades y la viabilidad de las poblaciones. Tapia et al. (2010) refiere, que en su estudio resalta la biología de especies raras se puede presentar a través del bajo tamaño poblacional y el impacto de las actividades humanas.
El análisis de completitud (Figura 3) por el método de la cobertura de la muestra por lotes arrojó para el cultivo convencional un valor de riqueza de S= 218 con un déficit de cobertura (DC) de 9.76 para el lote 1, para los lotes 2, 5 y 6 fueron de S= 181, DC= 10.37; S= 185, DC= 6.72; S= 194, DC= 9.09 respectivamente. Con relación a los lotes para el cultivo transgénico se obtuvo un estimativo de riqueza de S= 185 con un DC de 8.72 para el lote 3, y S= 183 con DC de 10.2 para el lote 4, para los lotes 7 y 8 los valores de riqueza obtenidos fueron de S= 198, DC= 7.58; S= 174, DC = 8.47 respectivamente.
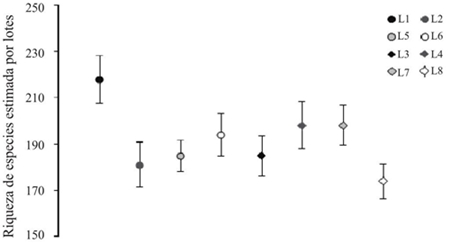
Figura 3 Análisis de completitud para los tipos de cultivos estudiados por lotes. (riqueza estimada 95%, ICcobertura de la muestra= 0.95).
La diversidad de especies para el cultivo convencional y transgénico (Figura 4) representa la misma tendencia al ser analizada la riqueza por medio de la diversidad alfa verdadera tipo 1D, presentada por la riqueza de especies (0D), con un mayor número de especies efectivas en el cultivo convencional (1D= 36.39) comparado con el transgénico (1D= 33.39). Teniendo en cuenta los valores obtenidos en los diferentes órdenes de diversidad, para el orden 2D se obtuvieron valores de (6.81) para el cultivo convencional y de (6.31) para el cultivo transgénico, con base a estos resultados no se evidencian diferencias con relación a los tres perfiles de diversidad entre los cultivos convencional y transgénico.
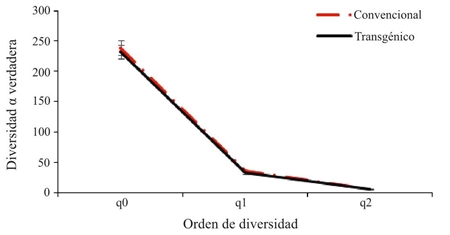
Figura 4 Perfiles de diversidad alfa verdadera para los artrópodos del cultivo de algodón convencional y transgénico, en Córdoba- Colombia.
Teniendo en cuenta el grado de cambio o reemplazo en la composición de especies entre los dos tipos de agroecosistemas (Figura 5), entre ambos se presentó un valor 1.013 con q= 0. Para la diversidad beta de orden q= 1 y q= 2 fue de 1.001 comunidades efectivas. Estos resultados evidenciaron que no existen diferencias entre las especies efectivas de los dos tipos de agroecosistemas debido a que los valores son muy cercanos a 1, presentándose una similitud de las comunidades.
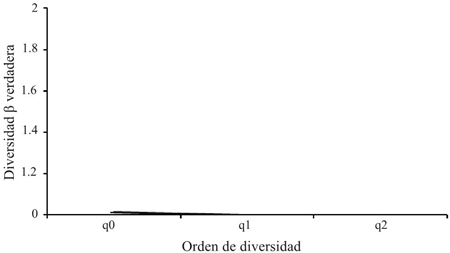
Figura 5 Perfil de diversidad beta verdadera para los artrópodos del cultivo convencional y transgénico en Córdoba-Colombia.
En cuanto al análisis de diversidad verdadera alfa y beta estos indicadores mostraron valores que no difieren significativamente entre los dos tipos de cultivo, lo que indica que para este estudio la diversidad de la artropofauna en cultivos de algodón convencional y transgénico no es diferente. Resultados que al ser comparados con otros estudios como el realizado por (Pilcher et al., 1997; Riddick et al., 1998; Armer et al., 2000) demuestran que las especies modificadas que contienen la proteína Bt son altamente selectivas y no se han encontrado efectos en la supervivencia, desarrollo y alimentación de especies de artrópodos no objetivo. Lo que contrasta con lo propuesto en estudios realizados por Hilbeck et al. (1999); Romeis et al. (2004); De Andow y Zwahlen (2006) quienes sugieren que la exposición por largo tiempo de estos organismos podría afectar la biodiversidad del suelo y en general a la funcionalidad ecológica de este ya que la toxina llega a los artrópodos por medio de los exudados de las raíces.
En estudios enfocados en el riesgo que puede provocar el uso de plantas transgénicas sobre la diversidad de especies de artrópodos asociadas a los cultivos realizados por Armer et al. (2000) no se reportaron efectos negativos, de igual forma en este estudio los resultados obtenidos coinciden con lo citado anteriormente, muchas de las especies al no tener una asociación directa con la planta no se ven afectadas, pero al tratar de hacer una generalización acerca de que este tipo de plantas no presenta algún efecto sobre los grupos de artrópodos que se encuentran asociados es muy arriesgada.
Conclusiones
En el presente estudio la diversidad de la artropofauna asociada al agroecosistema algodón entre el cultivo convencional y transgénico no fue diferente, no se evidenció diferencias entre las poblaciones de artrópodos en el cultivo transgénico con respecto al convencional. Las pequeñas diferencias que se presentaron no se atribuyen al uso del transgénico, es posible que existan factores externos que puedan influenciar en la dinámica de los artrópodos, como el control químico que se realiza durante el desarrollo del cultivo, a fin de llevar a niveles de baja importancia económica la incidencia de artrópodos y arvenses.











 texto en
texto en