Introducción
A nivel mundial y nacional, el cultivo de maíz ocupa el primer lugar en superficie sembrada (FAO, 2015). El Departamento de Agricultura de Estados Unidos (USDA) en junio de 2015 estimó una producción mundial de 989.3 millones de toneladas. México se encuentra en el séptimo lugar con una producción de 2.3% (USDA, 2015). El estado de Guanajuato cuenta con una gran superficie para la producción de grano de maíz; sin embargo, el estado es considerado como una región semiárida con graves problemas de falta de agua; cabe mencionar que de las 370 742 ha que se han sembrado con anterioridad, 68.23% es de temporal y 31.77% de riego (SIAP, 2015).
La importancia del maíz es que el consumo per capita en el país es de 330 g día-1, con una aportación a la nutrición de 32 a 55% de proteína. El maíz en el sector rural aporta a la nutrición 65% de las calorías, 53% de las proteínas, 69% de calcio, 51% de hierro, 15% de vitamina A, 62% de la tiamina, 36% de riboflavina y 54% de niacina (SAGARPA, 2014). La proteína del maíz, y en general la de los cereales, es de bajo valor nutricional cuando se compara con la proteína de origen animal. Esta deficiencia es el resultado de un desbalance de aminoácidos y de un bajo contenido proteico (Azevedo et al., 2006). En el maíz la mayor cantidad de proteína (75 a 85%) se encuentra en el endospermo y es deficiente en dos aminoácidos esenciales lisina y triptófano (Huang et al., 2004). Los maíces de alta calidad proteica (QPM) son cultivares portadores del gen opaco-2, que promueve una reducción del contenido de zeína e incremento de la glutelina. Llegan a duplicar las cantidades de lisina y triptófano, y lo convierte en maíz con valor nutritivo superior al maíz convencional (Ortega et al., 1986).
En este sentido se plantea a la germinación de maíz como un método simple y de bajo costo para mejorar la calidad de la materia proteica y el valor nutrimental del grano, ya que en las primeras etapas de la germinación del maíz la concentración de lisina y triptófano aumentan considerablemente. En el maíz germinado existe 19% de aumento en la concentración de lisina y triptófano, y una modificación general de su composición química durante el proceso de germinación del grano (Arámbula, 2015).
En México, los forrajes constituyen aproximadamente 50% de la ración total de la alimentación del ganado. En este rubro existen mejores posibilidades de disminuir los costos de producción, mediante la utilización de forrajes más productivos y de mayor calidad. Una buena alternativa para México es el cultivo de forrajes verdes hidropónicos de maíz. En lo que se refiere al forraje se requiere que tenga buena calidad para ensilaje, aquí interviene el contenido de fibra detergente neutro (FDN), para ello es necesario conocer cuál es la etapa ideal para su corte (Herrera y Saldaña, 1999).
Por lo anterior, la identificación de la calidad nutricional del grano y del forraje en programas de mejoramiento, requieren del análisis integral de métodos rápidos y confiables que permitan comparar parámetros adecuados en el mayor número de muestras posibles. Entre los parámetros que pueden medir el valor nutricional del maíz, destacan la calidad de la proteína (Poey, 1978), razón por la cual la importancia del análisis bromatológico. Esta información permitiría contar con la máxima información, para establecer posibles criterios de selección. Con respecto al forraje es necesario realizar un análisis proximal, el cual auxiliará en el contenido nutricional que este contenga.
Por otra parte, Llanos (1984) señala que casi todas las plantas forrajeras se cultivan exclusivamente para aprovechar sus tallos y hojas, mientras que sus semillas suelen carecer de valor nutritivo que justifique su aprovechamiento. El maíz para forraje es una excepción, sobre todo los cultivares que alcanzan el máximo rendimiento en carbohidratos después que florecen. Además, cuando el grano está en estado lechoso, las hojas y tallos están todavía verdes y la planta completa tiene entonces un alto valor nutritivo para el ganado.
En respuesta a los altos costos de la alimentación de los animales, utilizados para la producción de carne y leche, se han evaluado nuevas técnicas de alimentación a bajo costo y con alto valor nutricional como es el uso de hidroponía. Es una tecnología de producción de biomasa vegetal obtenida del crecimiento inicial de las plantas mediante la germinación a partir de semillas viables y por su lapso de tiempo no mayor a los 16 días. Además, el uso de hidroponía o la producción del forraje verde hidropónico (FVH) tienen la ventaja de poder obtenerse en cualquier época del año y en cualquier localidad geográfica, el FVH podría resolver el problema del alto costo de la alimentación, la cual representa el 70% de los costos en la producción animal (Less, 1983).
El maíz presenta la mayor tasa de conversión a carne, leche y huevos, debido a su alto contenido en almidón y baja concentración de fibra, constituye una excelente fuente de energía. En países tropicales, en promedio se destina el mismo porcentaje (44%) para forraje que para consumo humano. Generalmente se prefiere el grano entero o molido de maíz amarillo para alimentar ganado (Paliwal, 2001).
El forraje verde hidropónico es una tecnología de producción de biomasa vegetal obtenida a partir del crecimiento inicial de las plantas en los estados de germinación y crecimiento temprano de plántulas a partir de semillas viables. El forraje obtenido es de alta digestibilidad, calidad nutricional y muy apto para la alimentación animal (Palomino, 2008).
El forraje verde hidropónico es el resultado del proceso de germinación de granos de cereales o leguminosas (cebada, maíz, sorgo, soya, etc) el cual se desarrolla en un periodo de 9 a 15 días, captando energía del sol y asimilando los minerales disueltos en una solución nutritiva. El forraje hidropónico está comprendido dentro de un concepto nuevo de producción, ya que no requiere grandes extensiones de tierra, periodos largos de producción ni formas de conservación y almacenamiento. Este forraje es destinado para la alimentación de vacas lecheras, caballos de paso y de carrera, cuyos, ovinos, etc (Tarrillo, 2007).
Una alternativa es la producción de FVH que permitan prevenir pérdidas productivas (abortos, pérdida de peso, escaso volumen de leche, problemas de fertilidad) especialmente a nivel de los pequeños productores (FAO, 2001). Se ha demostrado que es posible sustituir parcialmente la materia seca que aporta el forraje obtenido mediante métodos convencionales, así como también aquél proveniente de granos secos o alimentos concentrados, por su equivalente en FVH. Se ha reportado que los establos lecheros que suministran alrededor de 18 a 20 kilos de FVH por cabeza, han incrementado su producción de leche de 10 a 12.5 %, la fertilidad, han disminuido la incidencia de mastitis y reducido el índice de abortos, han disminuido también el costo de alimentación por cabeza (Rodríguez, 2003).
En el sistema de producción de FVH las pérdidas de agua por evapotranspiración, escurrimiento superficial e infiltración son mínimas al compararse con las condiciones de producción convencional en especies forrajeras, cuyas eficiencias varían entre 270 a 635 litros de agua por kg de materia seca. Para la producción de 1 kilo de FVH se requiere de 2 a 3 litros de agua con un porcentaje de materia seca que oscila, dependiendo de la especie forrajera y la variedad, entre un 12 a 18% (Lomeli, 2000). Esto se traduce en un consumo total de 15 a 20 litros de agua por kilogramo de materia seca obtenida en 14 días.
En este sentido, Mendoza et al. (2007) mencionan que en México existe una gran diversidad genética de maíz, y los diversos programas de mejoramiento nacional e internacional constantemente liberan materiales. No obstante, el valor agregado de la proteína no se ha considerado hasta hoy como de impacto a la nutrición. Por lo tanto, es necesario realizar estudios con respecto a la calidad de forraje debido a que la lisina y el triptófano son los aminoácidos limitantes en la calidad de proteína. Además sí consideramos, que en las dietas de los bovinos y otros animales se considera la proteína de soya que tiene alto costo, con el maíz QPM se resuelve parte de la situación proteica y económica, ya que el costo del maíz con alto contenido de proteína tiene el mismo valor comercial que el grano común.
Por lo anterior, el objetivo de esta investigación fue determinar a través de muestreos en el germinado-plántula, los cambios importantes que existen de lisina, triptófano, proteína y rendimiento en maíz normal y maíz QPM.
Materiales y métodos
El presente trabajo experimental se llevó a cabo en el Centro de Investigación de Estudios Avanzados (CINVESTAV) Unidad Querétaro, ubicado en Juriquilla, Querétaro y en el laboratorio de biotecnología del Instituto Tecnológico de Roque, ubicado en Celaya, Guanajuato. Se utilizaron dos genotipos de maíz: como normal, a) criollo tipo occidental (grano rojo), altura de planta 3.6 m, madurez fisiológica 132 días, con 12 hileras por mazorca del Instituto Tecnológico de Roque (ITR) y b) híbrido QPM (maíz de alto contenido de proteína, grano blanco) del programa de maíz del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP) Campo Experimental Bajío ubicado en Celaya, Guanajuato.
La producción de forraje verde se realizó de acuerdo al método reportado por la Organización de las Naciones Unidas para la Agricultura y la Alimentación FAO (2001), con algunas modificaciones (se regaron las plántulas de 4 a 6 veces por día dependiendo del clima, el primer riego fue a las 8:00 am y el último riego a las 4:00 pm. Si el clima era muy caluroso, se aplicaron hasta 6 riegos).
Previamente se realizó una prueba de germinación obteniendo para el genotipo de maíz Criollo 96%, mientras que para el genotipo de maíz QPM fue de 94%.
Se trabajó con una densidad depoblación de 300 g de semilla/charola (0.53 m*0.27 m), se distribuyeron en bandejas de plástico para ambos genotipos de maíz evaluados maíz (QPM y normal o criollo). Las bandejas se colocaron en estantes y se aplicó riego continuo con agua de garrafón durante los primeros nueve días de crecimiento a razón de 4.2 L m-2. Para medir las variables de estudio se realizaron diferentes muestreos, el primero fue a los 9, luego a los 11, 13. 15 y 17 días después de la siembra en ambos genotipos.
Se evaluaron algunos componentes del peso fresco, como, altura de plántula, esta se evaluó midiendo de la base de la plántula hasta el ápice del brote vegetativo. En cada tratamiento se identificaron seis plantas, su altura se expresó en mm, la lectura fue cada dos días hasta el día 17 de crecimiento. El diámetro del tallo se midió al azar con un vernier los diámetros de 6 plantas en mm. El número total de hojas se contabilizaron desde el inicio del tallo principal hasta el quinto muestreo (9, 11, 13, 15, y 17 días). También se registró el peso fresco total de las plántulas en gramos, a partir del día nueve hasta el día 17.
Para determinar el porciento de materia seca (MS) se tomó porciones de 250-350 g de forraje verde por bandeja y se introdujeron en una bolsa de papel previamente pesada. Luego, se colocaron las muestras en una estufa de aire forzado a 60 ºC durante 72 horas. Transcurridos tres días, se pesaron las muestras y se les restó el peso de la bolsa para obtener el peso seco neto. Finalmente, la variable fue calculada mediante la siguiente fórmula: % MS= peso seco neto peso fresco ∗. El rendimiento de biomasa, fue la relación kg de forraje producido/kg de semilla utilizada, se obtuvo al dividir el peso neto de FV por bandeja entre la cantidad de semilla utilizada por bandeja (0.3 kg), ambos datos expresados en kg.
La fórmula utilizada fue kg FV/kg semilla= kg FV fresco por charola /0.3 kg. El rendimiento de biomasa en fresco (kg peso fresco/m2), correspondió a la producción (kg) de FV fresco, obtenido en 1 m2. Se calculó mediante la división del peso neto de material por bandeja entre el área del recipiente (0.53 m*0.27 m= 0.1431 m2); es decir; biomasa en fresco= kg FV por bandeja/0.1431 m2 y la biomasa seca (kg peso seco m-2), se refirió al peso seco (kg) de FV producido en 1 m2. Se obtuvo mediante la multiplicación de la biomasa en fresco por % de MS. Es decir: biomasa seca= biomasa fresca (kg peso fresco/m2)*(%) (MS/100).
Los análisis químicos proximales se hicieron sobre los productos terminados con las siguientes técnicas: para proteína se utilizó la 46-16 (AACC, 1995), grasa, 30-20 (AACC, 1995), humedad, 40-16 (AACC, 1995), cenizas, la 08-01 (AACC, 1995).
La determinación de triptófano fue por el método Opienska-Blauth modificado por Hernández y Bates (1969); Hartcamp et al. (2000). La muestra de malla 80 desgrasada y pulverizada se mezcló con una solución de papaína, se incubó por 16 h a 63 ±2 oC, se enfrió y centrifugó a 2 500 rpm por 5 m., se transfirió 1 mL de hidrolizado en una solución de cloruro férrico y ácido sulfúrico, posteriormente se incubo a la temperatura anterior, se dejó enfriar y se tomó lectura a 560 nm para calcular con base a una curva estándar la cantidad de triptófano, respecto a la proteína.
La lisina fue analizada por el método de Tsai et al. (1975), y modificado por Villegas (1984). El procedimiento consistió en preparar una muestra hidrolizada de maíz con papaína a 65 ±2 oC durante 16 h, una vez fría la muestra, pipetear 1 mL en una solución de carbonato y fosfato de cobre, se agitó por 5 in y se centrifugó a 2 000 rpm por 5 min, se tomó 1 mL del sobrenadante para mezclar con 0.1 mL de solución de 2 cloro-3,5 dinitropiridina. Enseguida se agitó fuertemente, se dejó reposar por 2 h, agitando cada 30 min, se agregó ácido clorhídrico y se agito nuevamente hasta homogenizar. Posteriormente se agregó solución extractora de acetato de etilo, se mezcló por inversión durante 10 veces y se extrajo la fase superior, repitiendo tres veces, se tomó lectura a 390 nm contra un blanco, enseguida se calculó el contenido de lisina con base a una curva estándar para reportarlo de acuerdo a la proteína estimada.
El análisis estadístico de los resultados se realizó con el paquete estadístico SAS versión 9.0, donde los datos se sometieron a un análisis de varianza con un diseño estadístico completamente al azar con arreglo factorial, siendo el factor A las variedades de maíz y el factor B, los muestreos de 9, 11, 13, 15, y 17 después de la siembra. La comparación de medias se realizó de acuerdo a la prueba de DMS (p≤ 0.05).
Resultados y discusión
El análisis de varianza mostró diferencias significativas al 1 y 5% de probabilidad en la fuente de variación variedades para las características altura de plántula, diámetro de tallo, peso fresco de plántula, materia seca, y rendimiento de biomasa, excepto número de hoja. Para la fuente muestreos se encontraron diferencias para todas las variables evaluadas; sin embargo, para la interacción existió significancia en la variable ancho de hojas, el resto no fueron significativas. Estas diferencias encontradas en las diferentes variables se atribuyen principalmente a la constitución o diversidad genética que existe entre el maíz QPM y el maíz criollo, además de que los muestreos influyen por la etapa fenológica del cultivo.
El comportamiento de los dos genotipos evaluados se muestra en el Cuadro 1, donde el maíz QPM fue superior en todas las variables, a excepción de la altura de plántula. Esta repuesta se debe a que el cultivar criollo es más precoz; es decir, su velocidad de crecimiento y desarrollo es mucho más rápida, esto se da para definir pronto sus etapas fenológicas.
Cuadro 1 Comparación de medias del rendimiento de forraje verde y sus componentes en condiciones de invernadero en un maíz QPM y criollo en Celaya, Guanajuato, México, 2014.
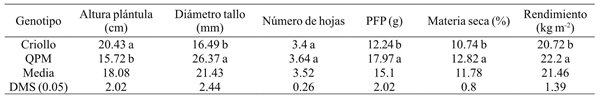
DMS= diferencia mínima significativa. Valores que comparten la misma letra en la misma columna son estadísticamente iguales. PFP= peso fresco de plántula.
Entre los componentes de rendimiento de forraje más importantes se puede destacar la materia seca y el rendimiento de biomasa, aquí se aprecia que el genotipo QPM fue superior para ambas características con valores de 12.82% y 22.2 kg m-2 con respecto al cultivar criollo que arrojo rendimientos de 10.74% y 20.72 kg m-2 y 10.65%, respectivamente. Estos resultados son superiores a los reportados por Vargas (2008) quienes reportan una producción de 17.2 kg con 4 kg de semilla en bandejas de 720 cm2. También Tarrillo (2007) menciona que a partir de 1 kg de semilla se puede producir una masa de forraje de 6 a 8 kg y Elizondo (2005) reporta que de 1 kg de semilla se puede cosechar hasta 9 kg de biomasa.
En el Cuadro 2 se presentan los valores promedios de altura de plántula al corte efectuados a partir de los 9 hasta los 17 días de edad. De acuerdo a la prueba de DMS, el tratamiento T17 alcanzó el mayor valor con 21.76 cm y 27.96 cm en los genotipos QPM y criollo, respectivamente. Para diámetro de tallo, alcanzaron en el último muestreo valores para el maíz criollo de 24.73 mm, mientras que para el genotipo QPM arrojo un promedio de 31.85 mm. Para el número de hojas se registró un promedio de 4.8 en el genotipo criollo, mientras que para el genotipo QPM su promedio fue de 5. De acuerdo con Sheehy y Cooper (1973) el número de hojas y arquitectura foliar varían en las plantas, dentro de la misma especie, así como también entre variedades.
Cuadro 2 Promedio del rendimiento de forraje verde y sus componentes en dos tipos de maíces en condiciones de invernadero en Celaya, Guanajuato, México en 2014.
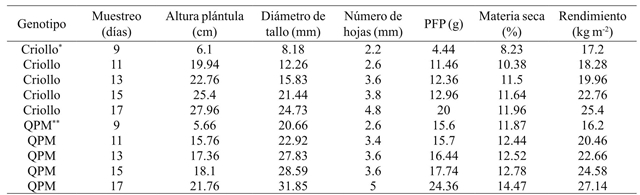
*Criollo= maíz normal; **QPM= maíz de alto contenido de proteína; PFP= peso fresco de plántula.
El número de hojas está directamente relacionado con la eficiencia de intercepción y absorción de radiación fotosintéticamente activa, así como también, con la organización espacial de las hojas y ángulo de inserción foliar (Moreira et al., 2005), por lo que es una variable morfológica importante, ya que es utilizada frecuentemente para los arreglos topológicos en los cultivos, para determinar la densidad de población ideal, para interceptar la máxima radiación solar, y reducir la competencias por luz (Oliveira et al., 2010). En peso fresco de plántula, el genotipo QPM alcanzo un promedio de 24.36 g y el cultivar criollo 20 g.
En materia seca, el genotipo criollo presentó un promedio de 10.74% con respecto al genotipo QPM que fue de 12.82%. El peso seco aumentó conforme avanzó el desarrollo de la plántula, obteniendo mayores valores a 17 días. Resultados que coinciden con Teixeira et al. (2009) quienes reportan que con la madurez de la planta, se incrementa el peso seco. Se encontró también un incremento significativo de peso seco al aumentar los días de cosecha en ambos genotipos.
En rendimiento de forraje verde, el genotipo criollo reportó un promedio de 20.72 kg m-2 mientras que para el maíz QPM un promedio 22.2 kg m-2. Estos resultados fueron similares a Bayardo (2006), quien señala que el rendimiento de forraje fresco dependió, en mayor medida, del día de cosecha y la fertilización del genotipo. Con base al desarrollo normal de cualquier planta, conforme aumenta la edad, el crecimiento se va incrementando hasta alcanzar un valor asintótico. Por lo tanto, si la cantidad de semilla es uniforme, esta variable será superior a mayor edad de la planta. Los valores de estos resultados son superiores a los reportados por Rodríguez (2003); Castro (2006); Izquierdo (2003), los cuales establecieron relaciones de 10, 6, y 9 kg de forraje verde/kg de semilla, respectivamente, a los 14 y 15 días, aunque el último autor lo reportó a los 9 días.
En la Figura 1 se muestran los valores que presentan los genotipos genéticamente contrastantes. Para el contenido de lisina en forraje verde, en los primeros tratamientos se observó que en ambos cultivares de maíz QPM y criollo existe un incremento en el porciento de lisina; es decir, a los 9, 11 y 13 días después de la siembra, se encontró valores para el maíz QPM de 0.73, 1.12 y 1.17% y para el genotipo criollo los datos son 0.19, 0.3 y 0.55% de lisina, posteriormente en los muestreos 15 y 17 días se aprecia un descenso en los dos tipos de maíces. Al respecto, Dale (1997); Arano (1998) reportan valores de 0.29% de lisina en grano.
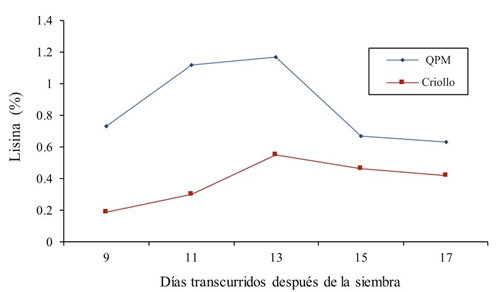
Figura 1 Contenido de lisina en forraje en maíz QPM y criollo a través de diferentes muestreos en 2014.
La media a través de los muestreos fue de 0.864 y 0.384 para QPM y Criollo; lo cual significa, una superioridad de 43.43% del maíz mejorado. Al respecto, Arámbula (2015) reporta un incremento de 16% de lisina en maíz pregerminado. En este sentido, Mendoza et al. (2006) en un estudio de biodisponibilidad de lisina y triptófano en maíz de alta calidad de proteína y normal reportan que la lisina en el grano QPM fue superior desde 45 hasta 66% con respecto a la variedad normal. También concluyen que para el genotipo Opaco-2 se encontró 58.74% de lisina, característica influenciada por el genotipo, la densidad de población y la fertilización nitrogenada. En este sentido, Poehlman y Allen (2003) reportan que la ventaja del maíz QPM sobre el maíz Criollo, es que contiene el doble de lisina y triptófano, aminoácidos esenciales para la nutrición humana y animal. Por otra parte, Fufa et al. (2003) reportan que los maíces QPM’s contienen entre 30 y 82% más de lisina que el maíz normal; asimismo, valores más altos de arginina, triptófano, histidina, treonina, cisteina, valina, también lo reportan Dale (1997) con 0.29% de lisina en grano. Todos estos resultados son inferiores a los encontrados en este estudio.
En la Figura 2 se presentan los resultados del porcentaje de triptófano a través de las cinco etapas vegetativas. Al igual que en el caso de lisina, el porciento de triptófano es superior en todos los muestreos para el maíz QPM versus maíz criollo. Se observa un mismo patrón de comportamiento de los 9, 11 y 13 días después de la siembra en ambos genotipos. Existe un incremento en el contenido de este aminoácido a medida que transcurren los días de crecimiento y desarrollo vegetativo de la plántula, sin embargo, a los 15 y 17 días del muestreo se registra una baja en el contenido de triptófano en los cultivares.
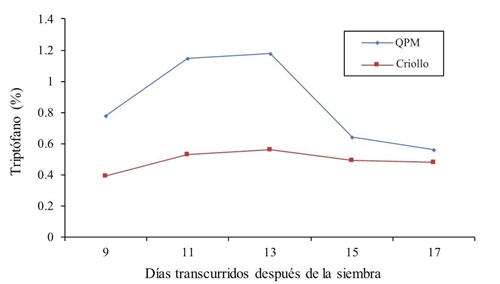
Figura 2 Contenido de triptófano en forraje de maíz QPM y criollo a través de diferentes muestreos en 2014.
El promedio a través de los cinco muestreos, muestra una media de casi el doble de este aminoácido en el maíz QPM (0.862) con respecto al maíz normal (0.49) esto representa una superioridad del 56.84%. Estos resultados concuerdan con Ortega et al. (2001) quienes mencionan que la expresión del gen Opaco-2 llega a duplicar las cantidades de lisina y triptófano, y lo convierte en un maíz con valor nutritivo superior al maíz normal. Por su parte, Mendoza et al. (2006) reportan resultados de 0.41 y 0.44 g para grano y endospermo en maíz normal y además agregan que el maíz QPM para esta misma característica supera en 46 y 73%, respectivamente. También Poey (1978) encontró 0.85 g de triptófano en 100 g de proteína en maíz QPM y 0.45 en el testigo criollo. Por su parte, Bantte y Prasanna (2004) reportan que los genotipos QPM, fueron mejor en el contenido de proteína y que existió alta significancia para lisina y triptófano entre ambos tipos de maíces. También se menciona, que en el maíz germinado existe 19% de aumento en la concentración de lisina y triptófano, y una modificación general de su composición química durante el proceso de germinación del grano (Arámbula, 2015).
Con respecto a la proteína total en todos los tratamientos se observa una superioridad del maíz QPM versus maíz común (Figura 3). Los valores para el genotipo de alto contenido de proteína oscilan de 7.49% en el primer muestreo a los 9 días hasta 19.86% de proteína a los 17 días después de la siembra; es decir, existe una respuesta lineal. En el maíz normal (criollo) los resultados fueron ascendentes hasta los 15 días, después existió una reducción de 3.24% con respecto al tratamiento anterior. También se muestra un promedio de proteína a través de los muestreos para el maíz QPM de 12.56% y para el maíz normal de 8.172%, esto indica, un incremento de 34.94% más para el genotipo QPM. Resultados similares reportan Cuevas-Rodríguez et al. (2004) quienes describen en su estudio que encontraron valores de proteína que oscilan de 9.1 a 9.13%. En otro estudio similar, Fufa et al. (2003) encontraron que la proteína oscila de 7 hasta 11.8% entre híbridos normales y QPMs, respectivamente. Mendoza et al. (2006) reportan de un estudio de triptófano un valor de 11% de proteína en maíz QPM, esta ventaja en el porciento de proteína del QPM se atribuye al gen Opaco-2 (Ortega et al., 2001).
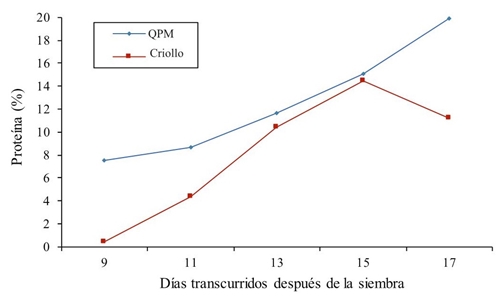
Figura 3 Porcentaje de proteína en forraje en maíz criollo y de alto contenido de proteína (QPM) en diferentes muestreos en 2014.
En la Figura 4 se presenta el rendimiento de forraje, se observa que en el muestreo a los 9 días después de la siembra el genotipo normal de elotes occidentales fue ligeramente superior al maíz QPM superando por 1 kg m-2, esto se atribuye a la precocidad y velocidad de emergencia, posteriormente en los muestreos de 11, 13, 15, y 17 días, el cultivar QPM fue superior, alcanzó rendimientos desde 20.46 kg m-2 hasta 27.14 kg m-2. Ambos genotipos alcanzan su máximo rendimiento a los 17 días después de la siembra; sin embargo, la recomendación por la superioridad en este estudio, es explotar el material mejorado genéticamente (QPM), aunado a esto también presenta un mayor contenido de lisina, triptófano y proteína. Al respecto, Castro (2006) y Rodríguez (2003) obtuvieron hasta 10 kg de forraje verde por kilogramo de semilla a los 14 y 15 días después de la siembra. Aunque el resultado de rendimiento de forraje fue más alto a los 17 días después de la siembra, la calidad en lisina y triptófano alcanza su máximo a los 13 días en ambos maíces.
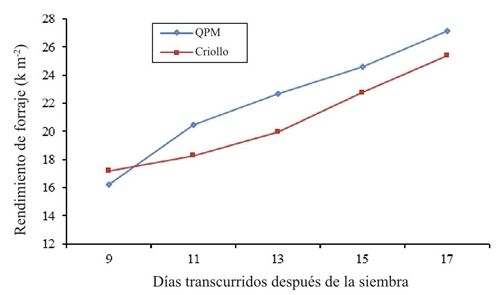
Figura 4 Promedio de rendimiento de forraje en maíz criollo y de alto contenido de proteína (QPM) en diferentes muestreos en 2014.
En relación a la proteína el maíz QPM tiene un respuesta lineal, sin embargo, el maíz normal presenta su valor más alto a los 15 días, en este sentido Mendoza et al. (2006); Vivek et al. (2008) en un estudio relacionado mencionan que el contenido de proteína muestra una correlación moderadamente fuerte, positiva y altamente significativa con el contenido de lisina y triptófano, de tal forma que un aumento en la proteína implica también un aumento en la lisina y el triptófano. La proteína cruda en maíz común apenas alcanzó 10% (Paliwal et al., 2001).
En relación a la proteína cruda Taiz y Zeiger (2003); Muller et al. (2006) describen que la disminución de la calidad de la proteína cruda en la producción de forraje verde hidropónico, es debido a la maduración de la planta, ya que durante el desarrollo de órganos estructurales como tallos y peciolos el nitrógeno se desplaza hacia las partes más jóvenes, esto disminuye la fracción de biomasa activa y promueve una dilución del nitrógeno, es particular de cada especie, es un elemento de elevada movilidad en la planta y en los primeros estadios de desarrollo se concentra en las partes de crecimiento y está en función del cultivo y es dependiente del estado de desarrollo fisiológico de la planta. Carbadillo (2005) reporta 19.41% de proteína cruda en forraje verde hidropónico, valor muy similar al maíz QPM a los 17 días después de la siembra.
Conclusiones
El rendimiento de forraje verde alcanzo sus valores más altos a los 17 días después de la siembra, sin embargo, el más alto contenido de lisina y triptófano se determinó a los 13 días en ambos genotipos. Asimismo, se concluye que la proteína del maíz QPM fue más alta a los 17 días con un valor de 19.86% y para el maíz criollo a los 15 días con 14.45 %. Cabe señalar, que con la técnica de pregerminados o hidroforraje en los dos genotipos se mejora la cantidad de lisina, triptófano y proteína.











 texto en
texto en 


