Introducción
Mammillaria plumosa Weber es una cactácea nativa del norte de México, popularmente conocida como biznaga, su forma de barril y el arreglo de sus aréolas le dan una apariencia algodonosa que simula estar cubierta por nieve, lo que la hace atractiva como planta ornamental de alto valor comercial (Arias et al., 2005). Las cactáceas son una familia cuya distribución se restringe al continente americano (Bravo-Hollis y Scheinvar, 1999), con excepción de Rhipsalis baccifera, que se distribuye en África tropical (Anderson, 2001). En la diversidad de cactáceas en México figuran 52 géneros, que representan 47% de los géneros reconocidos para la familia; a nivel de especies se reportan 850 en estado silvestre, que corresponden a 42% de todas las especies (Arias-Montes, 1993). La Norma Oficial Mexicana 059 (NOM-059-SEMARNAT-2010) clasifica a Mammillaria plumosa como una especie amenazada, por lo que podría estar en peligro de desaparecer en el corto o mediano plazo. Las cactáceas se pueden usar como plantas alimenticias, cercos vivos, forraje para ganado y medicinales, pero sin duda su uso como plantas ornamentales es el más explotado, por lo llamativo de sus flores y las formas raras de sus tallos (Jiménez y Jiménez, 2007).
Varios factores propician que muchas especies se encuentren en alguna categoría de riesgo. Su alta demanda para diversos usos ha conducido a la sobrecolecta de las especies a tal grado de amenazar las poblaciones naturales, principalmente porque muchas de ellas presentan alto grado de endemismo (Arias, 1993). La alta especificidad ambiental de las especies, ciclos de vida muy largos y su lento crecimiento son otros factores que contribuyen a la recuperación lenta de sus poblaciones ante disturbios causados de manera natural o por actividades humanas (Jiménez, 2011).
Además de la protección de las cactáceas (NOM-059-SEMARNAT-2010), es necesario implementar técnicas exitosas de propagación que permitan su conservación y aprovechamiento sustentable. Los estudios de propagación son fundamentales porque ofrecen la posibilidad de multiplicar plantas valiosas a través de métodos artificiales que podrían reducir significativamente la demanda de material de origen silvestre. La propagación de las cactáceas puede realizarse a través del cultivo de tejidos vegetales in vitro, la propagación vegetativa o por germinación de semillas (Rojas y Vázquez, 2000).
Los métodos de propagación convencionales son adecuados pero ineficientes en términos de multiplicación debido a su lento crecimiento y limitada producción de brotes (Angulo y Paredes, 2011). Ante la creciente demanda del mercado de plantas ornamentales y la mejor comprensión de los mecanismos que regulan la morfogénesis in vitro, la micropropagación se ha convertido en una herramienta clave para la protección de especies amenazadas o en peligro de extinción y la producción comercial a gran escala en la industria hortícola (Preil, 2003). En la micropropagación de varias especies de cactáceas las técnicas más empleadas han sido la activación de yemas axilares, la regeneración de brotes adventicios y la embriogénesis somática (Lema y Kulus, 2014). A través de los años estas técnicas han permitido micropropagar exitosamente más de 600 variedades y 40 especies ornamentales de cactáceas (Quiala et al., 2004; Ruvalcaba et al., 2010).
Para el establecimiento de un sistema de propagación in vitro en cactáceas se pueden emplear diversos tejidos u órganos como explantes, cuya elección depende del género y la especie. Se pueden usar brotes terminales de plántulas (Gómez et al., 2006), secciones laterales o verticales de cladodios (Estrada et al., 2002); aréolas simples (Pérez y Dávila, 2002; Ramírez et al., 2007; Quiala et al., 2009); semillas (Dávila et al., 2005; De Madeiros et al., 2006) y brotes florales (Wyka et al., 2006), entre otros, los cuales son cultivados con diferentes reguladores de crecimiento (auxinas, citocininas y giberelinas) de acuerdo con los objetivos de estudios y las respuestas morfogénicas deseadas.
Si bien la propagación in vitro de cactáceas se ha logrado eficientemente para diversas especies, desde el punto de vista científico, la aplicación de estos protocolos no se puede generalizar para todas las cactáceas, ya que la mayoría de las respuestas morfogénicas in vitro son influenciadas por el genotipo. Por ello, el objetivo de esta investigación fue establecer las condiciones óptimas de un sistema de propagación in vitro de Mammillaria plumosa Weber vía organogénesis indirecta y determinar el origen histológico de los callos y brotes.
Materiales y métodos
Material vegetal
Se utilizaron plántulas sanas y vigorosas cultivadas en condiciones de vivero proporcionadas por la unidad para el manejo y aprovechamiento de cactáceas, Tepetlaoxtoc, Estado de México, con registro UMA MX/VIV-CO-194.MX-SEMARNAT.
Medio de cultivo y condiciones de incubación
El medio de cultivo básico utilizado fue el de Murashige y Skoog (MS, 1962) con las sales inorgánicas completas, suplementado con sacarosa (30 g L-1), mio-inositol (100 mg L-1), tiamina (1 mg L-1) y solidificado con agar-agar (Merck®, 9 g L-1). El pH se ajustó a 5.7 con NaOH o HCl 1N y la esterilización se hizo en autoclave vertical (AESA®, modelo 300) a 121 °C y 1.5 kg cm-2 de presión por 20 min. Los cultivos se mantuvieron a una temperatura de 25 ±2 °C en fotoperiodo de 16 h e intensidad luminosa de 45 µmol m-2 s-1.
Establecimiento del cultivo aséptico
Las plantas jóvenes donadoras de explantes, de 4 a 6 cm de diámetro, se lavaron con detergente y agua corriente durante 25 min, después se enjuagaron seis veces con agua destilada esterilizada. Enseguida se aplicó un tratamiento de desinfección superficial que consistió en la inmersión de las plantas en una solución de hipoclorito de sodio comercial (NaOCl, cloralex®; 30% v/v) con plata coloidal estable (Microdyn®; 1.5% v/v) durante 10 min y luego se enjuagaron seis veces con agua destilada estéril. Posteriormente, las plantas se sumergieron en etanol (70%) durante 5 min y nuevamente se aplicaron seis enjuagues con agua destilada esterilizada.
Inducción de brotes
Segmentos de 5-8 cm de longitud de tubérculo con areola se sembraron en frascos de 45 mL de capacidad con 15 mL de medio de cultivo básico MS (1962) adicionado con 2,4-D (9, 13.5 y 18 µM) combinadas con cinetina (4.6, 9.3 y 13.9 µM) y medio sin reguladores de crecimiento como testigo. A las cuatro semanas de cultivo se cuantificaron la formación de callos (%), la brotación (número de explantes con brotes) y el número de brotes por explante. El diseño experimental fue completamente al azar, donde cada tratamiento estuvo representado por 10 repeticiones y la unidad experimental fue un explante areolar por frasco.
Proliferación de callos y multiplicación de brotes
Para promover la proliferación de brotes, los explantes (brotes y callos) fueron transferidos a los mismos tratamientos usados en la etapa de inducción de brotes durante 12 semanas, con subcultivos cada cuatro semanas. A las 4, 8 y 12 semanas se cuantificaron el crecimiento de callos (medido como peso de materia fresca (mg); el número de brotes organogénicos de novo por explante; el número de brotes por activación areolar por explante; longitud de los brotes de novo y por activación areolar (mm), el número de raíces y longitud de raíces (cm). El diseño experimental fue completamente al azar; donde cada tratamiento estuvo representado por 10 repeticiones y la unidad experimental fue un explante areolar por frasco.
Enraizamiento y aclimatación de plantas
Brotes de 1-1.5 cm de diámetro se subcultivaron en medio de cultivo MS (1962) a la mitad de concentración de sales minerales suplementado con sacarosa (15 g L-1) durante seis semanas. Cuando las raíces se alargaron y constituyeron un sistema radical con 3 a 5 raíces, se seleccionaron 40 plantas con diámetro promedio de 1-1.5 cm para su aclimatación. Las plantas se extrajeron de los frascos; se lavaron las raíces con agua destilada estéril y se plantaron en vasos de poliestireno de 150 mL de capacidad. Se evaluaron dos tipos de sustratos estériles: turba + arena de río (1:1) y turba + tierra de hoja (1:1). Las plantas se cubrieron con una bolsa de polietileno y se colocaron en una cámara de crecimiento con fotoperiodo de 12 h luz; temperatura de 26 ±2 °C y riegos con agua destilada estéril cada tercer día. A los 30 y 60 días después del trasplante se cuantificó el porcentaje de supervivencia.
Análisis histológico
Este análisis tuvo el propósito de estudiar el origen de los brotes y callos obtenidos durante las etapas de inducción y multiplicación; a las 10 semanas se tomaron muestras de explantes con brotes areolares organogénicos y tejido de callos. Las muestras se fijaron en FAA; se deshidrataron en una serie de etanol graduales y se procesaron para su inclusión en parafina (Ruzin, 1999). Con un micrótomo rotatorio (Spencer®) se obtuvieron cortes (10 μm) transversales y anticlinales los cuales se tiñeron con safranina 0 y verde fijo FCF (Zavaleta y Engleman, 1994). Las observaciones se hicieron con un microscopio (AxiosKop 2 Plus, ZEISS®) y las fotomicrografías se tomaron con cámara digital (AxiosKop MRc5, ZEISS®).
Análisis estadístico
Los datos obtenidos se sometieron a análisis de varianza con el paquete de análisis estadístico SAS (SAS Institute, 2003) y para la comparación de medias se usó la prueba de Tukey (p≤ 0.05).
Resultados y discusión
Establecimiento del cultivo aséptico
El proceso de desinfección empleado para el establecimiento de los cultivos asépticos de M. plumosa resultó eficiente, ya que el porcentaje de supervivencia de los explantes fue de 90% (Figura 1a-b). La efectividad del proceso de desinfección y el eventual daño de los tejidos de los explantes se relacionan directamente con el tiempo de exposición, la concentración del desinfectante, la condición fitosanitaria de las plantas donadoras, el tipo, tamaño y fisiología de los explantes son factores críticos durante el inicio de los cultivos (George y Debergh, 2008), de manera que en M. plumosa se encontró un balance en estos aspectos. Esta etapa se considera fundamental, ya que la presencia de agentes contaminantes y el ennegrecimiento de tejidos afectan negativamente las respuestas morfogénicas (Smith, 2013).
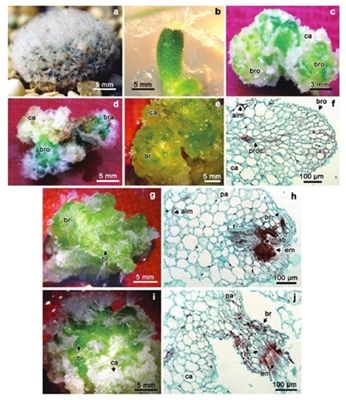
Figura 1. Morfogénesis in vitro y análisis histológico de M.plumosa. a) planta adulta; b) explante areolar; c) callo y brote regenerados de aréola apical con 2,4-D (18 μM) y cinetina (9.3 μM) a los 60 días de cultivo; d) callo organogénico, brote areolar y organogénico después de 90 días; e) estadio inicial 1, callo color verde; f) primordio de brote a los 60 días; g) estadio intermedio 2 del brote; h) sección longitudinal del brote intermedio a los 90 días; i) estadio 3 del brote; j) sección longitudinal del brote diferenciado a los 120 días; ca= callo organogénico; bra= brote areolar; bro= brote organogénico; br= brote; alm= almidón; pa= parénquima; proc= procambium; mab= meristemo apical de brote; x= xilema; f= floema; em= espinas modificadas.
Inducción de brotes
Las concentraciones de reguladores de crecimiento adicionadas al medio de cultivo tuvieron un efecto estadísticamente significativo sobre las respuestas morfogénicas observadas (p≤ 0.05). Todas las combinaciones de reguladores de crecimiento promovieron en los explantes la organogénesis indirecta, mientras que la organogénesis directa sólo se obtuvo en tres tratamientos (Cuadro 1).
Cuadro 1 Efecto de 2,4-D y cinetina en la organogénesis directa e indirecta de M. plumosa después de cuatro semanas de cultivo.
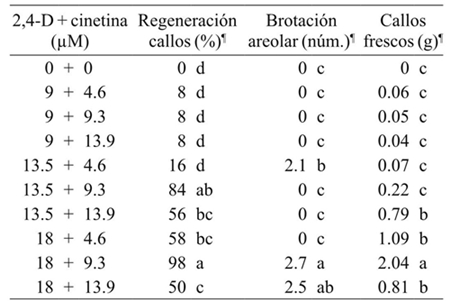
¶= Medias con la misma letra en cada columna no son significativamente diferentes (Tukey, 0.05).
En la organogénesis indirecta los explantes generaron varios tipos de callos, los cuales variaron en su coloración, textura y tasa de crecimiento. La coloración varió de blanco a verde y la consistencia fue de firme y compacto a friable (Figura 1c-d). Los callos verdes friables se originaron y crecieron en la superficie del corte en la base de los explantes, lo cual es una respuesta que coincide con observaciones hechas en Mammillaria carmenae, ya que los callos crecidos en presencia de 2,4-D presentaron un mejor aspecto (Mata et al., 2001). En general, se observó una tendencia marcada sobre el crecimiento de los callos conforme se incrementó la concentración de 2,4-D en el medio de cultivo. Los tratamientos con 13.5 y 18 µM indujeron la formación de callos 100% de los explantes; sin embargo, los mejores resultados se obtuvieron con la combinación de 18 µM de 2,4-D y 9.30 µM de cinetina (Figura 1e-j).
Estas respuestas son similares a las reportadas en la morfogénesis in vitro de otras especies de cactáceas, como Notocactus magnificus (De Medeiros et al., 2006), Opuntia spp. (Juárez y Passera, 2002; Estrada-Luna et al., 2008); Coryphantha retusa (Ruvalcaba, et al., 2010); Turbinicarpus spp. (Dávila et al., 2005) y Mammillaria albicoma (Wyka et al., 2006). En la propagación in vitro de estas especies y diversas cactáceas se han empleado de manera exitosa diferentes medios de cultivo (Vidican y Cachita, 2010) pero el medio MS (1962) ha resultado el más satisfactorio. Sin embargo, las respuestas morfogénicas deseadas dependen principalmente del tipo y concentración de regulador de crecimiento usado, y esto coincide con lo obtenido en esta investigación.
En la diferenciación de callos de Mammillaria albicoma y Coryphantha retusa los mejores resultados se alcanzaron con el ácido naftalenacético con un rango de concentraciones de 2.6 y 26 µM (Wyka et al., 2006; Ruvalcaba et al., 2010). La acción individual de las auxinas o su combinación con citocininas, así como su concentración determinan el éxito de las respuestas organogénicas observadas durante las diversas técnicas de propagación (Quiala et al., 2004).
La producción de brotes en esta etapa del proceso fue resultado de la activación de yemas axilares presentes en los explantes; sin embargo, sólo se obtuvo con la combinación de 2,4-D (18 µM) y cinetina (9.3 y 13.9 µM). Estas concentraciones favorecieron la regeneración de uno a tres brotes por explante, mientras las dosis de 13.5 µM de 2,4-D y 4.6 µM de cinetina indujeron dos brotes en promedio (Cuadro 1). En este tiempo no se observó la regeneración de brotes en la organogénesis indirecta. Si bien, no todos los tratamientos que incluyeron cinetina lograron la regeneración de brotes, se observó que dosis medias fueron capaces de romper la latencia de las yemas axilares y activar los meristemos de las aréolas.
Proliferación de callos y multiplicación de brotes
Los brotes y callos obtenidos en la etapa de inducción de callos y brotes se subcultivaron tres veces (30, 60 y 90 días) a los mismos medios de cultivo para promover la organogénesis indirecta y la multiplicación de brotes. Todas las dosis de auxinas promovieron la proliferación de los callos (p≤ 05). El mayor crecimiento de callos de apariencia friable se logró con 18 µM de 2,4-D y 9.3 µM de cinetina; a los 30 días del subcultivo triplicaron su peso inicial al pasar de 2 a 6 g. A los 60 y 90 días de cultivo la tasa de crecimiento se redujo y los callos alcanzaron un peso promedio final de 6.9 g (Cuadro 1 y 2).
Cuadro 2 Efecto de 2,4-D y cinetina en la proliferación de callos de M. plumosa después de 30, 60 y 90 días de cultivo.
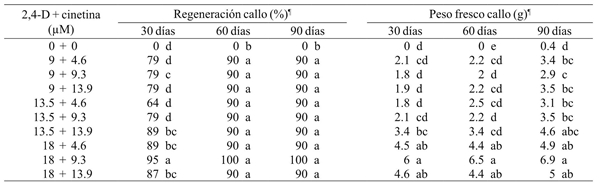
¶ = Medias con letra diferente entre columnas son diferentes; Tukey (p≤ 0.05).
Respecto a la brotación, se observó que la regeneración de brotes tuvo lugar a partir de la activación areolar, como sucedió en los cultivos de inducción, y la diferenciación de primordios de brotes a partir de organogénesis adventicia indirecta proveniente de células desdiferenciadas. En ninguno de los tratamientos se observaron daños por hiperhidratación, u oscurecimiento de tejido, y los nuevos brotes mostraron una apariencia normal.
La mejor respuesta en la brotación areolar se obtuvo con 18 µM de 2,4-D y 9.3 µM de cinetina donde se expresó el mayor número de explantes que generaron brotes areolares y la cantidad promedio de brotes por explante fue de 11.4 a los 90 días de cultivo (Cuadro 3). En cuanto a los brotes organogénicos, estas mismas concentraciones de reguladores de crecimiento favorecieron la mayor respuesta de regeneración de brotes en los tres periodos de subcultivo (Cuadro 4).
Cuadro 3 Efecto de 2,4-D y cinetina en la multiplicación brotes areolares de M. plumosa a 30, 60 y 90 días de cultivo.
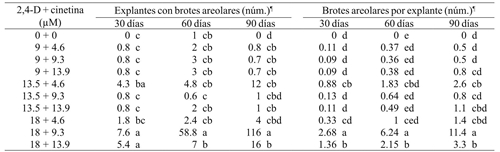
¶= Medias con letra diferente entre columnas son diferentes; Tukey (p≤ 0.05).
Cuadro 4 Efecto de 2,4-D y cinetina en la multiplicación de brotes organogénicos de M. plumosa a 30, 60 y 90 días de cultivo.
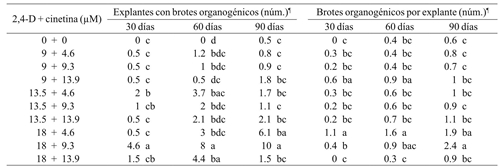
¶= Medias con letra diferente entre columnas son diferentes; Tukey (p≤ 0.05).
Las respuestas de regeneración de brotes obtenidas en el presente estudio son diferentes a los reportados para otras especies de cactáceas. En Coryphantha elephantidens la organogénesis indirecta de brotes se logró con 2.3 µM de 2,4-D y 6.9 µM de cinetina (Wakhlu y Bhau, 2000), mientras que en Opuntia ficus-indica la regeneración se obtuvo 2.26 µM de 2,4-D y 2.21 µM de BA con valores de 2 a 3 brotes por explante (Angulo-Bejarano y Paredes-López, 2011), cantidad considerablemente menor a la obtenida en este trabajo.
La activación del crecimiento de las yemas axilares areolares, de cada explante de Mamillaria plumosa promovida por el 2,4-D y la cinetina, puede considerarse alta; sin embargo, en la regeneración de los cactus Pelecyphora aselliformis y P. strobiliformis se obtuvieron 13.7 y 12.3 brotes por explante, respectivamente, con 8.8 µM de BA (8.8) (Pérez y Dávila, 2002). Asimismo, Mata et al. (2001) determinaron que la mayor tasa de multiplicación de brotes en Turbinicarpus laui se obtuvo con BA (8.8-13.32 µM) y ácido naftalenacético (0 - 2.68 µM).
En todo proceso morfogénico, el número de brotes producido está determinado genéticamente y se considera el principal indicador del potencial de multiplicación de una especie. La cantidad de brotes refleja el número de plantas potenciales adultas y en este estudio, la cantidad promedio de brotes que pueden regenerarse a partir de un explante de M. plumosa es de 537 aproximadamente, después de 120 días de cultivo.
Análisis histológico
El análisis histológico permitió caracterizar el origen y desarrollo de los brotes a partir de los callos organogénicos. Se observaron tres etapas identificadas como estadio 1 (inicial; 60 días); estadio 2 (intermedio; 90 días) y estadio 3 (diferenciado; 120 días). En el inicial, el callo estuvo formado por células de parénquima, isodiamétricas de paredes delgadas con granos de almidón. También se observó actividad meristemática subepidérmica que promovió el levantamiento de una protuberancia globosa, caracterizada por la diferenciación de procambium en la parte central (Figura 1e-f). En el estadio intermedio, el callo se tornó de un color más verde y aumentó el número de brotes con mayor grado de diferenciación.
Se observó la formación de un meristemo apical, diferenciación de una areola juvenil, con primordios de espinas, irrigados por un haz de xilema y floema diferenciado y funcional (Figura 1g-h). En el estadio diferenciado se presentó un callo con numerosos brotes verdes claramente diferenciados (Figura 1i); el parénquima del callo desarrolló numerosos haces vasculares de tipo anficribal (floema externo y xilema interno) con ramales orientados hacia los brotes. Estos brotes presentaron espinas modificadas en el centro de la areola con haces vasculares maduros (Figura 1j). Finalmente, los brotes crecieron y la base del nuevo brote se adelgazó y desprendió del callo y regenerar un nuevo individuo.
Enraizamiento
En la etapa de multiplicación, los brotes areolares y organogénicos de novo de Mammillaria plumosa generaron raíces de forma natural a 90 días de cultivo. La formación de raíces en los brotes regenerados durante todo el proceso morfogénico representa una ventaja en comparación con otras especies donde es necesaria una etapa de enraizamiento con reguladores de crecimiento específicos que induzcan al número y longitud de raíces. Sin embargo, los brotes se cultivaron en medio básico MS (1962) sin reguladores de crecimiento para mejorar la respuesta. A las cuatro semanas de cultivo los brotes constituyeron un sistema radical con 2 a 4 raíces en promedio.
En las cactáceas se ha reportado que, en general, son especies fáciles de enraizar tanto en condiciones in vitro como in vivo y que, de la misma manera, pueden diferenciar raíces adventicias sin la presencia de auxinas. Dávila-Figueroa et al. (2005) indicaron que el enraizamiento in vitro de brotes de los cactus Turbinicarpus schmiedickeanus subsp. flaviflorus y T. subterraneus regenerados (54 - 94%) se logró en medio básico MS (1962) sin reguladores de crecimiento. En otras especies como Pilocereus robinii (Quiala et al., 2009) y Turbinicarpus laui (Mata et al., 2001) el enraizamiento in vitro (94-100%) también fue efectivo en el medio básico MS (1962) pero con la mitad de concentración nutrientes. En el caso de Pilocereus aselliformis y P. strobiliformis la mejor repuesta de enraizamiento (87-89%) se obtuvo con ácido indolbutirico o ácido indolacético (Pérez y Dávila, 2002).
Aclimatación de plantas
En la etapa de aclimatación se utilizaron los brotes enraizados in vitro de Mammillaria plumosa que se plantaron en macetas que contenían una mezcla proporcional (1:1) de turba y arena de río. A 30 días la tasa de supervivencia de las plantas fue de 85%, que es un porcentaje aceptable. En la aclimatación de plantas de cactáceas regeneradas in vitro los porcentajes de supervivencia pueden ser variable; 70% en Schlumbergera truncata, 88% en Pilocereus aselliformis y P. strobiliformis (Pérez y Dávila, 2002) y 94-100% en Turbinicarpus laui, Coryphantha elephantidens y Mammillaria carmenae (Mata et al., 2001; Coca et al., 2007).
Conclusiones
Se estableció un sistema de regeneración in vitro para Mammillaria plumosa vía organogénesis directa e indirecta a partir de explantes areolares. La morfogénesis se caracterizó por la diferenciación de tejidos desorganizados o caulogénesis y la diferenciación de estructuras organizadas u órganos (organogénesis directa e indirecta). El promedio de brotes producidos fue 12 y el potencial de multiplicación fue de 500 brotes en promedio después de 20 semanas de cultivo, incrementándose el número de plantas al aumentar el número de subcultivos. La regeneración de brotes para ambas rutas fue promovido por la combinación de 18 µM de 2,4-D y 9.3 µM de cinetina, tanto en la etapa de inducción como en la de multiplicación. La generación de raíces adventicias para la producción de plantas completas fue posible en medio de cultivo básico MS (1962) a la mitad de concentración de nutrientes totales. La supervivencia de plantas en la aclimatación fue 85% en sustrato de turba y arena de río (1:1). El sistema desarrollado es eficiente para la propagación masiva de Mammillaria plumosa y contribuirá a satisfacer la demanda comercial de esta especie así como su aplicación en estrategias de rescate y conservación de poblaciones silvestres.











 texto en
texto en 


