Los arándanos (Vaccinium spp.) es un grupo de plantas frutales que pertenece a la familia Ericaceae y constituyen un grupo de especies ampliamente distribuidas en el Hemisferio Norte, específicamente Norteamérica, Europa Central y Eurasia, encontrándose también en América del Sur, algunas especies en África y Madagascar. La mayor parte de las variedades de arándano que se cultivan en el mundo son del tipo alto del norte provenientes de Vaccinium corymbosum principalmente y son de alto requerimiento de horas frio (Carrillo et al., 2015). Recientemente en México han introducido cultivares del tipo alto del sur con requerimientos bajos de frio. Los Arándanos del tipo altos del sur, son híbridos interespecíficos basados en V. corymbosum L. con V. agustifolum, V. asheii y V. darrowii L, siendo esta última especie la que les proporciona a los híbridos la poca necesidad de frío y le permite su cultivo en latitudes bajas e inviernos con pocas o nulas horas frío (Horticom, 2005).
La producción de arándano en México está en acelerada demanda principalmente en los estados como Jalisco (43%), Colima (28%), Baja California (13%), Michoacán (8%), Sinaloa (6%), Puebla (2%), el Estado de México con 34.5 t y sonora con 15.3 t representa el (0%) de la producción (SIAP, 2014). La fuerte demanda internacional, las condiciones agroecológicas y el cambio de los precios relativos en el mercado, explica este impacto fuerte productivo en el occidente mexicano (Figueroa y Gallo, 2005).
En México, cuando un productor decide establecer un huerto de arándano se enfrenta a una disyuntiva: el establecimiento de las 5 000 plantas por hectárea aproximadamente, con planta producida en el país y con riesgo de infección de hongos fitopatogenos a un costo de 25.00 pesos planta-1 lo que nos da 125 000.00 pesos ha-1, o con planta importada a un costo de 75.00 pesos planta-1 con calidad sanitaria lo que nos da 375 000.00 pesos ha-1 aproximadamente. Esto debido a que los sustratos usados por los viveristas en el país son actualmente la causa de la producción de planta en vivero sin calidad fitosanitaria (Rebollar et al., 2013).
Es conocido que las plantas de la familia Ericaceae, se caracterizan por establecer simbiosis con micorrizas, sobre todo las llamadas micorrizas ericoides, que le confieren a las plantas de esta familia la habilidad de colonizar suelos nutricionalmente pobres y ambientes donde el anegamiento es frecuente en invierno (Carrillo et al., 2015). Para que la colonización tenga lugar es necesario que las raíces de las plantas tomen contacto con las hifas de los hongos micorriticos pero también que el medio o sustrato provenga las condiciones para que este contacto sea adecuado, tal como lo sugiere Scagel et al. (2005); Bizambi y Dames (2015).
En Oregón, Scagel et al. (2005) aisló Oidiondendron griseum de V. corymbosum, Pezyzella ericacea de una Ericacea y Hymenoscyphus ericácea de V. agustifolium observando que la inoculación no es inmediata y depende del suelo y prácticas de trasplante su éxito en el mediano plazo. Bizamabi y Dames (2015) en Sudáfrica aislaron también dos especies de ericáceas Lachunuem sp y Cadaphora sp de especies de Ericaceas e inocularon plántulas de arándanos con relativo éxito. En Chile, los arándanos cultivados del tipo altos del norte han sido tratados con inoculo de micorrizas importadas de USA y su efectividad es limitada, por ello Carrillo et al. (2015) utilizaron fuentes de inóculo nativo de Gaultheria pumila, Azalea sp. y V. corymbosum obteniendo una mejor actividad con G. pumila. La interacción micorriza-sustrato resta por explorar por estos autores. En este contexto nuestro estudio tuvo lugar con el propósito de explorar la utilidad de las micorrizas de plantas nativas de la región occidental de México para la utilidad en la producción de plantas en vivero.
Localización
Este estudio se realizó en el campus Morelia de la Universidad Autónoma Chapingo (UACH), localizado en 19º 68’ 69’’-101º 23’ 80’’. El clima es templado subhúmedo, con lluvias en verano y humedad media, C (w1). Temperatura promedio anual de 17.5 °C y precipitación de 773.5 mm anuales. Los vientos dominantes proceden del suroeste y noreste, variables en julio y agosto con intensidades de 2 a 14.5 km h-1 (SMN, 2015).
Material vegetal
Se utilizaron plántulas de 4 meses de edad, de la variedad Biloxi micropropagadas in vitro en la Facultad de Agrobiología de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH) se confirmó su calidad sanitaria para ser utilizadas en los ensayos.
Fuentes de inóculo
Para investigar la colonización por micorrizas del arándano cv. Biloxi se utilizaron macetas con sustrato inoculado con micorrizas nativas de una especie de arándano silvestre Vaccinium confertum, una especie del género Gaultheria sp. y el producto comercial Endospor®. Enseguida se anotan los detalles de las fuentes de inóculo.
1. El inoculante endomicorritico comercial Endospor® contiene hongos formadores de endomicorrizas, como Gigasporas margarita, Glomus mosseae, G. clarum, G. desertícola, G. etunicatum, G. brasilianum, G. intraradices, Trichoderma y Gliocladium. Se recomienda en hortalizas, frutales, flores, árboles, pastos y arbustos. Los inoculantes se prepararon y aplicaron el mismo día. La aplicación se realizó de acuerdo a la dosis indicada en la etiqueta por la compañía y disolviéndola en 250 ml de agua (Bactiva, 2015).
2. La fuente de micorrizas nativas fueron las rizósferas (suelo + raíces) del arándano silvestre de 3 años de edad (V. confertum) y de una especie de Gaultheria colectadas en un bosque aledaño a la ciudad de Morelia colonizados con endomicorrizas y siguiendo la metodología propuesta por Carrillo (2015). Aplicando 1 kg de suelo en 3.6 L de agua por lo que el mismo día de su inoculación se fue a extraer de esta población.
En el ensayo las macetas contenían tres litros de la mezcla de peat moss más perlita (v/v 1:1) inoculada con micorriza comercial y micorriza nativas. El peat moss tiene la capacidad de retención de humedad, buena aireación y alto contenido de materia orgánica, y la perlita retiene el agua para que esté disponible por más tiempo para la planta además de ser inerte. Esta mezcla garantiza una humedad adecuada buscando la efectividad de la inoculación con los microorganismos benéficos nativos (Scagel et al., 2005; Bizabani y Dames, 2015). Establecidas en un diseño experimenta de bloques completamente al azar con 12 repeticiones.
Presencia de micorrizas
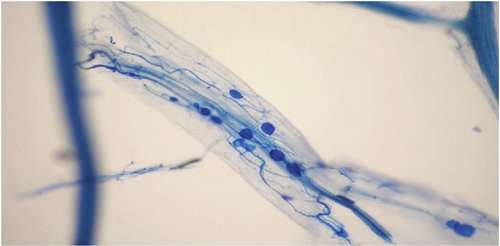
Para distinguir a los hongos micorriticos se siguió un protocolo de tinción de raíz propuesto por Phillips y Hayman (1970) a partir de una muestra radicular. Los análisis se llevaron a cabo en el laboratorio de agroecología del centro de investigación en ecosistemas UNAM (CIECO), Campus Morelia, Michoacán.
Evaluación del crecimiento de las plantas de arándano
Para la evaluación del crecimiento del arándano azul (Vaccinium spp.) cv. Biloxi bajo las tres fuentes de inoculo más el testigo se midieron las plantas. Se realizaron mediciones a los 161 días de haber realizado el trasplante (13 de marzo de 2014).
Se realizaron tres mediciones del crecimiento de plántulas:
Altura de la planta: se midió desde el cuello del tallo principal hasta el ápice del mismo.
Número de tallos: se contabilizo el número de tallos o rebrotes en la base de la plántula; brotes secundarios producidos en el periodo de crecimiento.
Número de hojas: se contaron el número de hojas del tallo principal, desde la base hasta el ápice de crecimiento.
Longitud y ancho de la hoja del tallo principal: se midió el largo y ancho de la hoja promedio del tallo principal con cinta métrica (Figura 1).

Figura 1 Mediciones del crecimiento de las plántulas de arándano azul cv. Biloxi una vez inoculadas con micorrizas.
Para cada variable se realizaron análisis de varianza (Anova) y pruebas de comparación de medias (Tukey α< 0.05) para analizar su efecto.
Logros obtenidos
Dado que las plántulas utilizadas fueron multiplicadas in vitro confirmamos su sanidad por medio de pruebas de tejido de la siguiente manera: se cortaron fracciones pequeñas de ramas, tallos y raíz se colocaron en cajas petri con medio de cultivo papa-dextrosa-agar (PDA) (8 g almidón de papa, 20 g dextrosa, 20 g agar) y siguiendo las claves morfológicas de Barnet y Hunter (1972) para identificar patógenos presentes. Todas las plántulas resultaron libres de bacterias y hongos.
Efecto de micorrizas nativas y el producto comercial Endospor R en el crecimiento de plántulas y colonización micorritica
El efecto de la inoculación en las plántulas se midió tanto en el crecimiento que produjo en la planta como en la colonización en raíces. El análisis estadístico de ambos tipos de variables se analizó mediante un Anova. En el Cuadro 1 se presentan los resultados. De manera general podemos señalar que entre los cuatro tratamientos el inoculado con Gaultheria sp, produjo una altura de plántula, número de hojas y frecuencia e intensidad de colonización micorritica mayor que el resto de tratamientos. El crecimiento promedio para plántulas de este tratamiento después de los 161 días fue de 22.818 cm de altura y 17.636 hojas por planta y de frecuencia e intensidad de colonización de 8.6% y 15%, respectivamente. En número de tallos, longitud y ancho de la hoja no encontramos diferencias significativas entre tratamientos (Cuadro 1).
Cuadro 1 Resultados de mediciones de crecimiento de plántulas y colonización por micorrizas de acuerdo con las fuentes de inóculo probadas en arándano cv Biloxi.

z= tratamientos con la misma letra estadísticamente son iguales.
En el Cuadro 1, se observa que para altura de la planta el tratamiento con inoculo Vaccinium confertum y el testigo sin inocular, presentaron una altura promedio de 16.545 y 16.5 cm respectivamente, que fueron similares a los obtenidos con la inoculación de Gaultheria sp., mientras que las plántulas inoculadas con el producto comercial Endospor registró el valor más bajo. Para número de hojas por planta, el tratamiento inoculado con Gaultheria sp. y el testigo, presentaron valores similares y muy distintos a los obtenidos con el inóculo de V. confertum y el producto Endospor. Para el resto de variables los tratamientos no muestran diferencias notables; las plántulas inoculadas o no muestran valores semejantes de número de tallos, largo y ancho de hoja.
En la Figura 2 se muestra la raíz con micorrizas de la especie Gaultheria sp. y en la Figura 3 se observa los datos graficados del Cuadro 1. Los resultados nos hacen notar que para la etapa en vivero, la plántula de arándano azul cv Biloxi inoculada con los tratamientos probados pueda alcanzar una baja colonización y un relativo bajo crecimiento. Lo anterior, coincide con Callejas-Ruíz et al. (2009), que no encontró efecto al inocular con micorrizas del género Glomus en calabaza. Tampoco Scagel et al. (2008) muestra un efecto importante de la inoculación micorritica de plántulas de arándanos en las primeras etapas de la planta. Este autor sugiere que la colonización puede depender de factores ambientales, de manejo o del sustrato y no solamente por la presencia o ausencia de las micorrizas correctas.
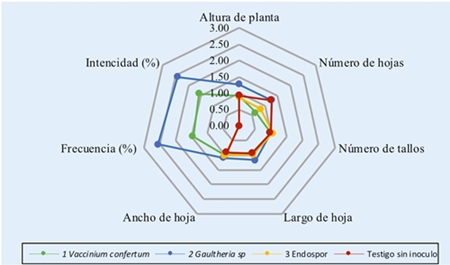
Figura 3 Variables de crecimiento de plántulas y colonización por micorrizas en arándano del cv Biloxi. Como respuesta a las diferentes fuentes de inoculo. Los valores reales de las variables fueron centrados con fines de graficación.
Un resultado opuesto reporta Ávila et al. (2009), quien encontró efecto positivo de las micorrizas del producto comercial Micorrizafer® (Agrosafer Company, Medellín, Colombia), el cual contiene esporas de micorrizas de los géneros Glomus, Entrophospora, Scutellospora y Acaulospora en tallos micropropagados. En la especie de arándano andino V. meridionale, la colonización produce que las plantas desarrollen raíces cortas a menos que se les agregue promotores de desarrollo como Acido Indol-butírico o ácido indol-acético en el medio de cultivo. El uso de los promotores es también contradictorio pues Rodríguez (2006), también encontró efectos positivos de micorrizas al multiplicar estacas de tallo e inocularlos con el producto comercial Mycosym Tri-Ton (Hymenoscyfus ericae) de la compañía chilena Biotritón S. A. Este autor señala que la interacción con el efecto de hormonas de crecimiento puede ser negativo, y no recomienda su uso cuando se inocula al arándano con micorrizas.
En términos de fuentes de inoculo nuestro trabajo coincide con el de Carrillo et al. (2015) quienes obtuvieron colonización de micorrizas a partir de propágulos de Gaultheria pumila, una especie chilena. Después de 6 meses las raíces del cv Brigitta de V. corymbosum (arándanos altos del norte) se colonizaron con estas micorrizas aunque poco abundantemente. Puede ser que para estos autores como en nuestro caso, el efecto del sustrato Peat Moss o turba deba ser investigada; autores como Scagel et al. (2005); Farías et al. (2014); Bezabani y Dames (2015) señalan que la relación entre la naturaleza del inoculo, la nutrición, el sustrato y el plazo de observación de las mediciones pueden ser factores que hagan variar los resultados aunque todos coinciden en la las micorrizas reducen la aplicación de nutrimentos y hacen viable su uso en sistemas de cultivo orgánico.
Conclusiones
El ensayo permitió distinguir el efecto positivo del inóculo de Gaultheria sp. Como fuente de micorrizas para los arándanos del cv Biloxi. Si bien puede considerarse una colonización baja (frecuencia de 8.3% e intensidad de 15%), la misma produjo un crecimiento de 22.8 cm de longitud en tallo y 17.6 de hojas por planta después de 161 días de trasplante. El producto Endospor®; así como, la rizósfera de V. confertum no produjeron un efecto diferente al testigo sin inocular.











 texto en
texto en