En su ambiente natural el ataque de u patógeno a las plantas es generalmente de poca importancia; sin embargo, la agricultura ha generado una cultura de monocultivo y de implementación de diversas técnicas agronómicas lo que ha conllevado a un desequilibrio en el ecosistema y a la proliferación de plagas (Cruz et al., 2006).
Una gran variedad de especies de plantas se ven afectadas por patógenos diferentes, entre los que destacan: hongos, bacterias, nematodos y virus. Una sola planta puede ser atacada por cientos de miles de individuos de una misma clase de patógeno. Sin embargo, aun cuando las plantas pueden sufrir daños considerables o de poca importancia muchas de ellas sobreviven y con frecuencia continúan su desarrollo normal llegando a producir buenos rendimientos (Agrios, 2002).
La resistencia natural de las plantas a patógenos se basa en efectos combinados de barreras preformadas y mecanismos inducibles. Las plantas utilizan defensas físicas y bioquímicas en contra de los invasores (Rangel et al., 2010). Teóricamente, las plantas poseen los genes necesarios para responder a la agresión ocasionada por un patógeno; esta respuesta puede ser en forma constitutiva, al estar presentes de una manera permanente en la planta o no constitutiva e inducida, cuando el ataque de la plaga o la interacción entre estos es suficiente para desencadenar umbrales tóxicos de sustancias que bloquean la instalación de la plaga (Riveros, 2001). Se ha comprobado que una compleja red de señales hormonales controla la respuesta de la planta frente al ataque de patógenos.
Las hormonas vegetales son un grupo de moléculas pequeñas de naturaleza química diversa que controlan procesos, que van desde el crecimiento y desarrollo de la planta, hasta su respuesta frente al estrés biótico y abiótico. El etileno, el ácido jasmónico (AJ) y el ácido salicílico (AS) son reguladores del crecimiento vegetal con un papel bien documentado en la respuesta de la planta frente al estrés biótico (Lumba y Culter, 2010). El objetivo del presente artículo es hacer una revisión del papel del AJ durante las respuestas de defensa contra patógenos en la planta, de igual forma presentar las características y cualidades con las que cuenta el ácido jasmónico como hormona inductora de resistencia frente al ataque de algún patógeno en diversos tipos de tejido vegetal.
Principales mecanismos de defensa vegetal frente a patógenos
Continuamente las plantas se encuentran en contacto con otros organismos, en sus condiciones naturales ellas interactúan con una amplia gama de microorganismos potencialmente patogénicos. Sin embargo, las plantas normalmente permanecen sanas debido, a la manifestación de varios mecanismos de defensa (Kenneth, 2002). Para ello los vegetales han desarrollado mecanismos físicos y químicos que reducen la posibilidad de infección o previenen el acceso de patógenos al hospedante. En general se puede decir que existen diversos mecanismos involucrados en la defensa de las plantas frente a patógenos, existen los que pueden presentar una defensa pasiva o preformada (preexistente), si está determinada por propiedades ya existentes antes del intento de infección del patógeno; también denominados factores constitutivos, o una defensa activa o inducida, dinámica, si resulta de estructuras o sustancias producidas como respuesta a la penetración del patógeno (Cruz et al., 2006).
Defensa pasiva
Dentro de este tipo se encuentran: las barreras estructurales o físicas de las plantas, formada por todos aquellos sistemas físicos que la planta tiene en forma natural, sin necesidad de ningún tipo de estímulo para producirlas, entre las cuales destacan las ceras, cutícula, paredes celulares, tamaño, forma y ubicación de aperturas naturales entre otras (Agrios, 2005). Las barreras bioquímicas preformadas, en este mecanismo se encuentran los inhibidores que se producen de forma natural y se liberan al medio con la finalidad de alejar o no permitir la reproducción de patógenos, de igual forma los factores de preexistencia se pueden deber a faltas de sustancias bioquímicas o nutrientes que permitan el reconocimiento del vegetal con el patógeno, lo que le permite no ser susceptible a su infección, además en las células vegetales se producen sustancias capaces de degradar la pared celular de los patógenos, por mencionar glucanasa y quitinasa, las concentraciones de dichas sustancias puede ir variando dependiendo de la edad del tejido vegetal (Lundstedt y Valdés, 2013).
Defensa activa o inducida
Los mecanismos de defensa activa, también denominada como resistencia inducida, son activados únicamente como respuesta al ataque de un patógeno (Collinge et al., 2001). Este tipo de resistencia es un mecanismo activo de defensa que involucra cambios claros en el metabolismo provocados por la expresión diferencial de genes. La inducción de defensas bioquímicas en las plantas, provocadas por el ataque de algún patógeno, es activada por diversos mecanismos dependiendo de varios factores, entre los cuales son de mayor importancia: la susceptibilidad de la planta, tipo de patógeno, condiciones medioambientales, etc.
Dentro los mecanismos de respuestas se encuentran las reacciones de hipersensibilidad, síntesis de proteínas RP (relacionadas con la patogenicidad), producción de fitoalexinas, aumento en la concentración de compuestos fenólicos, transformación de glucosidos a fenoles tóxicos para el patógeno, producción de enzimas que oxidan fenoles (polifenoloxidasa, peroxidasa, fenilalanina amonío-liasa) las que otorgan un mayor grado de toxicidad a algunos fenoles y aceleran la síntesis de compuestos como la lignina que fortalecen las paredes celulares, también se puede activar la síntesis de otras sustancias complejas del sistema defensivo de la planta como pectinas, proteínas, productos cianogénicos (cianuros), sustancias inhibidoras de las enzimas y toxinas producidas por el patógeno entre otras (Agrios, 2005; Robledo et al., 2012).
Inductores de resistencia
La inducción de resistencia frente a un patógeno se basa principalmente en transformar una interacción compatible en incompatible; es decir, que la planta susceptible de enfermar sea resistente (Riveris, 2010). Los inductores actúan sobre el vegetal impidiendo o retrasando la entrada del patógeno, y limitando consecuentemente su actividad en el tejido u órgano infectado. No tienen efecto directo o actividad específica sobre los fitopatógenos (Gómez y Reis, 2011, varios mecanismos de inducción existen hasta el momento entre los más destacados se encuentran: la resistencia sistémica adquirida (RSA) y la resistencia sistémica inducida (RSI) (Camarena y Torre, 2007).
La RAS se activa local y sistémicamente tras la infección de la planta por patógenos que producen necrosis (virus, bacteria u hongos). La RSA se caracteriza por ser una resistencia de amplio espectro, es decir, que confiere resistencia no sólo al patógeno que la ha activado, sino también a otros patógenos (Ryals et al., 1996). Se ha comprobado que la RSA es un resistencia duradera (activa durante días o semanas) en condiciones tanto naturales como de laboratorio, lo que la hacen muy atractiva desde un punto de vista agronómico (Molina y Rodríguez, 2008). Mientras que la RSI es activa por patógenos del suelo que son capaces de colonizar las raíces de las plantas.
Al igual que la RSA, la RSI es una resistencia sistémica, de amplio espectro (puede conferir protección frente a bacterias, hongos y algunos virus), y es duradera en condiciones de laboratorio y de campo (Pieterse y Loon, 2004). La similitud de ambos se basa en que, las plantas, luego de ser expuestas a un agente inductor, activan sus mecanismos de defensa tanto en el sitio de infección como en áreas más distantes (respuestas sistémicas) de manera más o menos generalizada (Cavalcanti et al., 2005).
Dependiendo del tipo de agente inductor, existen dos tipos de inducción de resistencia. Una donde la resistencia puede ser activada por la presencia, sobre el tejido vegetal, de organismos como hongos, virus, bacterias, nematodos e incluso insectos herbívoros, conocida ésta como inducción biótica. Mientras que el otro tipo de inducción imita la presencia de un patógeno para generar resistencia por la presencia de moléculas sintéticas depositadas sobre los órganos vegetales, denominada inducción abiótica (Kuc, 2001). Las vías de señalización de respuestas provocadas por un agente biótico pueden ser dependiente tanto del ácido salicílico, en asociación con la acumulación de las proteínas relacionadas con la patogénesis (PRP), como del ácido jasmónico y del etileno, no estando asociado, en este caso, con la acumulación de las PRP, conocida como resistencia sistémica adquirida (RSA). En cambio, la cascada de señales generada por un inductor abiótico sólo sigue la vía del ácido jasmónico y etileno, denominada resistencia sistémica inducida (RSI) (Vallad y Goodman, 2004).
Ácido jasmónico
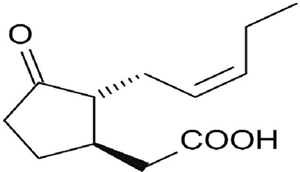
El ácido jasmónico (AJ), moléculas relacionadas y sus derivados, todos llamados jasmonatos (JAs), son fitohormonas de origen lipídico de estructura molecular similar a la de las prostaglandinas en animales (Farmer, 2003; Howe, 2004). Actúan como moléculas señal de las respuestas de las plantas a diversas situaciones de estrés y participan en diversos procesos del crecimiento y desarrollo (Avanci et al., 2010; Ting, 2014). El AJ es una ciclopentenona que posee una cadena pentenilo y una cadena carboxílica (figura 1). El nombre químico y la fórmula empírica del ácido jasmónico son: ácido cis-2-pent-2’-enil 3-oxo-ciclopentenilacético y C12H18O3, respectivamente (Abdala, 2006). El AJ es un aceite amarillo de consistencia viscosa, soluble en cloroformo, acetato de etilo, acetona y éter; y poco soluble en agua, su punto de ebullición es de 125º C/0.001 mm Hg (López, 1985).
La ruta de biosíntesis, también llamada ruta de los octadecanoides, ha sido estudiada extensamente, llegándose a conocer hoy en día varias enzimas implicadas en diversos pasos de la misma (Berger, 2002; Agrawal, 2004). Los jasmonatos son formados a partir del ácido graso no saturado linoleico y linolénico que se liberan desde los fosfolípidos de las membranas celulares por la acción de lipasas, mecanismo que ocurre principalmente en las hojas de las plantas (Jordán y Casaretto, 2006) (Figura 2).
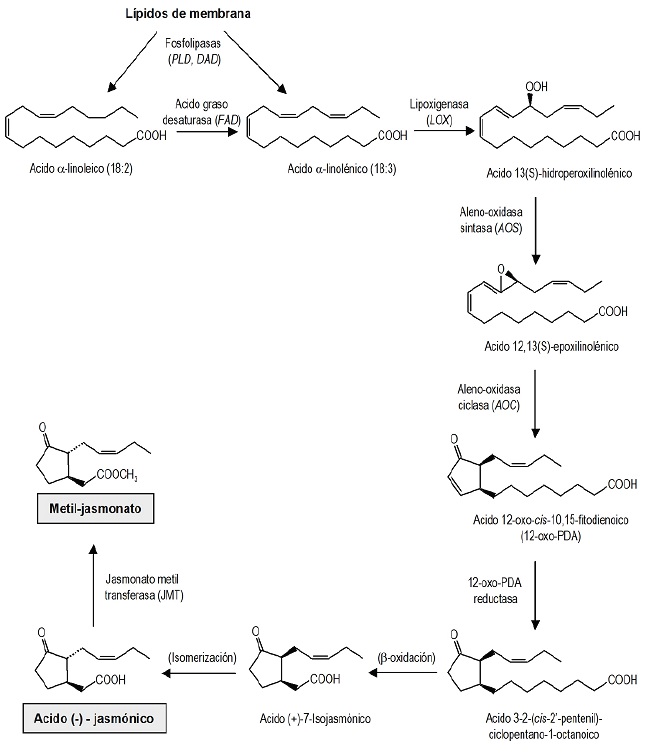
Figura 2 Biosíntesis del jasmonato. Ruta de los ácidos octadienoicos (18:3) que describe la formación de ácido jasmónico y metil jasmonato a partir de fosfolípidos de membrana (Jordán y Casaretto, 2006).
El ácido jasmónico es producido por la planta después del daño producido por un patógeno los cuales pueden ser microorganismo o insecto y da como resultado un incremento de la producción de compuestos de resistencia, como el ácido salicílico y etileno(Chávez et al., 2012). Entre las situaciones de estrés que lo regulan están las heridas (mecánicas o bióticas), la exposición a ozono, sequía y el ataque por patógenos y plagas. Entre los procesos de desarrollo en los que participan los jasmonatos están el crecimiento de la raíz, la tuberización, la maduración de frutos, la senescencia y el desarrollo del polen, la formación de yemas y flores, entre otros efectos (Rao et al., 2002; Rojo et al., 2003; Wasternack 2007; Chunmei, 2013).
Salisbury y Ross, (1992) reportaron que este tipo de compuesto se han encontrado en 150 familias y 206 especies de plantas, incluyendo hongos, musgos y helechos. También se ha demostrado que el AJ provoca efectos fisiológicos sobre las plantas similares a los del ácido abscísico (ABA) (Schilmiller y Howe, 2005).
Este ácido orgánico generalmente está en el rango picomolar por gramo de peso fresco en tejido de hojas y pueden aumentar rápidamente bajo estímulos externos. Algunos órganos y tejidos exhiben por encima de 10 veces el nivel encontrado en hojas, sugiriendo que estos niveles elevados indican funciones diferentes en la regulación de determinados procesos de desarrollo (Wasternack y Hause, 2002).
Ácido jasmónico como inductor de resistencia frente a patógenos
El ácido jasmónico y sus derivados son considerados componentes de la vía de transducción de señales en los mecanismos de defensa de las plantas y se han registrado aumentos en sus niveles endógenos en plantas sometidas a estrés (Fonseca et al., 2009; Yhan et al., 2013). Estos compuestos inducen la expresión de genes que codifican proteínas específicas, entre las que pueden citarse: inhibidores de proteasas, enzimas involucradas en la biosíntesis de flavonoides, osmotinas y lipoxigenasas, y diferentes proteínas relacionadas con la patogénesis (Andrade et al., 2005). Diversos estudios demostraron que el AJ y los JAs inducen la biosíntesis de varias enzimas involucradas en las reacciones de resistencia en plantas, entre las más importantes están las enzimas claves para producir las fitloexinas como polifenol oxidasa, calcona sintasa, fenilalanina-amonio liasa (PAL) y HMG-Co-reductasa (HMGR) (Jankiewicz, 2003; Leszek, 2003).
El ácido jasmónico, al igual que cualquier otra hormona, no participa de forma aislada en la activación de los procesos que regula, sino que lo hace interaccionando con otras moléculas señalizadoras (Lorenzo y Solano, 2005). Se ha descrito un amplio número de interacciones entre el AJ y otras rutas de señalización hormonal como las de etileno, AS, auxinas o ABA (Turner et al., 2002; Rojo et al., 2003). Al ser herida la planta por algún patógeno se induce el aumento en la producción de etileno. Lo que genera la formación de elicitores (conformados principalmente por los elementos de las paredes celulares destruidas) (Anderson et al., 1989). Estos causan diversas reacciones: pueden generar desde reacciones de hipersensibilidad conectada con la explosión oxidativa y la muerte programada de las células alrededor del lugar infectado.
Cuando la reacción de hipersensibilidad y la explosión oxidativa se presenta, la formación de oxigeno que puede ayudar a las células vecinas vivas para la oxidación del ácido linolenico, siendo este último un precursor del ácido jasmónico por la ruta de los octadecanoides (Leszek, 2003). En algunas ocasiones se ha observado que a pesar que el AJ y etileno cooperan en la activación de la expresión de genes de defensa frente a patógenos o exposición a ozono, ambas señales hormonales pueden ser antagónicas en respuesta a heridas provocadas por fitófagos o daño mecánico (Rojo et al., 2003).
Estudios realizadas en plantas de tomate demostraron que no sólo la planta que los produce responde al estrés, sino también en plantas vecinas, esto debido a la presencia del éster volátil metil-jasmonato (Me-JA) (Ryan, 2000). Se ha observado que las plantas sanas expuestas a metil-jasmonato son capaces de acumular inhibidores de proteinasas de manera similar a las plantas dañadas por insectos, lo que sugiere que el metil-jasmonato volátil es transmitido por el aire. Estudios posteriores lograron descifrar que el ataque de órganos foliares por herbívoros causaba que un polipéptido de 18 aminoácidos, la sistemina, siendo liberado y transportado por el floema a otras hojas donde una lipasa de membrana induciría un incremento del ácido graso precursor del JA y éste a su vez induciría la expresión de genes que codifican a proteínas de defensa como los inhibidores de proteinasas ya mencionados Wasternack et al., 2006). La producción de sistemina una vez ocurrido el daño estaría siendo inducida por corrientes eléctricas (Peña, 2000). Debido a que no se ha logrado identificar la sistemina en la mayoría de las familias, se piensa que en éstas la inducción de JA ocurriría en forma más directa.
Se ha reportado que la acumulación del inhibidor de proteasas por la aplicación de AJ ocurre en diversas plantas, un ejemplo de esto es la alfalfa y el tabaco, estas responden positivamente a la exposición de Me-JA para acumular sus respectivos inhibidores de tripsina en las hojas (Wasternack, 2006). Por otra parte se ha demostrado que los precursores biosintéticos del AJ, como el ácido linolénico, también induce al inhibidor de las proteasas en hojas de diversos tejidos vegetales de forma similar al AJ y Me-JA (Abdala, 2006). Schweizer (1993), observo que el AJ protege eficientemente a la avena contra la infección por Erysiphe graminis f. sp. hordei, y de igual forma protege a las plantas de jitomate y papa contra Phytophthora infestan. Jaiti (2009), logro demostrar que el AJ tiene la capacidad para inducir la producción de polifenoloxidasa y peroxidasa en plántulas de palma datilera, siendo estas enzimas capaces de generar resistencia contra Fusarium oxysporum f. sp. albedinis.
La aplicación exógena de AJ y del Me-JA en una amplia variedad de plantas como lechuga, algodón (Omer et al., 2001), papa (Halim et al., 2006), tabaco y tomate (Thaler et al., 2001; Rohwer y Erwin, 2010) estimuló la resistencia directa contra los diversas clases de insectos. Esta resistencia directa de las plantas fue provocada por la reducción de la fecundidad, crecimiento y supervivencia de estos insectos (Stout et al., 2002). Se ha comprobado de igual forma que la adición exógena de estas fitohormonas induce la producción de néctares florales con propiedades insecticidas, por ejemplo en el algodón y Macaranga tanarius (Rodríguez-Saona et al., 2001; Heil et al., 2001; Liechti y Farmer, 2002). Cultivos de soya tratados con AJ lograron la activación de genes que codifican para enzimas como la fenilalanina amonio liasa y chalcona sintetasa. Estas proteínas intervienen en la defensa de vegetales contra patógenos, herbívoros y, así como en el estrés físico y químico (Rohwer y Erwin, 2008).
Una tendencia creciente es la aplicación de AJ es mediante extractos en medios acuosos sobre semillas, esto con la finalidad generar la protección de diversos tipos de cultivos con al menos diez semanas después de la germinación (Wasternack y Hause, 2002). De igual forma las semillas tratadas pueden ser almacenadas y sembradas en una etapa posterior. Se generó la hipótesis de que los extractos de AJ actúan como inmunizadores, generando de esta forma una protección a las plantas durante un período prolongado después del tratamiento (Wasternack, 2007).
Conclusiones
El ácido jasmónico es una hormona ampliamente estudiada debido a su participación en diferentes efectos fisiológicos en las plantas, como la inducción de resistencia local y sistémica de enfermedades. El AJ parece utilizar diferentes mecanismos para desarrollar la inducción de estas respuestas, aunado a que éste mismo interactúa de diferentes maneras con otras vías de señalización hormonal para generar la inducción de respuestas de defensa. Durante la última década se ha buscado la forma de acelerar la respuesta de la planta frente al ataque de un patógeno y una de las alternativas para este problema podría ser la aplicación de señalizadores de resistencia sistémica, lo que al mismo tiempo generaría una alternativa de protección biológica y ambiental, además de ser compatible a los métodos actuales de control de patógenos. Se espera que el uso del ácido jasmónico permita el acceso a un nuevo y poderoso agente de control de plagas que ayuden a la planta a defenderse contra sus enemigos. Sin embargo, se requiere aun de una serie de investigaciones en laboratorio y campo para comprender el comportamiento biológico de este ácido.











 texto en
texto en