Introducción
El Ustilago maydis (DC) Corda es un hongo basidiomiceto patógeno biotrófico, causante del carbón de maíz o huitlacoche. Su desarrollo se debe a la infección provocada por U. maydis en la región meristemática de la mazorca del maíz (Zea mays) inmaduro e induce la formación de tumores llenos de teliosporas diploides, conocidos también como agallas (Valverde el at., 1995; Salmerón-Santiago, 2011). Las agallas representan una fuente interesante de alimento, con buen contenido de proteínas, fibra y ácidos grasos como linoleico, linolénico y palmítico (Valverde el at., 1995). Martínez-Flores el at. (2008) reportaron que el aminoácido más abundante en el huitlacoche es la lisina con 27.2% del total de los aminoácidos esenciales. De hecho, se ha considerado como un alimento funcional de alta calidad (Valverde el at., 2012).
En la actualidad se busca mejorar la producción y conservación del huitlacoche para su consumo en fresco (Madrigal-Rodríguez el at., 2010; Aydogdu, 2015). Sin embargo, la principal desventaja es su corta vida de anaquel, tres o cuatro días, debido a su alta actividad metabólica, falta de cutícula y pérdida acelerada de agua, razón por la cual se consume fresco y en forma casi inmediata a su recolección o cosecha. De acuerdo con investigaciones previas, el metabolismo respiratorio del huitlacoche entero es elevado (> 300 ml CO2 kg-1 h-1) en condiciones normales de almacenamiento (20 ±2 ºC) y en ambientes refrigerados se puede disminuir hasta un 38% (10 °C) o hasta 22% (3 °C) respecto del ambiente normal (Martínez-Flores el at., 2008; Monroy-Gutiérrez el at., 2012).
El producto generalmente se comercializa desgranado (en agallas) en los mercados locales. Durante la actividad del desgranado, la cubierta externa (peridio) recibe esfuerzos de compresión que rebasan el límite elástico de la cubierta ocasionando daños mecánicos, además de exponer a las agallas individuales a las condiciones del aire del ambiente con mayor superficie de contacto. Esta situación genera cambios significativos en la velocidad de respiración y pérdida de peso debido a la deshidratación. Martínez-Flores el at. (2008) reportan perdidas de peso del orden de 30% en huitlacoche entero (mazorca) y hasta de 65% en producto desgranado (agallas) después de tres días de almacenamiento a la temperatura ambiente. El cambio visual más evidente en la agalla deshidratada es el cambio de color externo debido al rompimiento del peridio y la consecuente exposición del micelio del hongo (color oscuro). Estos cambios significativos en la deshidratación sugieren que el aire del ambiente de almacenamiento se mantenga con alta humedad relativa para minimizar el gradiente de concentración de humedad entre el aire y la superficie del peridio, ya que de ello depende en gran medida la velocidad de difusión del agua a través de aire.
El almacenamiento del huitlacoche en cámaras de alta humedad puede ser una alternativa para solucionar el problema de la deshidratación; sin embargo, esta condición puede favorecer la proliferación de la flora patogénica que pudiera hospedarse en la superficie del hongo, aunado con que el huitlacoche contiene altos niveles de azúcares libres (56.2-268 mg g-1, base seca) (Valdez-Morales el at., 2010), como la glucosa y fructosa, que son un medio de cultivo natural para el crecimiento de estos microorganismos. La concentración en azúcares libres es superior a lo que se reporta para granos de maíz híbrido normal y extra-dulce (Reyes el at., 1982) y en otras especies como papaya y banano (Torija el at., 1998). Por lo tanto, en la búsqueda de nuevas alternativas para prolongar la vida de anaquel del producto, es importante identificar los factores físicos y microbiológicos que coadyuvan a su rápida senescencia. En este contexto, el objetivo de este trabajo fue evaluar la influencia que tiene las condiciones de alta humedad relativa y temperatura de almacenamiento bajas sobre las propiedades físicas del huitlacoche y la presencia de los hongos fitopatógenos.
Materiales y métodos
Material vegetal
Las mazorcas enteras de maíz infectadas por el hongo del huitlacoche se compraron en la central de abasto de la Ciudad de México, aproximadamente 12 h después de haberse cosechado. En el laboratorio de experimentación, localizado en el Departamento de Ingeniería Agroindustrial de la Universidad Autónoma Chapingo, se realizó una selección eliminando la mazorca dañada. Se manejaron como unidades experimentales, la mazorca completa de maíz cubierta del hongo Ustilago maydis y grupos conformados por 10 agallas de huitlacoche, ambos seleccionados al azar.
Caracterización poscosecha
Se establecieron los siguientes tratamientos de acuerdo con la temperatura del aire del ambiente de almacenamiento: a) 3 ±2 °C, b) 10 ±2 °C y c) 20 ±2 °C. De cada tratamiento se midieron las siguientes variables durante un periodo de 20 días. El peso se midió en una balanza electrónica digital Ohaus (Adventurer™ Pro AV8101, Ohaus Corporation, Pine Brook, NJ USA). Con estos datos se calculó el porcentaje de pérdida de peso diario. El color se medió con colorímetro Hunter Lab® (modelo Mini Scan XE Plus núm. 45/0-L, Reston, VA, USA) en la superficie de las agallas y se reportan valores en la escala CIELab. Se midió la firmeza del peridio de las agallas con un analizador de textura Stable Micro System (Mod. TA-XT2i, Stable Micro Systems Ltd., Godalming, Surrey, UK) adaptado con un accesorio cónico de punta redondeada de 2.6 cm de diámetro y ángulo de 75°. Se midió la fuerza de compresión, con una distancia de deformación de 5 mm y una velocidad de ensayo de 5 mm s-1. Los resultados se expresan en newtons (N) (Monroy-Gutiérrez el at., 2012). Diariamente se tomaron fotografías y se realizaron anotaciones sobre los cambios observados visualmente en las agallas y mazorcas para evaluar la apariencia.
Diagnóstico e identificación de hongos patógenos
Para inducir el crecimiento de los microorganismos que albergan en la superficie de las agallas y mazorcas de huitlacoche, se tomaron muestras y se colocaron en cámaras húmedas que fueron colocadas a diferentes temperaturas (3, 10 y 20 ºC) hasta alcanzar el grado de descomposición (pérdida de firmeza y aparición de color oscuro y olores extraños). La cámara húmeda consistió en colocar una toalla de papel humedecida, con agua destilada esterilizada, sobre una charola de poliestireno expandido y sobre la toalla húmeda se colocaron las muestras de huitlacoche. Inmediatamente, la charola se colocó dentro de una bolsa de polietileno y se cerró herméticamente. La humedad relativa en el ambiente interno de la bolsa se mantuvo a 95% aproximadamente.
En la etapa de aislamiento de los microorganismos se tomaron porciones rectangulares de la parte sana y enferma de las agallas de 1 cm*0.5 cm cada una. Los cortes se desinfestaron con hipoclorito de sodio al 1.5% durante 1.5 min. Posteriormente, se enjuagaron con agua destilada esterilizada y se sembraron cuatro cortes en cada caja petri con medio de cultivo agar de papa y dextrosa (PDA). Tres días después de la siembra se observaron diferentes formas de crecimiento y coloraciones de hongos, los cuáles se aislaron y purificaron en cajas Petri con PDA. El aislamiento de los hongos se hizo con la técnica de punta de hifa utilizando el mismo medio de cultivo, donde previamente se agregaron riphampicina y cloranfenicol (500 ppm) para inhibir el crecimiento de bacterias (Rodríguez-Mejía, 2010). Las cajas se incubaron durante 72 h a 25 °C. Después de ocho días de la siembra se hicieron observaciones en el microscopio y se obtuvieron cultivos monoconidiales. Los aislamientos obtenidos se sembraron en PDA y se incubaron a 24 °C en luz blanca durante 15 días para incrementar el inóculo. La identificación de los hongos aislados se realizó por medio de sus estructuras morfológicas y características culturales con la ayuda de las claves de Barnett y Hunter (1998).
Asimismo, los hongos se identificaron por medio de la técnica de PCR-ITS (Polymerase Chain Reaction-Internal Transcribed Spacer), lo que dio una mayor confiabilidad a la identificación debido a la precisión de la técnica. Para ello, la extracción de DNA de los microorganismos se realizó ocho días después del crecimiento, de acuerdo con los métodos de Ahrens y Seemüller (1992) y Lee el at. (1993). La calidad del ADN se verificó en un gel de agarosa al 1% mediante electroforesis. El gel se observó en un transiluminador Bio Rad® (Bio Rad Laboratories Inc., CA, USA). La región interna ITS (ITS1 e ITS2) de los genes ribosomales RNA 18S-5.8S-28S se amplificó mediante PCR. Los iniciadores utilizados fueron ITS4 (TCCTCCGCTTATTGATATGC) e ITS5 (GGAAGTAAAACTCGTAACAAGG) (White el at., 1990).
La mezcla de reacción para PCR estuvo compuesta por amortiguador 1X, 1.5 mM (milimolar) de MgCl2, 1 U (unidad) de ADN polimerasa, 200 mM dNTP’S, 10 pm de iniciadores, 80 ng de muestra de DNA y agua desionizada esterilizada para ajustar un volumen final de 50 µL. La reacción se desarrolló en un termociclador Perkin Elmer (Mod. 2400, PerkinElmer Inc., Waltham, Massachusetts, USA) con el siguiente programa de amplificación: un ciclo de desnaturalización inicial (95 °C por 2 min); 30 ciclos de desnaturalización (95 °C por 1 min), alineación (50 °C por 30 s) y extensión (72 °C por 2 min); y una extensión final (72 °C por 10 min) (White el at., 1990). La calidad de la amplificación de los fragmentos se visualizó por electroforesis en un gel de agarosa al 1% en el transiluminador Bio Rad® (Bio Rad Laboratories Inc., CA, USA). La amplificación se purificó con el QIAquick PCR Purification Kit (QIAGEN® N.V, Venlo, Netherlands). Los genes se secuenciaron en dos direcciones 5’-3’ y 3’-5’con los iniciadores ITS4 e ITS5 (White el at. 1990). El secuenciador utilizado fue un ABI PRISM 3700 (Macrogen Inc., Seúl, Republica de Korea). Finalmente, las secuencias se analizaron en el software Lasergene 2001 versión 5 (DNAStar® Inc, Madison, Wisconsin, USA). La alineación se realizó en la base de datos del GenBank NCBI (National Center for Biotechnology Information).
Pruebas de patogenicidad
Las pruebas consistieron en inocular los hongos identificados en concentraciones conocidas sobe el huitlacoche desgranado (10 agallas) y en las mazorcas. Previo a la inoculación, las agallas y la mazorca se desinfestaron sumergiéndolos en una solución de hipoclorito de sodio al 1.5% por 3 min. y posteriormente, se enjuagaron con agua destilada esterilizada. El inóculo se preparó a partir de los cultivos monoconidiales de cada uno de los hongos identificados en la fase anterior (Fusarium oxysporum, Penicilium expansum y Rhizopus stolonifer), con los cuales se prepararon soluciones madre. Posteriormente, la concentración de los conidios se ajustó a 8*106 conidios mL-1 con ayuda de la cámara Neubauer (Marienfield, Laboratory Glassware, Kônigshofen, Alemania).
La inoculación de los hongos se hizo por deposición con herida y por deposición sin herida. En la primera, se realizaron incisiones de 2 mm de profundidad sobre las agallas y mazorcas, y con una aguja esterilizada se depositó 0.1 mL del inóculo. La deposición sin herida se hizo de manera directa sobre la superficie del producto inoculando la misma cantidad. Las mazorcas y agallas se colocaron en cámaras húmedas a 3, 10 y 20 ºC, con humedad relativa del 95 % durante ocho días. La cámara húmeda consistió en colocar el material en charolas de poliestireno expandido con una toalla de papel humedecida con agua destilada esterilizada dentro de una bolsa cerrada de polietileno. Se evaluaron las variables de incidencia y severidad de los hongos.
Análisis estadístico
Se empleó un diseño completamente al azar para el estudio de los cambios en la pérdida de peso, firmeza y color en el peridio del huitlacoche, así como el porcentaje de incidencia y severidad de los hongos. Se empleó un análisis de varianza de clasificación simple en la variable pérdida de peso y L* para determinar diferencias entre los factores grado de manipulación y temperatura de almacenamiento. Los resultados se presentan en la gráfica respectiva como la media de las observaciones con la respectiva barra de error estándar. Se aplicó un análisis de varianza multifactorial para determinar el efecto del factor (temperatura, manipulación y método de inoculación) sobre el porcentaje de incidencia y severidad de los hongos sobre el huitlacoche. Se empleó la prueba de Tukey (p≤ 0.001) para determinar las diferencias significativas con el software estadístico Statistical Analysis System for Windows 9.2 (SAS Institute Inc., Cary, NC, USA).
Resultados y discusión
Caracterización poscosecha
La temperatura de almacenamiento mostró influencia sobre la pérdida de peso en las agallas y mazorca del huitlacoche. En las agallas se observó una mayor velocidad de pérdida de peso en comparación con la mazorca entera (Figura 1). Técnicamente, en vegetales frescos, una pérdida de peso entre 5-10% es considerado no apto para la venta como producto fresco (Kays, 1991). A la temperatura del ambiente, tanto la agalla (ATA) como la mazorca (MTA) perdieron aproximadamente 8% de su peso después de uno y dos días de almacenamiento, respectivamente. A la temperatura de 10 ºC se observaron valores de pérdida de peso similares que en el tratamiento anterior en periodos de tiempo similares. A la temperatura de 3 ºC, tanto en agalla como en mazorca, la pérdida se mantuvo por debajo de 10% hasta por 4 días de almacenamiento.
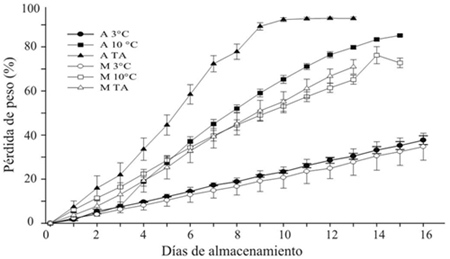
Figura 1 Pérdidas de peso en agallas (A) y mazorcas (M) de huitlacoche almacenadas a diferentes temperaturas.
En los días de almacenamiento subsecuentes, la tendencia continuó en un orden ascendente como sigue: 20 ºC>10 ºC>3 ºC y agalla (A)> mazorca (M) (Figura 1). Este comportamiento refleja que, además de los factores ambientales, el grado de manipulación del producto en el desprendimiento de la agalla y área superficial que queda expuesto al ambiente son un factor importante en la velocidad de deshidratación y que conducen a la senescencia del producto (Whitelock el at., 1999; Martínez-Flores el at. 2008). El almacenamiento del huitlacoche a 3 °C fue la mejor condición para mantener a un ritmo bajo la velocidad de deshidratación y mantener la calidad visual del producto un periodo de tiempo mayor.
Por otra parte, la firmeza de las agallas y las mazorcas se redujo durante el tiempo de almacenamiento postcosecha. Los tratamientos almacenados a temperatura ambiente mostraron mayor reducción en la fuerza de compresión del peridio, lo cual indica que la perdida de firmeza fue mayor en comparación con el material refrigerado. Los tratamientos almacenados a 3 y 10 °C no mostraron diferencias significativas (p≤ 0.05).
Los cambios de color y sabor en el huitlacoche, durante el periodo de almacenamiento, constituyen un parámetro de medida de la calidad (Tracy el at., 2007). En este sentido, Martínez-Flores el at. (2008) concluyeron que los cambios más significativos en el color fue la brillantez (L*) de la superficie del peridio del huitlacoche. En la Figura 2 que observa una disminución en la luminosidad durante los días de almacenamiento, encontrando diferencia significativa (p≤ 0.05), entre las temperaturas de almacenamiento, a partir del día seis cuya disminución fue de acuerdo con la siguiente relación 20 ºC> 10 ºC> 3 ºC.
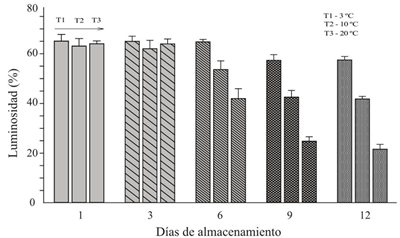
Figura 2 Promedio del porcentaje de luminosidad (L*) de agallas y mazorca, almacenadas a diferentes temperaturas.
El peridio del huitlacoche mostró un aspecto rugoso después de tres días de almacenamiento a temperatura ambiente, lo cual coincide con la manifestación de una alta pérdida de humedad (>10%) en el producto. Después de cuatro días hubo ruptura del peridio y como consecuencia liberación de teleosporas, aunque no hubo manifestación de olor desagradable que fuera indicio de pudrición (Figura 3). Esta apariencia visual es indicador de rápida senescencia en el producto, tal como fueron reportados por Martínez-Flores el at. (2008).
Apariencia visual
El almacenamiento a 10 ºC mostró un comportamiento similar que el tratamiento anterior; en tanto que, a 3 °C el peridio de las agallas desgranadas mostraron una apariencia visual aceptable por un mayor tiempo de almacenamiento (superior a 12 días) que la mazorca entera (Figura 3).
La prolongación en el tiempo de almacenamiento de la agalla desgranada a bajas temperaturas, a pesar del grado de manipulación que experimenta y mayor área superficial expuesta, indica la idea que la poca compactación de agallas de la mazorca entera deja espacios que funcionan como reservorio de humedad y microorganismos fitopatógenos que se encargan de iniciar los procesos de descomposición.
Diagnóstico e identificación de hongos patógenos
Las agallas se mantuvieron en cámaras húmedas a 3, 10 y 20 ±2 ºC para inducir el crecimiento de microorganismos. Tres días después del establecimiento del experimento se observó crecimiento de Fusarium sp., Penicilium sp. y Rhizopus sp., los cuales fueron identificados por sus características culturales y morfológicas con la ayuda de las claves de Barnett y Hunter (1998) y posteriormente corroborados mediante la técnica de PCR-ITS. En el Cuadro 1 se presenta la caracterización molecular de los hongos identificados, el género clasificado morfológicamente como Fusarium sp. corresponde a F. oxysporum con una similitud de 97%, el género Penicillium sp. a P. expansum con una similitud de 98% y el género Rhizopus sp. a R. stolonifer con 97% de similitud (%) por sus rasgos moleculares.
Pruebas de patogenicidad
Las especies de hongos, identificados previamente, F. oxysporum, P. expansum y R. stolonifer fueron inoculados en las agallas y mazorcas de huitlacoche, mediante las técnicas de punción y deposición, en tres temperaturas de almacenamiento. Se observó que los hongos no se desarrollaron en temperaturas de refrigeración (3 y 10 °C), excepto Rhizopus que a 10 °C tuvo una incidencia de 46% (Cuadro 2). El resultado indica que el riesgo de incidencia de hongos fitopatógenos en huitlacoche es menor en ambientes por debajo de los 10 ºC y alta humedad relativa. Esta condición de alta humedad en el ambiente de refrigeración resultaría benéfico pues contrarrestaría su acelerada velocidad de deshidratación (Whitelock el at., 1999).
Cuadro 2 Porcentaje de incidencia de Fusarium oxysporum, Rhizopus stolonifer y Penicillium expansum inoculados por herida (punción) y sin herida (deposición) en agallas desgranadas y en mazorcas de huitlacoche almacenadas a tres temperaturas en poscosecha.
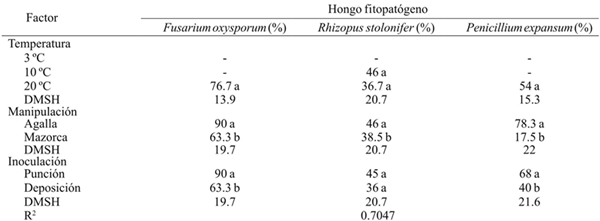
-= no se presentaron síntomas del hongo en el periodo de evaluación; DMSH= Diferencia mínima significativa honesta. Letras diferentes dentro de la misma columna corresponde a un factor indica que la media difiere significativamente (p≤ 0.001).
A la temperatura del ambiente, las tres especies inoculadas desarrollaron favorablemente con porcentaje de incidencia decreciente como sigue: R. stolonifer< P. expansum< F. oxysporum. No hubo diferencia significativa en el porcentaje de incidencia de R. stolonifer a 10 ºC y 20 ºC. El grado de manipulación mostró que la incidencia de las tres especies de hongo fue alta (p≤ 0.05) en la agalla que en mazorca, siendo de mayor incidencia la especie F. oxysporum (90%), seguido de P. expansum (78.3%) (Cuadro 2). Asimismo, el efecto del método de inoculación por punción fue mayor (p≤ 0.05) que el método de deposición, excepto en R. stolonifer. Thompson el at. (2013) reportaron que la pudrición en la mazorca de maíz se atribuye en gran medida a los hongos de la especie F. oxysporum, lo cual explica el alto porcentaje de incidencia de esta especie, sobre el hospedero de Ustilago maydis, en los tres factores estudiados. La especie F. oxysporum sobrevive en condiciones severas en el suelo, que lo convierte en un agente patógeno muy agresivo al momento de infestar a las plantas hospederas (Momma el at., 2010), aunque la invasión puede completarse en cualquier etapa poscosecha con la consecuente producción de toxinas (Logrieco el at. 2002; Agrios, 2005).
En otras especies de vegetales se ha observado que la patogenicidad de Penicillium y Fusarium no es tan severa cuando la inoculación se realiza sin herida (Hernández el at., 2006), lo cual resalta la importancia del grado de manipulación del huitlacoche, ya que en la agalla se presentó el porcentaje más alto de incidencia.
El porcentaje de severidad de P. expansum< R. stolonifer< F. oxysporum a la temperatura del ambiente (Cuadro 3). En las temperaturas de refrigeración no hubo efecto del hongo, excepto R. stolonifer con 8. 3% de severidad a 10 ºC. La manipulación del huitlacoche influyó en la severidad de la invasión de los hongos fitopatógenos, siendo que en la especie F. oxysporum hubo diferencia significativa (p≤ 0.001) con respecto a la mazorca entera. Esto sugiere que el esfuerzo aplicado sobre la agalla durante su desprendimiento manual del olote de maíz ocasiona daños en la superficie del peridio que favorecen la entrada del patógeno (Pérez-López el at., 2012).
Cuadro 3 Severidad de invasión de Fusarium oxysporum, Rhizopus stolonifer y Penicillium expansum, inoculados porn herida (punción) y sin herida (deposición) en agallas desgranadas y en mazorca de huitlacoche almacenadas a tres temperaturas en poscosecha.
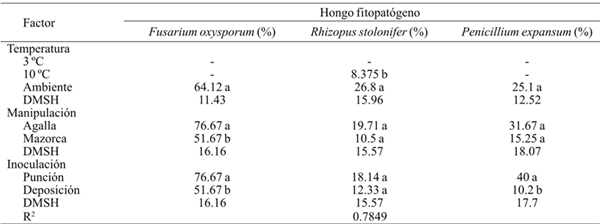
-= no se presentaron síntomas del hongo en el periodo de evaluación; DMSH= diferencia mínima significativa honesta. Letras diferentes dentro de la misma columna correspondientes a un factor indica que la media difiere significativamente (p≤ 0.001).
La severidad fue significativamente mayor (p≤ 0.001) en el método de inoculación por punción, en las especies F. oxysporum y P. expansum, que en inoculación por deposición. Los resultados indican que la incidencia y severidad en la invasión de las especies de hongos fitopatógenos incrementa conforme el grado de daño en el peridio es mayor, tal es que las especies P. expansum y R. stolonifer, que son considerados patógenos de herida, incrementan su nivel de severidad (Agrios, 2005).
La presencia de patógenos en productos frescos para consumo es indeseable. En la actualidad, existen alternativas de control en poscosecha como el control biológico que ayudan a reducir la incidencia y severidad de los patógenos. Guevara-Vázquez el at. (2009) aislaron e identificaron, mediante técnicas moleculares, levaduras asociadas al huitlacoche que pertenecen a las especies Candida railenensis, C. quercitrusa y Pichia guilliermondii. Estas especies han mostrado efecto antagónico contra algunos patógenos, especialmente P. guilliermondii que se ha evaluado contra especies de Rhizopus (Zhang el at., 2007; Zhao el at., 2010), Fusarium (Laitila el at., 2007) y P. expansum (Pacheco el at., 2008). La evaluación de las levaduras asociadas al huitlacoche para el control de los patógenos encontrados podría representar una oportunidad para el control efectivo de los mismos.
Conclusiones
Los factores desgranado del huitlacoche y la temperatura de almacenamiento ≥10 ºC afectan significativamente la pérdida de peso del huitlacoche, mientras que la temperatura de 3 ºC ayuda a mantener baja la tasa de deshidratación (<10%) y es favorable para mantener la calidad visual del producto en un periodo de tiempo mayor. Las técnicas de identificación empleadas revelaron, con una similitud de 98, 97 y 97% respectivamente, que las especies P. expansum, R. stolonifer y F. oxysporum son los patógenos que se hospedan en la superficie del hongo de huitlacoche en postcosecha. Las pruebas de patogenicidad confirmaron la severidad del daño, de dichas especies, en la calidad y vida de anaquel del huitlacoche. El hongo F. oxysporum fue el que mostró mayor porcentaje de incidencia y severidad en agalla almacenada a temperatura normal del aire del ambiente. La especie R. stolonifer mostró una alta incidencia en ambientes de refrigeración ≥10 ºC, lo cual sugiere que los ambientes más idóneos para el almacenamiento del huitlacoche son los cercanos a 3 °C con un alto porcentaje de humedad relativa (95%). Con ello se obtiene una velocidad de deshidratación menor en el huitlacoche, además de ofrecer condiciones que disminuyen los riesgos de desarrollo de hongos fitopatógenos en la superficie.











 texto en
texto en 




