Introducción
Entre las condiciones adversas de los sistemas agrícolas del mundo la salinidad de los suelos se ha convertido en el factor abiótico de mayor impacto en la productividad de las plantas (Setter et al., 2016). Actualmente más de 74% de los suelos dedicados a la agricultura a nivel mundial presenta problemas de salinidad (Zaki y Yokoi, 2016) y en muchos de los casos la conductividad eléctrica del suelo supera el índice de tolerancia de importantes especies económicas (Zhao et al., 2016) como el trigo (Triticum aestivum L.) que constituye la base de la alimentación de más de 96.4% de la población mundial (Argentel et al., 2016).
La evaluación del efecto del estrés salino en especies económicas como el trigo es de vital importancia para conocer y comprender los posibles mecanismos que éstas desarrollan en su adaptación a este factor abiótico. Sin embargo para la evaluación final y recomendación de variedades tolerantes la tarea primordial es la identificación de los principales caracteres asociados a dicha tolerancia (Argentel et al., 2013), los que una vez identificados y evaluados simplifican y aceleran el trabajo experimental en programas de mejora genética para el carácter tolerancia al estrés salino (Lamz et al., 2013).
Numerosos métodos se emplean para simular la tolerancia a la salinidad en condiciones in vitro una vez identificada la variabilidad genética del germoplasma disponible. En ocasiones, se han añadido al medio de cultivo soluciones de ciertas sustancias como manitol, polietilénglicol (González y Argentel, 2005) y cloruro de sodio para evaluar la respuesta a la salinidad (Munss et al., 2016). Precisamente mediante el cultivo in vitro de los tejidos vegetales es factible fisiológicamente determinar la respuesta de importantes variables que determinan la tolerancia al estrés como la selectividad de membranas (García et al., 2003), la síntesis y concentración de hormonas como el ácido abscísico (ABA), que regula la inducción de genes estructurales que codifican enzimas y proteínas involucradas en dicha tolerancia (Kadri et al., 2014).
Por ello su determinación y evaluación durante el cultivo de tejidos tiene importante significado práctico (Zaidi et al., 2016). Fue objetivo de la presente investigación evaluar el efecto de diferentes concentraciones salinas y tiempos de exposición al estrés en la permeabilidad de las membranas celulares, actividad de la enzima peroxidasa, concentración de proteínas solubles y síntesis de ácido abscísico, en tres variedades de trigo harinero: un progenitor y dos radiomutantes durante el cultivo de callos para su posible recomendación en el proceso de mejora genética mediante la técnica de inducción de mutaciones para la tolerancia al estrés salino.
Materiales y métodos
Desarrollo del experimento y variedades empleadas
Los experimentos se desarrollaron en el Centro de Estudios de Biotecnología Vegetal del Centro de Ingeniería Genética y Biotecnología, Habana, Cuba. Se utilizaron tres variedades de trigo harinero. La variedad Cuba-C-204 (progenitor), primera variedad de trigo obtenida en Cuba a partir de la variedad de trigo brasileña BH-11 (Gutiérrez et al., 2005) y dos variedades radiomutante INIFAT RM 26; INIFAT RM 29 obtenidos a partir de Cuba-C-204 (Argentel et al., 2012).
Etapa de formación de callos
Para la formación de callos se partió de semillas maduras previamente desinfectadas (Labrada, 1999). De cada variedad estudiada, se utilizaron 80 semillas y se cultivaron en medio de cultivo a base se sales MS. Se adicionaron los reguladores del crecimiento 2,4 diclorofenoxiacético (2,4-D; 2 mg L-1) y 6 Bencilaminopurina (BAP; 2 mg L-1) y las concentraciones de NaCl que representan conductividades eléctricas (CE) de 0.002 dS m-1 (tratamiento control); 5 dS m-1, 7 dS m-1 y 9 dS m-1. El medio de cultivo se ajustó a pH 5.8, se solidificó con agar Gelrite (2 g L-1) y se esterilizó en autoclave a 120 °C y 1.5 atmósferas de presión durante 20 min.
La siembra y la desinfección de las semillas se efectuaron en condiciones de asepsia en una cámara de flujo laminar. Se sembraron dos semillas por tubo de ensayo (15.5 cm * 2.3 cm), y se emplearon ocho tubos por cada tratamiento. Los tubos con las semillas se colocaron en una cámara de crecimiento en condiciones de oscuridad y una temperatura de 25±2 °C. Se establecieron tres repeticiones por cada variante experimental. Para cada variedad en las conductividades eléctricas se realizaron evaluaciones a las 24 h de exposición al estrés, a los 30 días y 70 días para evaluar el grado de variabilidad de respuestas en función del tiempo. Las variables evaluadas fueron las siguientes.
Permeabilidad de las membranas celulares (PMC)
La PMC se cuantificó en los callos obtenidos a las 24 horas, 30 días y 70 días de exposición al estrés. Se pesaron 0.05 g de callo de cada tratamiento en seis repeticiones y se lavaron cuatro veces con agua desionizada. Luego, los callos se colocaron en 5 mL de agua desionizada durante 20 h a 18 °C en la oscuridad. Después se evaluó la salida de electrolitos de las muestras sometidas a diferentes tratamientos de estrés, por la conductividad eléctrica de la solución al cabo de las 24 h. Se empleó un conductímetro (DD-IIA, China). La PMC se estimó con respecto al control siguiendo la metodología propuesta por Blum (1981).
Actividad peroxidasa
Se homogenizaron en un mortero, 0.25 g de tejido vegetal con 5 mL de tampón tris-HCl pH 7.4. El homogenato se centrifugó a 20 000 g durante 15 min. El sobrenadante se usó para determinar la actividad peroxidasa y se definió como unidad de actividad enzimática (UAE), un cambio de 0.01 en la absorbancia (420 nm) en 1 min por gramo masa fresca. La determinación, propiamente dicha, de la actividad peroxidasa se realizó según el método continuo descrito por Martínez (2013).
Contenido de proteínas solubles totales
El contenido de proteínas solubles totales se determinó por el método fotométrico. Una muestra de 1 g de material fresco se depositó en un mortero y se maceró. La extracción se realizó con 40 mL de una solución buffer de fosfato a pH 6.86 preparado a partir de fosfato de potasio, solución que se adicionó lentamente mientras se efectuaba la extracción. El extracto se decantó en tubos de centrifugación de 50 mL y se centrifugó a 10 000 revoluciones por minuto, durante un tiempo de 7 min. Finalmente la solución sobrenadante separada se trasvasó a matraces volumétricos de 50 mL. El contenido de proteína solubles totales fue cuantificado mediante fotometría de absorción en un espectrofotómetro Hewlett Packard 8452, a una longitud de onda de 750 nm (Galvani y Gaertner, 2006).
Contenido de ácido abscísico
Se tomó una masa de 5 g de callos de las variedades en cada concentración y tiempo de incubación al estrés y éstos se maceraron para realizar la determinación (extracción líquido-líquido) de ABA. La cuantificación de la fitohormona se realizó mediante una curva de calibración de ABA y su concentración final se expresó en µm g mf-1 usando un espectrómetro de masas (Bautista y Gallardo, 2008).
Análisis estadísticos
Los datos fueron procesados a través de análisis de varianza de clasificación simple basado en modelos lineales de efectos fijos (Fischer, 1935) sin interacción entre los factores conductividad/variedad/ tiempo de exposición al estrés salino. De manera independiente se evaluó la respuesta de cada variable entre conductividades eléctricas, medias que fueron comparadas por la prueba de comparaciones múltiples de Tukey (Tukey, 1960) para niveles de significación de 5% y 1%. Las comparaciones entre los tiempos de exposición al estrés salino de 30 y 70 días se realizaron intravarietalmente en cada nivel de conductividad eléctrica mediante la distribución teórica de probabilidades de t-student (Gosset, 1917) para niveles de significación de 5% y el 1%. Se utilizó para todos los análisis el paquete estadístico profesional Estatistica, versión 8.0 para Windows.
Resultados y discusión
Permeabilidad de las membranas celulares
La permeabilidad de las membranas celulares (PMC), no se afectó significativamente, aunque la tendencia fue a ascender, cuando los callos de las tres variedades fueron incubados por 24 h en las soluciones salinas (Figura 1).

Figura 1 Permeabilidad de la membrana celular (PMC) en callos de tres variedades de trigo harinero formados en medio salino por 24 h. R2= 0.822; 0.824; 0.831 para Cuba-C-204, INIFAT RM 26, INIFAT RM 29 respectivamente. ESx= 0.001 ns NS= no significativo.
Varios estudios tratan de explicar que condiciones de estrés salino se produce una estimulación de la actividad enzimática y la permeabilidad de membranas, tal fue el resultado aquí obtenido, aspecto al que se le conoce como efecto estimulante de la salinidad o euestrés (Bakry et al., 2012).
Los cambios en la permeabilidad de las membranas celulares (PMC) generalmente varían en dependencia del tiempo de exposición de los tejidos al estrés y del grado de tolerancia de las variedades y tiene variación entre los tipos de estrés hídrico y salino (Chávez et al., 2012). En el estudio se observó que a medida que se incrementó la conductividad eléctrica del medio de cultivo la permeabilidad de las membranas celulares disminuyó significativamente a partir de 30 días de exposición al estrés, quizás para evitar efectos adversos como la toxicidad iónica. La mayor disminución de PMC se obtuvo en los radiomutantes (Cuadro 1). La variedad progenitor presentó diferencias marcadas en respuesta al estrés salino impuesto y en el tiempo de exposición al estrés y los mayores valores de PMC a los 30 días, que denota que conforme incrementó el período de exposición al estrés disminuyó la PMC aunque en menor medida que los mutantes. Esta respuesta tiene un significado práctico porque ofrece la medida en que las membranas se hacen menos permeables a iones como el sodio y el cloro que pudieran propiciar toxicidad.
Cuadro 1 Permeabilidad de las membranas celulares en callos de tres variedades de trigo sometidas a diferentes conductividades eléctricas a 30 y 70 días de exposición al medio salino.

Medias con letras iguales no difieren según la prueba de comparación múltiple de Tukey HSD. ** y *= diferencias para el 5% y 1% respectivamente por t-student; Es(x)=error estándar de la media.
Otro resultado importante en los radiomutantes fue que aún en 9 dS m-1 los valores de PMC fueron similares a cuando el estrés se impuso durante las 24 h. Quizás este elemento sea debido al efecto de la radioinducción donde se muestra superdominancia de caracteres deseados como la tolerancia al estrés salino. En tal sentido se ha reportado que la inducción de mutaciones ha sido propuesta como una técnica biotecnológica efectiva para tales fines en otras especies vegetales (Oladosu et al., 2016). La evaluación de la PMC en tejidos foliares ha resultado un indicador eficiente para detectar variaciones en los niveles de tolerancia a los estrés salino e hídrico en diferentes genotipos de cereales (Munss et al., 2012).
Actividad peroxidasa
La actividad peroxidasa experimentó diferencias significativas respecto al control en los dos tiempos de evaluación en las tres variedades y la tendencia inicial fue al incremento, excepto para la variedad progenitor (Cuba-C-204) en la cual a los 9 dS m-1 tuvo el mismo valor de actividad enzimática que en control. La variedad INIFAT RM-26, mostró una respuesta similar en las diferentes concentraciones salinas y en el tiempo de exposición al estrés y sus valores fueron los más altos entre las tres variedades aunque a 9 dS m-1 el valor del indicador no mostró diferencias significativas al compararlo con lo obtenido para CE de 5 dS m-1. En la variedad progenitor la actividad peroxidasa no superó las 100 UAE min-1 a los 30 días de exposición mientras que a los 70 días se incrementó a más del doble de lo obtenido a 30 días. En sentido general la actividad peroxidasa fue superior en las variedades radiomutantes que en el progenitor (Cuadro 2). El incremento de la actividad peroxidasa en el presente estudio demuestra la capacidad protectora de la enzima para evitar el daño oxidativo causado directa o indirectamente por la salinidad.
Cuadro 2 Actividad de la enzima peroxidasa, en callos de tres variedades de trigo sometidas a diferentes conductividades eléctricas a 30 y 70 días de exposición al medio salino.
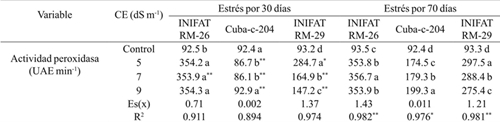
Medias con letras iguales en una misma columna no difieren según la prueba de comparación múltiple de Tukey HSD. ** y *= representan los tiempos de estrés, diferencias para el 5% y 1% respectivamente por t-student; Es(x)= error estándar de la media; R2= coeficiente de determinación sin ajustar.
Al analizar los valores del coeficiente de determinación para cada variedad en los dos tiempos de exposición al estrés evaluados se pudo observar que por efecto de la CE se explicó más de 89% de la variabilidad encontrada.
Se tienen evidencias de que en maíz expuesto al estrés hídrico y salino la actividad peroxidasa se incrementa significativamente originando la formación de radicales superóxido (O2 -) (Ahmad et al., 2016). El radical superóxido y su producto reductor peróxido de hidrógeno (H2O2) son compuestos potencialmente tóxicos que al combinarse forman un radical conocido como radical hidroxilo (OH) y se conocen como especies reactivas de oxígeno (ROS) (Zhang et al., 2016). Los genotipos tolerantes a estrés como la sequía y la salinidad presentan un sistema activo eficiente para evitar el daño oxidativo en función de la actividad peroxidasa (Young et al., 2012), quizás tal proceso se puso de manifiesto en el presente ensayo.
Concentración de proteínas solubles
La concentración de proteínas solubles totales fue similar en el tratamiento control en las tres variedades; sin embargo, se observó un incremento significativo cuando se elevó la concentración salina en las dos variedades radiomutantes pero su incremento fue solo hasta la CE de 5 dS m-1 cuando fue evaluada a los 30 días mientras que el progenitor incrementó el valor del indicador hasta los 9 dS m-1. El incremento obtenido fue de al menos 0.92 mg g mf-1 de proteínas cuando el período de incubación de los callos fue de 70 días, aspecto que denota las transformaciones bioquímicas significativas para tolerar la condición de estrés. Las mayores concentraciones de proteínas solubles se obtuvieron en el mutante INIFAT RM-26 aunque se observó que en la primera evaluación (a los 30 días de exposición al estrés) a partir de CE= 7 dS m-1 el valor del indicador evaluado disminuyó (Cuadro 3).
Cuadro 3 Concentración de proteínas solubles, en callos de tres variedades de trigo sometidas a diferentes conductividades eléctricas a los 30 y 70 días de exposición al medio salino.
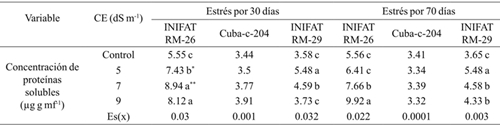
Medias con letras iguales no difieren según la prueba de comparación múltiple de Tukey HSD. ** y *= representan diferencias para el 5% y 1% respectivamente por t-student; Es(x)= error estándar de la media.
Una forma de mantener la estabilidad e integridad de las membranas celulares es a través del incremento en síntesis de proteínas estructurales. Este incremento se asocia con la síntesis de nuevas proteínas en condiciones de estrés (Valifard et al., 2012). Esto demuestra que las variedades estudiadas sintetizan nuevas proteínas como respuesta al estrés impuesto.
En condiciones de salinidad, en muchas especies de cereales, produce un incremento del contenido de proteínas solubles totales pero estos valores van descendiendo debido a la actividad de las proteasas para emplear aminoácidos para el recambio proteico, como fuente de energía, carbonada o nitrogenada (Mollasadeghi et al., 2011), además de emplear los aminoácidos para el incremento de la concentración de compuestos osmóticamente activos, entre otros prolina y glicina, glicina-betaína, y así asegurar la disminución del potencial osmótico y en consecuencia el potencial hídrico celular (Argentel et al., 2013).
Contenido de ácido abscísico (ABA)
La concentración de ABA se incrementó significativamente en los callos de las variedades en condiciones de salinidad del medio de incubación. Además se observaron diferencias entre sus concentraciones en los dos tiempos de incubación evaluados, siendo la mayor concentración a 70 días de estrés. Se encontraron incrementos de la concentración de ABA en más de 25 unidades en las conductividades eléctricas establecidas. La concentración de ABA fue similar para cada una de las tres variedades estudiadas cuando el tiempo de exposición a la salinidad fue de 70 días a las conductividades eléctricas de 7 dS m-1 y 9 dS m-1 (Figura 2).
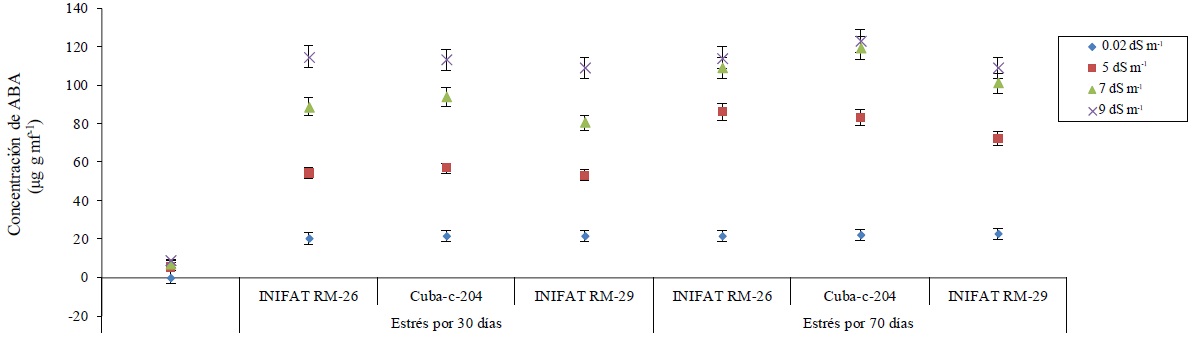
Figura 2 Concentración de ABA en callos de tres variedades de trigo sometidas a diferentes conductividades eléctricas a los 30 y 70 días de exposición al medio salino.
En la mayoría de las plantas superiores la biosíntesis del ABA se realiza, por vía indirecta, o sea, por degradación de algunos carotenoides (C40) presentes en cloroplastos (Wang et al., 2016); sin embargo, los resultados aquí mostrados demuestran que su síntesis ocurrió plenamente en callos, no en células vasculares ni a partir de carotenoides, quizás sí a partir de precursores no pigmentados quedando demostrada la capacidad de sintetizar ABA por cualquier célula vegetal en condiciones de estrés salino.
Entre los efectos que produce el ABA en las plantas además de la regulación y apertura estomática (Fujita et al., 2011), latencia en yemas (Nakashima y Yamaguchi-Shinozaki, 2013) y semillas (Kadri et al., 2014), ocurre la inhibición de las síntesis de RNA y algunas proteínas (Alhasnawi et al., 2016). Por ello sería interesante probar si a partir de callos con altas concentraciones endógenas de ABA, como en el presente estudio, se afecta la capacidad de regeneración de plantas.
Los resultados de las variables bioquímicas evaluadas en el presente estudio muestran el efecto de la inducción de mutaciones para crear variabilidad de respuesta y superdominancia a partir de variedades consideradas como tolerantes en la producción agrícola en condiciones de estrés como el salino (Jimenez et al., 2016). Actualmente los programas de mejora genética se enmarcan en la creación, identificación y caracterización de dicha variabilidad mediante técnicas rápidas y precisas como la inducción de mutaciones, dado que la mejora por cruzamiento para condiciones de estrés abióticos en general es un proceso largo (Oyiga et al., 2016) y en ocasiones cuando se obtiene una variedad promisoria ya las condiciones edáficas han cambiado y la nueva variedad no expresa su potencial genético productivo (Al-Mashhadani et al., 2016).
El estudio realizado constituyó una vía factible y eficiente para determinar el efecto del estrés salino en estos tejidos y al mismo tiempo definir la variabilidad de respuesta de los mutantes respecto a su progenitor, los cuales mostraron mayor tolerancia. La caracterización de estos radiomutantes permitirá su recomendación como futuros parentales para la mejora genética ya que su permeabilidad disminuyó incluso cuando las concentraciones salinas fueron altas, al mismo tiempo demostraron desarrollar mecanismos para mitigar el estrés salino mediante la síntesis de compuestos osmóticamente activos para asegurar un buen estado hídrico e impedir la sequía fisiológica que se presenta en condiciones de estrés salino.
Conclusiones
La salinidad propició variaciones significativas en las variables evaluadas, siendo la permeabilidad de las membranas celulares y la concentración de ácido abscísico las más afectadas. Tales características demuestran tolerancia, y pueden ser utilizadas en el mejoramiento genético por la capacidad de evitar la toxicidad iónica mediante el incremento de su selectividad.
Los callos de los radiomutantes evaluados presentaron mejor respuesta al estrés salino impuesto en el medio de cultivo y los resultados más favorables se obtuvieron hasta la conductividad eléctrica de 7dS m-1 en ambos tiempos de exposición, demostrando la tolerancia a éste tipo de estrés a corto y mediano plazo de exposición hasta éste nivel de CE y el efecto positivo de la inducción de mutaciones para mitigar los efectos adversos del estrés salino.











 texto em
texto em 


