Introducción
En 2011, las plantas de agave representaron una fuente de ingreso para un total de 4 407 productores magueyeros de la “región del mezcal” que abarca siete distritos políticos (Antonio y Terán, 2008; Snidrus y Oeidrus 2011). Se utilizan alrededor de nueve especies de agave de las cuales Agave angustifolia (maguey espadín) es la de mayor demanda y la única que se cultiva de forma significativa (Cruz et al., 2013), las ocho restantes son colectadas de poblaciones silvestres o semi-cultivadas principalmente en cercos vivos con poco o nulo manejo cultural. Tal es el caso del Agave americana var. oaxacensis conocido comúnmente como maguey “arroqueño”.
Los individuos de las poblaciones de esta especie están disminuyendo cada vez más, debido a diversos factores en los que se incluye su tasa de crecimiento muy lenta (tarda de 15 a 20 años en llegar a la madurez para cosecha); el cambio de uso de suelo y la dificultad para su reproducción ya que campesinos eliminan el escapo floral cuando éste inicia su crecimiento, para evitar que la planta consuma los azúcares acumulados en el tallo o piña; pero, con esto se evita la producción de semillas (Enríquez-del Valle, 2008; Ángeles, 2010).
Desde cualquier punto de vista es muy importante generar alternativas de reproducción. La mayoría de los agaves se pueden propagar mediante la germinación de semillas, vástagos de rizoma, bulbilos de la inflorescencia, y por métodos no convencionales como la micropropagación a través de la técnica de cultivo de tejidos vegetales, que es eficiente para lograr la multiplicación de una gran cantidad de plantas a partir de células y tejidos somáticos que se establecen en un medio de cultivo formado por carbohidratos, vitaminas, aminoácidos, hormonas de crecimiento, sales inorgánicas tanto macronutrimentos como micronutrimentos, sustancias de soporte físico y agua (Hartman y Kester, 1994; Enríquez-del valle, 2008). El proceso de micropropagación consta de varias etapas:1) establecimiento de cultivos asépticos; 2) multiplicación de propágalos; 3) enraizado de brotes; y 4) aclimatación de las plántulas (George y Debergh, 2008; Enríquez-del Valle, 2008). Esta última etapa citada es considera crítica para la mayoría de las especies; y en el caso de plantas de agave micropropagadas, se han reportado altos porcentajes de sobrevivencia. Abreu et al. (2007), reportan 90% de sobrevivencia en A. fourcroydes; Enríquez-del Valle y Cruz-Valdez, (2012) 100% para Agave angustifolia Haw.
Con el objetivo de obtener plantas de buena calidad se ha puesto especial interés al tipo de sustrato y disponibilidad de nutrientes que requieren las plantas durante su proceso de aclimatación, durante el cual deben asumir cambios en sus características morfológicas y fisiológicas que les permitan continuar con su crecimiento y desarrollo al momento de establecerlas en campo, en donde las condiciones ambientales son poco favorables (Enríquez-del Valle et al., 2009). Entre los cambios morfológicos ocurridos durante el proceso de aclimatización se encuentra el reemplazamiento de las hojas formadas en el ambiente in vitro, por hojas nuevas (Zimmerman, 1991; Pospisilova, et al., 1999), debido a que las hojas formadas en el ambiente in vitro presentan deficiencias morfológicas y fisiológicas, entre ellas se menciona que son muy frágiles, delgadas, estomas poco funcionales, cutícula muy delgada y poco desarrollada, elevada tasa de transpiración, baja tasa fotosintética (Pierik, 1990; Zimmerman, 1991).
Sin embargo, la información que existe sobre este proceso de reemplazo de las hojas formadas in vitro, así como los factores que influyen durante el proceso de aclimatización de las plantas micropropagadas es escaso. Debido a que la respuesta o aclimatación de las plantas depende del manejo que se le proporcione, en este estudio se evalúo el efecto del tipo de sustrato y la dosis de fertilización, sobre el comportamiento foliar que ocurre en las plantas micropropagadas de Agave americana var. oaxacensis durante su aclimatación.
Materiales y métodos
La investigación se realizó durante el periodo de septiembre de 2011 a agosto de 2013, en el laboratorio de cultivo de tejidos vegetales e invernaderos del Instituto Tecnológico del Valle del Oaxaca, ubicado en Nazareno, Xoxocotlán, Oaxaca. Mediante la micropropagación, a partir de brotes de tejido de tallo, que fueron sometidos a procesos de multiplicación y su posterior enraizado, se obtuvieron plantas de Agave americana var. oaxacensis, las cuales tenían en promedio 6.75 hojas, 5 raíces, 9.78 cm de longitud de la hoja más larga con 0.64 cm de ancho. Se trasplantaron a macetas de polietileno con capacidad de 171 cm3, los sustratos se elaboraron con turba y arena en diferente proporción (1:2, 2:1, 3:1) en relación con su volumen.
La aclimatización de las plantas se realizó en un invernadero con radiación solar disminuida a 50%, temperatura de 24 a 28 °C, humedad relativa alta 80-90% y recibieron una vez por semana 10 mL de la Solución Universal Steiner (1984) a 10% de concentración de nutrimentos, en estas condiciones se mantuvieron durante 45 días, posteriormente se trasladaron a un segundo invernadero con mayor radiación solar, temperatura de 20 a 38 °C, humedad relativa baja y la aportación de la solución Steiner a nivel de sustrato, se aplicó tres veces por semana de acuerdo a los tratamientos establecidos, hasta finalizar el experimento.
Durante el desarrollo del experimento se le dio seguimiento a las hojas formadas en condición in vitro y a las hojas formadas en condición ex vitro. Para diferenciarlas se marcaron con hilo cáñamo de color rojo y amarillo. Se registraron datos de crecimiento en longitud y ancho de las hojas, cada 30 días a partir del inicio de la aclimatización de las plantas en invernadero. Otras de las variables evaluadas fueron el recambio de hojas, es decir, número de hojas formadas en condición in vitro y número de hojas senescentes o perdidas formadas en condición in vitro.
Los datos registrados para cada variable de estudio, se sometieron a un análisis de varianza. Se realizó la comparación de medias de Tukey con un nivel de significancia al 95% (α= 0.05) mediante el paquete estadístico SAS (The SAS System for Windows 9.0). Con los datos obtenidos se elaboraron cuadros, gráficas y figuras.
Resultados y discusión
Senescencia o pérdida gradual de hojas formadas en ambiente in vitro
Durante el proceso de aclimatización, las plantas pasan de un ambiente de baja traspiración a otro que exige una mayor demanda hídrica. Sin embargo, en las plantas cultivadas in vitro la raíz tiene escasa conexión con el tallo y son muy frágiles, lo que según Fila et al. (1998); Hazarika, (2006) ocasiona que al establecerlas en los sustratos se rompan, por lo tanto se impide el trasporte eficiente de agua y nutrientes. La baja asimilación de agua y de nutrientes, aunada a la morfología de las hojas que son muy delgadas, escaso desarrollo de la cutícula y poca o nula acumulación de ceras, influyen en su comportamiento durante su aclimatización. Pospíšilová et al. (1999), mencionan que las hojas que forma la planta en condición in vitro, no son capaces de continuar su desarrollo cuando se trasfieren al ambiente ex vitro.Fuentes et al. (2005), mencionan que las hojas producidas in vitro actúan como estructuras almacenadoras de nutrientes, que sostienen el crecimiento de las nuevas hojas desarrolladas ex vitro.Quesada y Valpuesta (2004), indican que la senescencia y posterior pérdida foliar no es sólo un proceso degenerativo, sino también un proceso de reciclaje en el que los nutrientes son trasportados desde las células que envejecen a las hojas jóvenes.
Las plantas de Agave americana var. oaxacensis estudiadas mostraron cambios en su morfología cuando se expusieron a mayor radiación solar; esto ocurrió después de los 45 días de aclimatización. Uno de los primeros síntomas que adquirieron las plantas como respuesta al inicio de la pérdida de sus hojas formadas in vitro, fue el cambio de color verde a púrpura (Figura 1). Esta coloración se presentó en primer lugar en las hojas inferiores de mayor edad, manifestándose en la parte distal y posteriormente expandiéndose por toda la lámina foliar. El color purpura de las hojas se debió a la presencia de antocianinas. La acumulación de antocianinas en las hojas puede deberse a múltiples factores de estrés, entre los que se destaca la alta irradiación y la deficiencia de nutrientes (Peng et al., 2008). En hojas senescentes, donde la movilización de nutrientes hacia otros órganos se incrementa, la acumulación de antocianinas permitiría minimizar el potencial por daño foto-oxidativo (Hoct et al., 2003).

Figura 1 Cambios en la morfología de las plantas de A. americana var. oaxacensis, por la pérdida y formación de hojas nuevas durante su aclimatización en invernadero.
Dentro de los cambios más importantes a los que tienen que adaptarse las plantas producidas in vitro, es al aumento gradual de la intensidad luminosa. Una vez que las plantas micropropagadas son transferidas al ambiente ex vitro, estas resultan altamente susceptibles a la fotoinhibición (Osorio et al., 2010).
La pérdida de las hojas formadas en condición in vitro fue gradual, siendo las inferiores de mayor edad las que murieron primero. En general las plantas sustituyeron todas sus hojas formadas in vitro en un lapso de 240 días. Esto coindice con lo mencionado por Pyung et al. (2007), quienes mencionan que la degeneración de las células en el tejido es lenta, debido a que la planta asegurará la translocación de las macromoléculas hacia los sitios de demanda como formación de hojas nuevas, frutos o yemas de crecimiento. También podría ser por el tipo de especie, ya que los agaves presentan tasas de crecimiento bajas, además sus hojas son duras, carnosas, fibrosas etc, lo cual hace más lenta la degeneración de sus tejidos, así como también la capacidad de renovación de los mismos.
En este estudio, el tiempo que tardaron las plantas en perder sus hojas fue diferente. Las plantas que se establecieron en el sustrato que tenía una porción de turba combinado con dos de arena y que además recibieron fertilización diferente, perdieron más rápido sus hojas en un tiempo de 180 días, en comparación con las plantas que se establecieron en el sustrato con dos y tres porciones de turba combinados con una de arena y que además recibieron fertilización, las cuales perdieron sus hojas formadas en condición in vitro, en un tiempo de 240 días. A los 90 días, las plantas establecidas en el sustrato con una porción de turba combinado con dos de arena y que además recibieron fertilización diferente, habían perdido el 50% de sus hojas totales, en cambio las plantas establecidas en los sustratos con dos y tres porciones de turba y que además recibieron fertilización diferente, habían perdido 30.2 y 33.15% del total de sus hojas formadas en condición ex vitro, respectivamente (Cuadro 1).
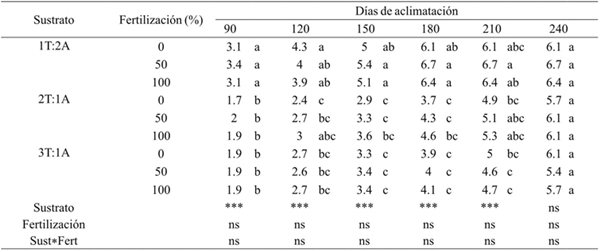
T= turba; A= arena; ***= valor de F altamente significativo (p≤ 0.01); ns= valor de F no significativo (p≥ 0.05). Medias con letras iguales no son estadísticamente diferentes (Tukey, 0.05).
Cuadro 1 Efecto del sustrato y fertilización sobre la senescencia de hojas de A. americana durante su aclimatización en invernadero.
Por otra parte, al duplicarse el tiempo de aclimatación es decir, a los 180 días se observó la pérdida de 100% de las hojas formadas in vitro en las plantas que se establecieron en el sustrato con una porción de turba combinado con dos de arena y que además recibieron fertilización diferente. En cambio, para las plantas establecidas en los sustratos con dos y tres porciones de turba y que además recibieron fertilización diferente, habían perdido en promedio 0.46 y 68.8% del total de sus hojas formadas in vitro respectivamente.
De acuerdo con el análisis de varianza, el factor sustrato tuvo efectos significativos (p≤ 0.01) sobre el descenso o pérdida de hojas formadas in vitro, durante su aclimatación a los 90, 120, 150, 180 y 210 días. En cambio el factor fertilización no influyó en la pérdida de las hojas formadas in vitro durante los días evaluados, ni la interacción sustrato-fertilización.
Los análisis de comparación de medias mostraron que hubo diferencia significativa sobre el número de hojas perdidas por las plantas establecidas en los diferentes tratamientos. A 90 días de aclimatación las plantas que habían perdido mayor de 3.2 hojas en promedio, fueron las que se establecieron en los sustratos con una porción de turba combinado con dos de arena y que recibieron fertilización diferente, mientras que las plantas que se establecieron en los sustratos con dos y tres porciones de turba, habían perdido un promedio de 1.8 hojas. Este comportamiento fue similar a los demás días evaluados durante la aclimatación. Los sustratos en los que las plantas perdieron más rápido sus hojas formadas in vitro, fueron los compuestos por una porción de turba combinado con dos de arena y que además recibieron fertilización diferente (Cuadro 1).
Las plantas que se establecieron en los sustratos con dos y tres porciones de turba combinado con dos de arena y que se les aplicó fertilización diferente, se vieron favorecidas ya que el total de sus hojas que habían formado durante su cultivo in vitro las sustituyeron por hojas nuevas, 60 días después en comparación con las plantas establecidas en los sustratos con una porción de turba combinado con dos de arena.
Lo anterior denota que la senescencia y posterior pérdida de las hojas formadas in vitro fue más lento en las plantas que se establecieron en un sustrato con mayor proporción de turba combinado con arena. La permanencia de las hojas formadas in vitro por más tiempo favoreció la generación de hojas nuevas en la planta.
Formación de hojas nuevas en ambiente ex vitro
Durante la aclimatación, las plantas micropropagadas generan hojas nuevas con características similares a las plantas que crecen en un ambiente natural. En el caso de las plantas de Agave americana var. oaxacensis, se observó que las primeras hojas que se generaron ex vitro, presentaron una capa ligera de ceras, lo cual les dio una tonalidad grisácea; además comenzaron a adquirir dureza. Sin embargo, estas hojas aún no habían adquirido las características de una planta que crece en condiciones ambientales naturales. En esta investigación, se observó que a partir de la segunda o tercer hoja nueva que se formó ex vitro, presentaron una capa más densa de ceras, carnosas, rígidas, duras y presencia de espinas en los bordes de las hojas (Figura 2), lo cual difiere de las primeras hojas que generaron las plantas.

Figura 2. Morfología de hojas nuevas de plantas de A. americana generadas durante su aclimatización en invernadero.
Lo anterior denota que el cambio es gradual y conforme avanzan los días de aclimatización, la planta presenta cambios en sus hojas como respuesta al proceso de adaptación. Los agaves poseen características morfológicas, anatómicas y fisiológicas como el desarrollo de suculencia o engrosamiento en hojas, cutícula gruesa y el depósito de distintas capas de ceras sobre la superficie epidérmica y metabolismo CAM, que les han permitido crecer y desarrollarse en ambientes poco favorables (García-Mendoza, 2007).
El crecimiento y desarrollo de las hojas va a depender del tipo de sustrato y disponibilidad de nutrientes. En base a los análisis de varianza, el factor sustrato tuvo efectos significativos (p≤ 0.01) sobre el número de hojas nuevas formadas a los 90, 120, 150, 180, 210 y 240 días de aclimatización. Mientras que el factor fertilización mostro significancia estadística en su efecto sobre la característica mencionada, a partir del día 180 hasta los 240 días de aclimatación. En cambio, la interacción sustrato-fertilización mostraron efectos significativos sobre el número de hojas nuevas formadas a los 150, 180 y 240 días de aclimatación (Cuadro 2).
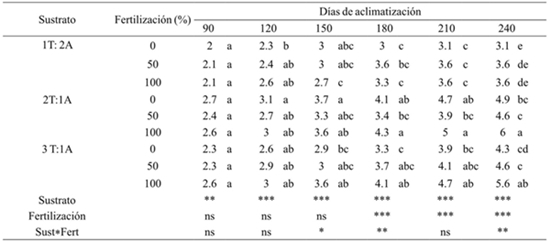
T= turba; A= arena; ***= valor de F altamente significativo (p≤ 0.01); ns= valor de F, no significativo (p≥ 0.05). Medias con letras iguales no son estadísticamente diferentes (Tukey, 0.05).
Cuadro 2 Efecto del sustrato y fertilización sobre la formación de hojas nuevas de A. americana durante su aclimatización en invernadero.
Los análisis de comparación de medias mostraron que hubo diferencia significativa sobre el número de hojas nuevas generadas en las plantas establecidas en los diferentes tratamientos. A 90 días de aclimatación las plantas establecidas en los diferentes tratamientos habían generado la misma cantidad de hojas en promedio (2.18). Sin embargo, a 180 días la diferencia entre las plantas fue notoria. Las que se establecieron en sustrato con dos porciones de turba combinado con dos de arena y además con fertilización al 100% habían formado el mayor número de hojas (4.3), mientras que el menor número de hojas (3), lo presentaron las plantas establecidas en sustratos con una porción de turba combinado con dos de arena sin fertilización.
A 240 días de aclimatación, las plantas establecidas en los sustratos con dos y tres porciones de turba combinado con poción una de arena y que además recibieron fertilización diferente, habían formado 32% más hojas respecto a las plantas establecidas en los sustratos con una porción de turba combinado con dos de arena y que recibieron fertilización diferente.
De manera general, se observó que las plantas generaron mayor cantidad de hojas cuando se aplicó a nivel de sustrato la solución nutritiva con 100% de concentración de nutrimentos. Lo que indica que el sustrato no alcanza a cubrir las necesidades nutrimentales y que cuando se adiciona solución nutritiva, las plantas mejoran su condición. Esto concuerda con Enríquez-del Valle et al., (2012), quienes menciona que al finalizar la etapa de aclimatización de A. angustifolia, el nivel de desarrollo de las plantas y la acumulación de N, P y K se incrementaron en relación directa a la concentración de nutrimentos en la solución nutritiva, hasta el óptimo al 66 y 100%.
Conclusiones
Las plantas micropropagadas sustituyen o reemplazan las hojas formadas in vitro como una estrategia de adaptación fisiológica para su crecimiento y desarrollo, ya que las hojas nuevas formadas en condiciones ex vitro adquieren características fenotípicas que caracterizan a la especie de agave. La disponibilidad de nutrimentos determina el recambio de las hojas, en este caso el aporte de materia orgánica en mayor cantidad, mediante un sustrato como la turba y la fertilización adicional, favorece la relación entre perdida y formación de hojas haciéndola gradual.











 texto en
texto en 


