Introducción
La horticultura ornamental en México juega un papel importante en la diversificación de la agricultura, por lo que en la actualidad se busca la producción de especies con alto potencial productivo y económico. El lisianthus (Eustoma grandiflorum [Raf.] Shinn) es una buena opción; ya que es una flor que por su belleza, sus intensos colores y larga vida en florero, cada día cobra mayor importancia en el mercado (Mazuela et al., 2007); esta ornamental es prácticamente nueva en el mercado nacional, con un gran potencial de comercialización, tanto para consumo interno como para exportación; así como para planta en maceta o de corte.
La superficie cultivada que se reporta en el país es de aproximadamente 4 ha, las zonas productoras son Arteaga, Coahuila; Zacatepec, Morelos; Villa Guerrero, Estado de México; Tecamachalco, Puebla y Guadalajara, Jalisco (SAGARPA-SICDE, 2010).
Los programas actuales de fertilización deben estar basados en la demanda de nutrimentos de cada cultivo durante sus etapas fenológicas. Esta demanda está dada por su producción de biomasa y las concentraciones totales de nutrimentos en los tejidos de la planta (Rodríguez et al., 2001). Las curvas de extracción nutrimental determinan la cantidad de los elementos extraídos por una planta durante su ciclo de vida. Con esta información es posible conocer las épocas de mayor absorción de cada nutrimento y se puede definir un programa de fertilización específico, para cubrir las necesidades de cada una de las especies, considerando tanto la cantidad como la fase fenológica apropiada (Bertsch, 2003); lo que reduce el uso de agroquímicos y mejora la eficiencia de utilización de nutrimentos y agua, con un impacto ambiental muy bajo.
Por lo reciente del cultivo del lisianthus, se desconocen sus necesidades nutrimentales y en consecuencia, el manejo nutrimental es incompleto y algunas veces contradictorio, basado principalmente en la fertilización con nitrógeno, fósforo y potasio (Gill et al., 2003; Dole y Wilkins, 2005), además de que dicho manejo se propone para condiciones muy diferentes a las de los productores nacionales.
Por lo que la presente investigación tuvo como objetivos: evaluar la acumulación y distribución de biomasa, la extracción y distribución nutrimental y determinar la etapa de mayor demanda nutrimental en lisianthus cv. Mariachi Pink.
Materiales y métodos
Localización. El presente trabajo se realizó en un invernadero con cubierta de vidrio de la Universidad Autónoma Chapingo, el cual se localiza a una altitud de 2 240 m y a 19 °29’ de latitud norte y 38° 53’ de longitud oeste.
Material vegetal. Se utilizaron plantas de lisianthus cv. Mariachi Pink, obtenidas en semillero de la empresa Plántulas de Tetela S. de R. L. de C. V. El cultivo se estableció en suelo, cuyas características físicas, químicas y de fertilidad se presentan en el Cuadro 1. Cuando las plántulas presentaron 3 a 4 pares de hojas se trasplantaron en una cama baja de 1 x 3.8 x 0.4 m, distribuidas de la siguiente manera: 17 cm entre hileras y 12 cm entre plantas, lo que resultó en una densidad de 186 plantas en una superficie total de 4 m2 (46.5 plantas m-2). Las plantas no se fertilizaron debido a que el suelo presentó buena fertilidad. La temperatura promedio en el invernadero fue de 23 °C y 62% de humedad relativa.

Cuadro 1 Características del suelo utilizado en el cultivo de lisianthus cv. Mariachi Pink en invernadero.
Muestreos. Cada muestreo consistió de 25 plantas (con competencia completa, que no estuvieran en orillas) seleccionadas aleatoriamente, en cada una de las cuatro etapas fenológicas identificadas a lo largo del ciclo del cultivo. El primer muestreo se realizó a los 45 días después del trasplante (ddt), fin de la etapa de arrosetamiento, con poco alargamiento del tallo; el segundo a los 60 ddt, fin de la etapa de alargamiento de los tallos y formación de brotes secundarios; el tercero a los 90 ddt, formación de botones florales y alargamiento de pedúnculos, y el cuarto a los 140 ddt, apertura de la primera flor (punto de cosecha).
Manejo de muestras. Las plantas se separaron en parte aérea (tallo y hojas), raíz y flores, se secaron por separado hasta peso constante en una estufa con aire circulante a 65 °C en un horno marca Binder®.
Variables evaluadas. Una vez secas las muestras, en las 25 repeticiones de cada muestreo, se registró el peso seco (acumulación de biomasa) de cada órgano de la planta, en una balanza digital Ohaus®. En seguida, las muestras se molieron en un molino de acero inoxidable Wiley modelo 4 con tamiz del 20 y se procedió a hacer la determinación, por órgano, de N, P, K, Ca, Mg, Fe, Cu, Zn, Mn y B. Para esto se formaron tres repeticiones mezclando la biomasa molida de cada órgano provenientes de ocho plantas por muestreo. La digestión de la biomasa se hizo con 4 mL de una mezcla de ácido sulfúrico (H2SO4) y ácido perclórico (HClO4) en relación 2:1(v/v) y 2 mL de peróxido de hidrógeno (H2O2) al 30 %; al final se aforó a 50 mL con agua desionizada. La determinación de nitrógeno se realizó por el método microkjeldahl y la de los elementos adicionales con un espectrofotómetro de emisión atómica de plasma por inducción acoplada ICP-AES de Varian (Australia). En todos los casos se siguió la metodología descrita por Alcántar y Sandoval (1999).
La unidad experimental estuvo constituida por una planta para el registro del peso seco, con un total de 25 repeticiones por órgano y muestreo. Para la determinación nutrimental se tuvieron tres repeticiones, igualmente por órgano y muestreo; la unidad experimental fue una muestra compuesta que se formó como se indicó anteriormente.
Con los datos de peso seco se calcularon la acumulación de biomasa total por órgano, el porcentaje que representó, el total por planta y por m2. Con los datos nutrimentales se calculó la extracción total de cada nutrimento por órgano, por planta, el porcentaje y el total por m2. Las gráficas se elaboraron con el paquete SigmaPlot 12.5.
Resultados y discusión
La acumulación de biomasa en la planta se fue incrementando a través de las etapas de estudio, el total registrado a los 45 ddt (0.32 g planta-1, 6.5%) se incrementó 15 veces a los 140 ddt, en donde alcanzó un total de 4.97 g planta-1. Durante la formación de los botones florales (90 ddt), la planta acumuló 28% de su biomasa; el restante 72% se formó durante el engrosamiento de los botones y alargamiento de los pedúnculos, con una tasa de acumulación de biomasa de 70.8 mg día-1. La biomasa de la parte aérea (tallo y hojas), se incrementó con el crecimiento, pero de 90 a 140 ddt, durante la formación y engrosamiento de los botones florales y alargamiento de los pedúnculos, la acumulación aumentó 71%, lo que se logró con una tasa de 55.4 mg de biomasa por día. En esta última etapa, las raíces acumularon 95% menos biomasa que la parte aérea; en tanto que las flores acumularon hasta tres veces más biomasa que las raíces (Cuadro 2).

Donde: ddt= días después del trasplante; 45 ddt= fin de la etapa de arrosetamiento; 60 ddt= fin de la etapa de alargamiento de los tallos y formación de brotes secundarios; 90 ddt= formación de botones florales y alargamiento de pedúnculos; 140 ddt= apertura de la primera flor, punto de corte. Los valores son el promedio de 25 observaciones.
Cuadro 2 Acumulación de biomasa por órgano y total en plantas de lisianthus cv. Mariachi Pink.
La parte aérea fue la que presentó el mayor porcentaje de acumulación de biomasa en la planta, en las cuatro etapas de evaluación; de los 45 a los 90 ddt, el porcentaje paso de 88 a 93%, con descenso a los 140 ddt a 82.7%. La raíz fue el órgano que menor biomasa acumuló, su mayor acumulación (12.5%) se presentó a los 45 ddt, a partir de los 60 ddt el porcentaje fue disminuyendo hasta los 140 ddt, en donde sólo representó 4.2% del total. En esta misma etapa las flores representaron el 13.2% (Figura 1). El orden de distribución de biomasa en los órganos de la planta fue: parte aérea˃ flores˃ raíz.

Figura 1 Distribución relativa de la biomasa total en plantas de lisianthus cv. Mariachi Pink. Los valores son el promedio de 25 observaciones.
La disminución en la acumulación de biomasa registrada en parte aérea y raíz en la última etapa evaluada, se debe a la removilización de fotosintatos hacia los botones florales en desarrollo. La raíz es la estructura con menor fuerza de demanda en la planta, durante la fase de crecimiento vegetativo y floración se puede almacenar poco carbono en ella (Patrick, 1990). Sin embargo, en la primera etapa evaluada (40 ddt) que es cuando el crecimiento vegetativo es muy lento, es cuando el sistema radical se desarrolla (Melgares de Aguilar, 1996). En esta investigación se observó que la mayor acumulación de biomasa se presentó después del crecimiento vegetativo, lo que coincide con observaciones en diversos cultivares de nochebuena (Whipker y Hammer, 1997; Galindo-García et al., 2015).
Durante el ciclo del cultivo, la planta fue incrementando la acumulación de biomasa; de tal forma que en esta investigación, en un m2 con una densidad de 46.5 plantas, la acumulación total fue de 231 g; de los cuales 30.69 g correspondieron a las flores, 9.77 g a las raíces y 190.65 g a los tallos con sus ramificaciones (Cuadro 3).
Donde: ddt= días después del trasplante; 45 ddt= fin de la etapa de arrosetamiento; 60 ddt= fin de la etapa de alargamiento de los tallos y formación de brotes secundarios; 90 ddt= formación de botones florales y alargamiento de pedúnculos; 140 ddt= apertura de la primera flor, punto de corte.
Cuadro 3 Acumulación de biomasa por órgano y total por m2 en plantas de lisianthus cv. Mariachi Pink.
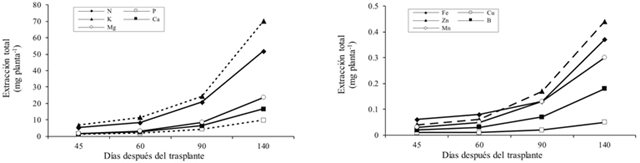
La extracción nutrimental por la parte aérea (tallo y hojas) y raíz se incrementó con el desarrollo de la planta, pero a los 90 ddt fue muy notable el aumento. Esta tendencia de incremento continuó hacia los 140 ddt, etapa en la se observó la mayor acumulación nutrimental, ya que la planta casi duplicó o incluso triplicó, en el caso del Fe, la cantidad de elementos extraídos en la etapa anterior. La flor superó la extracción de la raíz, para la mayoría de los elementos, con excepción del Ca, Fe, Cu y Mn (Cuadro 4).
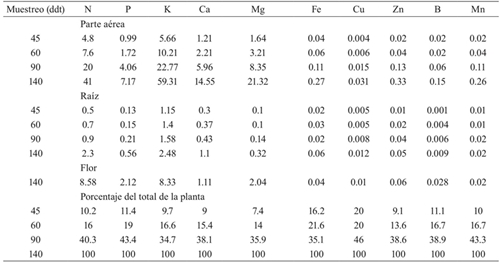
Donde: ddt= días después del trasplante; 45 ddt= fin de la etapa de arrosetamiento; 60 ddt= fin de la etapa de alargamiento de los tallos y formación de brotes secundarios; 90 ddt= formación de botones florales y alargamiento de pedúnculos; 140 ddt= apertura de la primera flor, punto de corte. Los valores son el promedio de tres observaciones.
Cuadro 4 Extracción de macro y micronutrimentos (mg planta-1) de lisianthus cv. Mariachi Pink cultivada en suelo bajo condiciones de invernadero.
La extracción nutrimental total siguió el mismo estilo de la acumulación de biomasa; esto es, se incrementó con el avance del desarrollo de las plantas; de tal forma que al momento de la apertura de la primera flor (140 ddt), la planta presentó la mayor acumulación de todos los elementos (Figura 2). De los 90 a los 140 ddt, etapa de formación de flores, la planta presentó la mayor tasa de absorción nutrimental, con una extracción de 60 a 70% del total (Cuadro 4). El orden de extracción de macronutrimentos fue: K˃ N˃ Mg˃ Ca˃ P; el de micronutrimentos fue: Zn˃ Fe˃ Mn˃ B˃ Cu. Lo que indica que durante la formación y engrosamiento de los botones florales y alargamiento de los pedúnculos, la planta tuvo la mayor demanda nutrimental. Dicho comportamiento también se observó en dos cultivares de nochebuena de sol (Galindo-García et al., 2015); en crisantemo (Chrysanthemum morifolium Ramat) (Valdez-Aguilar et al., 2015) y en fresa (Fragaria x ananassa Duch.) (Avitia-García et al., 2014).
Cabe resaltar que el cultivar lisianthus evaluado, la extracción de Mg fue superior al Ca, cuando en la mayoría de las especies el Ca es requerido en mayor cantidad que el Mg. Este comportamiento también se observa en otras ornamentales como Calathea spp. y Schlumbergera (Dole y Wilkins, 2005).
El K fue el elemento más extraído en este cultivar de lisianthus; en nochebuena fue el N (Galindo-García et al., 2015); en crisantemo la extracción de N y K fue similar (Valdez-Aguilar et al., 2015). Lisianthus tiene semejanza con los cultivos de frutales en cuanto a la mayor demanda de K que de N (Tagliavini et al., 2000), como se ha observado en frambuesa roja (Pineda-Pineda et al., 2008) y banano ‘Dominico’ (Castillo-González et al., 2011).
La parte aérea (tallo y hojas) presentó el mayor porcentaje de acumulación de todos los nutrimentos en todas las etapas, con 80% o más del total acumulado por la planta, seguido por la flor, con excepción del Ca; la raíz fue la que presentó el menor porcentaje de macronutrimentos, salvo el Ca cuyo porcentaje fue igual al de la flor (Figura 3).
En el caso de los micronutrimentos (Figura 4), el mayor porcentaje de Fe, Zn, B y Mn se registró en la parte aérea en todas las etapas. El Cu a los 45 ddt se acumuló más en la raíz (56%) que en la parte aérea (44%), situación que fue cambiando con el desarrollo del cultivo.
Al final del ciclo (140 ddt), la raíz presentó mayor porcentaje de Fe y Cu (17 y 23 %, respectivamente) que la flor (11 y 19%); la flor presentó 15% del B, en tanto que la raíz solo 5%. El Mn se acumuló en porcentajes muy cercanos en la raíz y la flor (7 y 6%, respectivamente). La raíz presentó un mayor porcentaje de nutrimentos al inicio del ciclo (45 ddt), que al final (140 ddt), debido que en la primera etapa la parte aérea no crece porque está en la etapa de arrosetamiento y el crecimiento del tallo es lento; en tanto que la raíz se encuentra en desarrollo (Melgares de Aguilar, 1996).
La extracción nutrimental por m2 se muestra en el Cuadro 5, el K fue el macronutrimentos de mayor extracción por el cultivo; miemtras el P fue menos requerido. De los micronutrimentos el Zn fue más extraído y el Cu el menos. Por lo que es necesario restablecerle al suelo al menos esas cantidades a través de la fertilización. Sin embargo, se debe considerar que la etapa de formación de los botones florales es más demandante de nutrimentos durante el desarrollo fenológico.
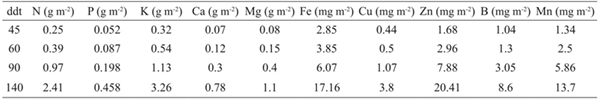
Donde: ddt= días después del trasplante; 45 ddt= fin de la etapa de arrosetamiento; 60 ddt= fin de la etapa de alargamiento de los tallos y formación de brotessecundarios; 90 ddt= formación de botones florales y alargamiento de pedúnculos; 140 ddt= apertura de la primera flor, punto de corte.
Cuadro 5 Extracción total de nutrimentos por m2 en plantas de lisianthus cv. Mariachi Pink.
Conclusiones
La etapa de mayor acumulación de biomasa y extracción nutrimental en lisianthus cv. Mariachi Pink, fue durante la formación y engrosamiento de los botones florales; así como la elongación de pedúnculos (90 a 140 ddt). El orden de extracción de macronutrimentos fue: K˃ N˃ Mg˃ Ca˃ P, el de micronutrimentos fue: Zn˃ Fe˃ Mn˃ B˃ Cu. La estructura de la planta que acumuló mayor biomasa y en consecuencia mayor cantidad de nutrimentos en las diferentes etapas fenológicas fue la parte aérea. La extracción total de macronutrimentos en g m-2 fue: 2.4 de N, 0.46 de P, 3.3 de K, 0.8 de Ca y 1 de Mg; de micronutrimentos en mg m-2 fue: 17.2 de Fe, 3.8 de Cu, 20.4 de Zn, 8.6 de B y 13.7 de Mn. La propuesta de fertilización bajo estas condiciones, es aplicar esas cantidades para el mantenimiento de la fertilidad del suelo; 40% se aplicará al inicio de la etapa de crecimiento vegetativo y 60% al inicio de la floración.











 text in
text in