Introducción
Es reconocida la incidencia de fitopatógenos y susceptibilidades en las diferentes variantes de chile, y en diferentes agrosistemas de producción (invernadero, bioespacio, cielo abierto, etc), por lo que las, enfermedades causan cuantiosas pérdidas en calidad y rendimiento, en función de las condiciones ambientales favorables para su presencia y prácticas de manejo del cultivo (Guigón-López y González-González, 2001). Entre los principales patógenos que atacan al cultivo de chile son: Phytophthora capsici, Xanthomonas campestri ps. Vesicatoria, Alternaria spp., A. alternata, Oidiopsis taurica, Leveillula taurica, Fusarium spp., Rhizoctonia solani, Pythium spp., Sclerotinia sclerotium, Sclerotium rolfsii, diferentes nematodos (Meloidogyne spp. y Heterodera spp.) y complejos virales del tomate, pepino, tabaco, papa, chile y otros (Guigón-López y González-González, 2001; Velázquez et al., 2002; Velásquez-Valle y Amador-Ramírez, 2007; Chew et al., 2008).
La marchitez del chile o secadera es una de las principales enfermedades que causan pérdidas en la producción de 26% a 90%, no solo en México sino a nivel mundial. Es causada por un complejo fitopatológico de Fusarium spp., Phytophthora capsici, Verticillium spp., Macrophomina spp., Rhizoctonia solani, Pythium spp. y Sclerotium rolfsii, actuando de manera aislada o combinada (Ristaino y Johnston, 1999; Velásquez et al., 2000 y 2001; González-Pérez et al., 2004; Rico-Guerrero et al., 2004; Vásquez et al., 2009; Montero-Tavera et al., 2013). Como consecuencia de la incidencia de ésta enfermedad, la superficie sembrada ha disminuido o se ha desplazado a nuevas áreas (González-Pérez et al., 2004). La etiología compleja o el complejo patológico hace difícil establecer un patrón epidemiológico específico del desarrollo de la enfermedad, lo que impide establecer un programa específico de manejo aunado con la alta variabilidad genética en los patógenos que intervienen (Montero-Tavera et al., 2013).
La sintomatología de marchitez del chile o secadera es variada pero esencialmente se refleja en marchitez de hojas sin cambio de color, clorosis y después caída prematura de hojas, rizado de hojas, maduración adelantada e irregular de frutos, pudriciones de raíz o base del tallo y muerte de planta (Avelar y Marban, 1989; Velásquez-Valle et al., 2001; Vásquez et al., 2002). No obstante, se ha mejorado en las técnicas de identificación de patógenos basados en extracción de ADN y amplificación por PCR (Rico-Guerrero et al., 2004).
Entre las principales estrategias de manejo de la marchitez del chile, se destaca el uso de hongos rizosféricos antagónicos a Fusarium spp., Rhizoctonia solani y Phytophthora capsici (Guillen-Cruz et al., 2006; Jiang et al., 2006; Robles-Yerena et al., 2010; Ramos-Sandoval et al., 2010); rizobacterias antagonistas a P. capsici (Sang et al., 2008; Sang y Kim, 2012); combinación de biofumigaciones y microorganismos antagonistas (Wang et al., 2014); inoculaciones con hongos micorrízicos rizosféricos (Ozgonen y Erilic, 2007); combinación de uso de compostas e injertos en patrones resistentes (Gilardi et al., 2013); rotación de cultivos (Lamour y Hausbeck, 2003), uso de germoplasma resistente al principal complejo Fusarium-Rhizoctonia-Phytophthora-Pythium (Koc et al., 2011; Babu et al., 2011); aun cuando no hay resistencias totales al complejo; y aplicación de fungicidas (Chew et al., 2008). No obstante, se comienzan a identificar perfiles de la expresión de secuencias específicas de ADN (transcriptomas) relacionados con la resistencia fenotípica a P. capsici, a partir de la colecta criollo de Morelos-334 (Walker y Bosland, 1999; Richins et al., 2010). También en las variedades autóctonas mexicanas de chile se han identificado fuentes de resistencia a P. capsici (Moran-Bañuelos et al., 2010).
En general, se requiere seguir documentando la presencia y magnitud de daños ocasionados por marchitez del chile, la situación regional y los patógenos asociados, con el propósito de tomar decisiones sobre programas de manejo y control debidamente justificados. Los diagnósticos regionales ayudan a detectar cambios y prevalencias de la enfermedad, relaciones de patógenos asociados, interacciones patógenos-hospederos y aspectos del sistema de cultivo que favorecen o detienen el desarrollo de la enfermedad, entre otros aspectos (Velásquez-Valle et al., 2001a; Guigón-López y González-González, 2001; González-Pérez et al., 2004; Chew et al., 2008; Vásquez et al., 2009). El objetivo del trabajo fue realizar un diagnóstico rápido del síntoma y patógenos asociados a marchitez del chile en Valles Centrales de Oaxaca, México.
Materiales y métodos
Área de estudio
Los Valles Centrales se ubican en la región centro del estado de Oaxaca y se integra por 121 municipios, los que en su orografía delimitan a tres valles: Etla, Tlacolula y Zimatlán-Zaachila-Ocotlán donde se realizan las principales actividades agrícolas (Arellanes et al., 2006). En la región prevalece un clima seco y semi-seco, cálido a semicalido con temperatura media anual de 18 a 22 °C, precipitación media anual de 725 mm y una evaporación de 1 862 mm. Para cubrir los tres valles de la región se visitaron 27 comunidades de 18 municipios, las que se agruparon en cuatro subregiones: 1) Coatlán a Sola de Vega; 2) Ocotlán a Ejutla; 3) Zimatlán a Tlacolula; y 4) Etla, las que están comprendidas entre 16° 13’ 2.17’’ a 17° 14’ 48.14’’ latitud norte a 96° 28’ 27.59’’ a 96° 70’ 11.11’’ longitud oeste y altitudes de 1 412 a 1 760 m.
Entrevista a productores de chile
De junio de 2013 a marzo de 2014, se entrevistaron a 63 productores que tenían cultivos de chile en Valles Centrales de Oaxaca. Durante la visita y recorrido por las parcelas de cultivo (cielo abierto, invernadero y malla sombra o bioespacios), se aplicó una encuesta al agricultor con el objetivo de describir las prácticas de manejo de su cultivo, principales problemas, evaluación de incidencia de marchitez al cultivo bajo una escala general (1-25 leve, 26-50% moderado, 51 a 75% grave y 76 al 100% muy grave; Guigón-López y González-González, 2001) y se obtuvo una muestra de plantas enfermas con síntomas de marchitez del chile.
Diagnóstico fitopatológico en muestras de plantas enfermas
Aislamientos e identificación de patógenos. Después de obtener muestras de plantas con síntomas de marchitez, se enjuagaron por 30 min en agua corriente y cortaron secciones de raíz de 1 cm y de tallo de 0.5 cm. Después se desinfestaron con hipoclorito de sodio al 3% por 3 min, se enjuagaron tres veces con agua destilada estéril y las secciones de tallo y raíz se depositaron en cajas petri con medio de cultivo papa-dextrosa-agar (PDA), jugo V8-Agar (V8A) y agar-agua (A-A) más dos gotas ácido láctico por cada 100 mL de medio preparado, esto último para inhibir el crecimiento de bacterias. Se incubaron por 48 horas a temperatura ambiente (25-35 °C) con monitoreo diario para verificar crecimiento de colonias.
Aquella secciones con colonias se transfirieron a cajas con medio nuevo, afín de obtener colonias puras por el método de punta de hifa o cultivo monozoospóricos. Estas colonias fueron la base para realizar las preparaciones con azul de metilo y glicerol y así proceder a la identificación de patógenos, mediante un microscopio compuesto (10x, 40x y 100x). Complementariamente, se hicieron preparaciones directas del material infectado donde se observaron crecimiento de colonias (cámaras húmedas; método de cintaso). La identificación fitopatológica se hizo con base en las claves de Barnett y Hunter (1972) para Rhizoctonia y Fusarium, y de Romero-Cova (1988) para Phytophthora y Pythium.
Pruebas de patogenicidad de aislamientos de Rhizoctonia y Phytophthora
Preparación y cuantificación del inóculo. Una vez identificados los patógenos en los aislamientos antes señalados se cultivaron en medio PDA para su incremento masivo y después de 20 días de crecimiento, se prepararon los inóculos para la prueba de patogenicidad. En total se obtuvieron 937 aislamientos. En cada patógeno la preparación fue particular como se describe a continuación:
a) Phytophthora capsici. En cajas petri con 20 mL de agua destilada esterilizada se colocaron 10 discos de medio de cultivo que contenía micelio y se incubo por ocho días a temperatura ambiente (25-35 °C) para la formación de esporangios y la posterior liberación de sus zoosporas al colocar las cajas petri bajo refrigeración a 6 °C durante media hora. Una vez generadas las zoosporas y para determinar la dosis del inóculo, mediante un hematocitómetro se ajustó la suspensión de zoosporas a una concentración de 25 000 zoosporas mL-1 y a cada planta de chile objetivo se adicionó a la base del tallo 10 mL de la suspensión de zoosporas.
b) Rhizoctonia solani. En seguimiento al crecimiento del hongo en cajas de petri, cuando éste cubrió la superficie total de las cajas, se le agregaron 20 mL de agua destilada estéril y con una espátula se removió el micelio para separarlo del agar. Posteriormente, la suspensión resultante se homogenizó y se molió para obtener fragmentos diminutos y se hizo el conteo con el hematocitómetro. A partir del conteo, se preparó una suspensión de fragmento de R. solani a una concentración de 95 000 fragmentos de micelio mL-1 y se adicionaron 10 mL de la suspensión a la base del tallo de la planta de chile objetivo.
Previo a la inoculación se sembraron semillas de chile de agua y al cumplir 45 días de edad, las plántulas se trasplantaron en vasos de poliestireno con sustrato estéril (peat moss) y cuando las plantas presentaban de 4 a 6 hojas no cotiledóneas se inocularon con la suspensiones de Rhizoctonia solani y Phytophthora capsici previamente preparada. La aplicación se hizo a 2 cm por debajo del cuello de las plántulas de chile. Las plantas se mantuvieron durante 60 días en el invernadero a una temperatura de 25 ± 5 °C y una humedad relativa de 80 ± 5%. La humedad del sustrato de soporte de las plantas se mantuvo constante para todos los tratamientos, 937 aislamientos.
En ambas inoculaciones, a 60 días de edad de las plantas se hizo la evaluación de daño y reproducción de síntoma de marchitez del chile. En Rhizoctonia se observó la presencia de necrosis en base del tallo con desprendimiento de epidermis a 15 días de inoculación y en Phytophthora se observó pérdida de turgencia, amarillamiento y necrosis en la base del tallo a 10 días de inoculación. En ambos casos se cuantificó la patogenicidad como número de plantas muertas o con síntomas de la enfermedad.
Análisis estadístico
Con las respuestas de los agricultores sobre sus datos sociodemográficos y manejo del cultivo, se hicieron pruebas de ji-cuadrada para evaluar la homogeneidad de clases de respuesta e independencia entre nichos agroecológicos (subregiones) y patógenos identificados para los aislamientos de muestras de plantas con síntomas de marchitez del chile. Complementariamente, a la descripción de manejo se hizo un análisis de correspondencia con el objetivo de identificar las variables de mayor valor descriptivo del chile. Finalmente, se aplicó una prueba de ji-cuadrada para evaluar la independencia entre aislamientos patogénicos de Phytophthora y Rhizoctonia y subregiones de los Valles Centrales donde había cultivos de chile. Todos los análisis se hicieron con los paquetes estadístico SPSS (Visauta, 2002; SAS, 1999).
Resultados y discusión
En cuanto a la descripción del sistema de producción de chile, se encontró que la edad de los productores que cultivan chile se fue entre 40 y 60 años de edad (65.1%) y hubo los agricultores que tenían de 10 a 30 años sembrando el cultivo. No obstante, la mayoría siembran media hectárea o menos (88.9%) y regionalmente el chile de agua es el tipo más cultivado (92.1%). Aunque había plantaciones de habanero, jalapeño, tabiche, poblano y tusta. Al momento de la visita de campo, los cultivos presentaban de 90 a 120 días de haberse trasplantado y estaban en floración y producción, cuando fue más notoria la presencia de la marchitez. Siempre fertilizan ya sea de manera orgánica o combinaciones de orgánico con inorgánico, y usualmente realizan controles químicos de enfermedades o plagas.
La semilla proviene de su propio cultivo previo o intercambio con vecinos para siembras tanto de riego o temporal. Los agricultores resaltan que siempre tiene problemas con el cultivo ya sea de tipo sanitario (plagas o enfermedades) o por altos costos de insumos y bajas ventas en los mercados regionales que son el principal destino de la producción. El cultivo principal es el chile de agua, y prácticamente se siembra todo el año en los Valles Centrales. Sin embargo, cuando estaba presente la marchitez los daños se evaluaron de leves a moderados (90.5%) de sitios visitados; es decir, la enfermedad comenzaba a aparecer y la base del tallo presentaba un grado de necrosis avanzado. En ocasiones se presentaron combinaciones de pudriciones de raíz, ataque de picudo o presencia de virosis. Los resultados muestran que el manejo del cultivo de chile es variable.
La mayoría siembran chile de agua casi todo el año, esto, se verifica con las diferencias estadísticas (p< 0.01) entre clases de respuestas. Los resultado corroboran señalamientos previos de Velasco et al. (1998) y López (2007), quienes afirmaron que la producción de chile de agua en pequeñas superficies, además de generar ingresos para los productores, dinamiza la economía local por las parcelas riego que pueden cultivar chile durante el año. Por otra parte, el intercambio de semilla sin cuidado de sanidad diseminó las enfermedades en la región, esto coincide con las consideraciones de campo de López (1989), al señalar que el incremento de la superficie sembrada entre 1970 y 1985, trajo consigo la aparición y desarrollo de problemas y enfermedades, debido que no existen variedades mejoradas o verificaciones de sanidad de semilla.
En el análisis de correspondencia se determinó que la edad del agricultor, superficie sembrada, tipo de chile sembrado, estación de siembra y trasplante, problemas fitosanitarios, uso de fertilizantes y origen de la semilla, fueron determinantes en el sistema de producción de chile de 63 agricultores de Valles Centrales de Oaxaca. A la cuarta dimensión principal se explicó 82.4% de la variabilidad total (Cuadro 1).
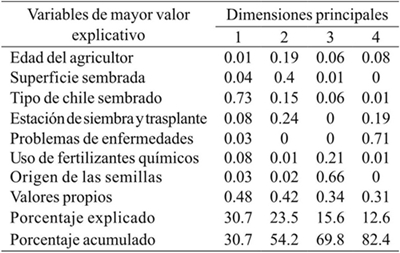
Cuadro 1 Valores y vectores propios del análisis de correspondencia con base en las respuestas de agricultores respecto al manejo del cultivo dechile en Valles Centrales de Oaxaca.
En la representación gráfica del análisis de correspondencia, mediante las dos primeras dimensiones principales (Figura 1), se observó que los sistemas de producción de chile siguen un patrón determinado por la superficie sembrada, estación de siembra y trasplante, tipo de chile y uso de fertilizantes. Así, algunas parcelas de la subregión de Coatlán-Sola de Vega siguen un patrón particular debido a que ahí se siembra esencialmente chile tusta y en el caso de ciertas siembras establecidas en la subregión de Tlacolula-Zimatlán de chile de agua, siguen patrones basados en la estación de siembra y trasplante y uso de agroquímicos (30.7%). También fue posible encontrar un patrón de diferencias de pequeñas, medianas y grandes superficies sembradas de 0.25 o menores a 1 ha. En el caso de los agricultores que poseen una superficie menor a 0.25, corresponden a las subregiones de Coatlán-Sola de Vega, Ocotlán-Ejutla y Etla, las de mayor superficie corresponde a la subregión de Etla.
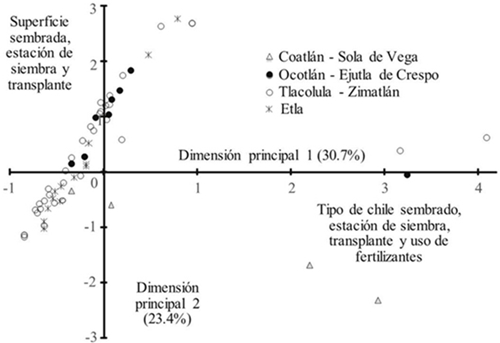
Figura 1 Descripción del manejo de unidades de producción de chile en tres subregiones de Valles Centrales de Oaxaca, con base en las primeras dos dimensiones principales del análisis de correspondencia.
El 79.4% de la superficie sembrada corresponde a riego y riego-temporal, al realizar el riego rodado inundando la parcela que coincide con la época de lluvias y encharcamientos. Así, el agua dispersa los esporangios y entonces se liberan zoosporas motiles que encuentran un ambiente favorable para dispersarse, y el suelo inundado se convierte en foco de infección y medio de supervivencia del patógeno, como lo señalan reportes para P. capsici (Erwin y Ribeiro, 1996; Ávila-Quezada et al., 2005 y Silva-Rojas et al., 2009).
En cuanto a incidencia de marchitez del chile ocasionada por el complejo fitopatológico, se observó que en toda la región explorada de los Valles Centrales se presentaron cuatro patógenos: Rhizoctonia, Fusarium, Phytophthora y Pythium. La subdivisión en cuatro subregiones permitió observar una relación entre patógenos y subregiones. Por ejemplo, para las regiones de Coatlán-Sola de Vega y Ejutla-Ocotlán hubo mayor incidencia de Rhizoctonia y Fusarium, pero para Zimatlán-Tlacolula además se presentó Phytophthora y Pythium. La presencia de los cuatro patógenos también se hizo evidente en la región de Etla. Todo hace pensar que los daños de marchitez se presentan más frecuentes si hay prevalencia de dos o más patógenos en el suelo, y específicamente las regiones de Etla y Zimatlán-Tlacolula se presentó con mayor incidencia la enfermedad. Esto resultados coinciden con los reporte previos de Vásquez et al. (2009) en chile de agua (Cuadro 2).
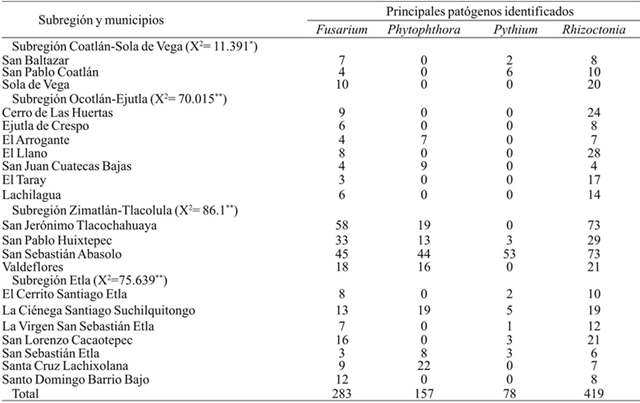
*= diferencias significativas a nivel p≤ 0.05; **= diferencias significativas a nivel p≤ 0.01 (prueba de χ2).
Cuadro 2 Frecuencia observada de patógenos identificados en los muestreos realizados (n= 937) aislamientos en plantas de chile con síntomas de marchitez, en los Valles Centrales de Oaxaca.
Los resultados de diagnóstico sobre la asociación del complejo fitopatológico Rhizoctonia-Fusarium-Phytophthora-Pythium, se observó e identificó la presencia de dos o más de ellos y manifestación síntomas de marchitez, que coinciden con los trabajos de Durán-Ortiz et al. (2001) de marchitez en Zacatecas y Aguascalientes. En Camargo, Delicias y Sur de Chihuahua se determinó a Phytophthora capsici como el agente causal de marchitez del chile (Silva-Rojas et al., 2009 y Guigón-López y González- González, 2001). Vásquez et al. (2009) en su estudio determinaron que Phytophthora y Rhizoctonia son los agentes causales de marchitez para tres comunidades del estado de Oaxaca. Otros estudios indican que, los patógenos asociados con mayor frecuencia fueron Rhizoctonia spp. y Fusarium spp., en Aguascalientes y Zacatecas (Rico-Guerrero, 2002).
Cuando se realizó la prueba de patogenicidad a 17 y 52 asilamientos de Phytophthora y Rhizoctonia, respectivamente; en ambos casos, se detectó un número de aislamientos no patogénicos que de patogénicos. De estos últimos, se determinaron tres en Phytophthora y siete en Rhizoctonia. Aun cuando, en estas pruebas de patogenicidad hubo aislamiento que de manera independientes no reprodujeron los síntomas, no es un reflejo de pérdida de patogenicidad porque en campo regularmente convergen dos o más patógenos en el mismo sitio para reproducir los síntomas de marchitez. También debe resaltarse que se hicieron inóculos solo en chile de agua a 45 días de la primera fase de crecimiento (Cuadro 3).
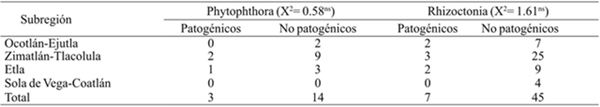
Cuadro 3 Resultados de pruebas de patogenicidad de 17 aislamientos de Phytophthora y 52 de Rhizoctonia, y su relación con la subregión de origen en Valles Centrales de Oaxaca.
A 60 días de las inoculaciones, los síntomas de las plantas con Rhizoctonia fueron de clorosis, después necrosis en la base del tallo con desprendimiento de epidermis y finalmente muerte de la planta. En inoculaciones con Phytophthora, los síntomas aparecieron a 55 días de inoculación; entre los más destacados fue, pérdida de turgencia o marchitez de hojas, defoliación, ligero amarillamiento, necrosis en la base del tallo y muerte de planta. Se cuantificó patogenicidad como número de plantas muertas con síntomas de la enfermedad.
Conclusiones
Los agrosistemas de producción de chile en Valles Centrales de Oaxaca son diversos en infraestructura utilizada, superficie sembrada, manejo del cultivo, plagas y enfermedades. En este sentido, se destaca el chile de agua como más frecuente y de mayor superficie sembrada durante todo el año. Los productores usualmente obtienen su propia semilla, utilizan fertilizantes químicos, regularmente presentan incidencias de plagas como el picudo del fruto y pudriciones de raíz asociadas a síntomas de marchitez, y 84.1% de ellos utilizan agroquímicos para su control. En el análisis de correspondencia se determinó la edad del agricultor, superficie sembrada, tipo de chile sembrado, estación de siembra y trasplante, problemas fitosanitarios, uso de fertilizantes y origen de la semilla, fueron las variables de mayor valor descriptivo del sistema de producción de chile de 63 agricultores de Valles Centrales de Oaxaca.
Se observaron diferentes síntomas catalogados como marchitez del chile en varios sitios de producción de los Valles Centrales, y los patógenos relacionados con el síntoma fueron Rhizoctonia y Fusarium, y dos oomycetos: Phytophthora y Pythium. También, se determinó una relación significativa (X2, p< 0.05) entre subregiones visitadas y frecuencia de la distribución de patógenos: en las regiones de Coatlán-Sola de Vega y Ejutla-Ocotlán hubo mayor incidencia de Rhizoctonia y Fusarium, pero para Zimatlán-Tlacolula y Etla además se presentó Phytophthora y Pythium. Los resultados muestran la presencia de dos o más patógenos en el mismo sito, y consecuentemente mayor incidencia en campo de la enfermedad.
En las pruebas de patogenicidad se reprodujeron uno o más síntomas de la marchitez del chile, mediante la inoculación de 3 y 7 aislamientos patogénicos de Phytophthora y Rhizoctonia respectivamente; en plantas de chile de agua de 45 días de edad. Estos aislamientos patogénicos son factibles de utilizarse en pruebas de tolerancias o resistencias de germoplasma de chile.











 texto en
texto en 


