Introducción
El consumo insuficiente de los micronutrientes través de los alimentos causa una malnutrición mineral en humanos. Hasta ahora se han determinado 11 elementos traza que son esenciales para el desarrollo y crecimiento adecuado de los humanos (Fraga, 2006). Algunos de estos elementos son requeridos en cantidades tan pequeñas que su deficiencia puede llegar a ser rara o incluso desconocida (Stein, 2009). De acuerdo con la Organización Mundial de la Salud (OMS) las deficiencias nutrimentales más comunes son las de hierro (Fe), zinc (Zn), yodo (I) y Vitamina A (Burlingame, 2013) (Figura 1).
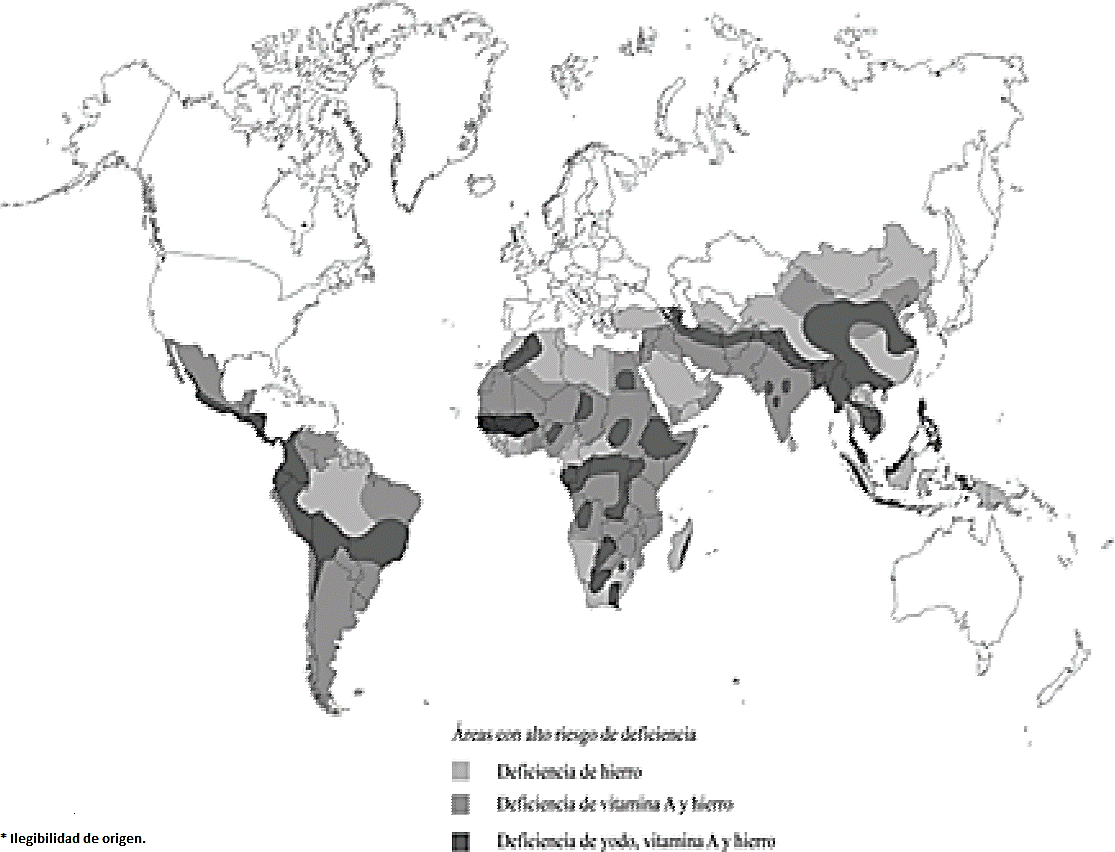
Figura 1 Deficiencias nutrimentales más comunes. (Modificado de Burlingame, 2013. Frontiers in Agricultural Sustainability: studying the protein supply chain to improve dietary quality).
Entre las causas de la desnutrición mineral se encuentran la distribución irregular de los elementos en los suelos y el empobrecimiento de los suelos de uso agrícola por la producción intensiva y la falta de un buen manejo (Vir, 2012).
Uno de los elementos más estudiados debido a su importancia metabólica en mamíferos es el yodo. La deficiencia de este elemento se presenta en muchas regiones del planeta pero es más pronunciada en áreas montañosas y llanuras, esto ocasionado por la distribución irregular del yodo en la corteza terrestre (FAO, 2009). Se estima que 2 000 millones de personas viven con una ingesta insuficiente de este elemento (Mottiar, 2013), provocando los denominados desordenes por deficiencia de yodo (DDY) (Weng et al., 2008). Los DDY se refieren a todos los desórdenes asociados con la baja ingesta de yodo y que pueden ser prevenidos asegurando el consumo adecuado del elemento (WHO, 2001). Los DDY ocurren cuando la ingesta y asimilación de yodo es más baja que la cantidad requerida por la glándula tiroidea para sintetizar suficientes cantidades de las hormonas tiroxina y triyodotironina. El DDY más conocido por su clara sintomatología es el bocio, sin embargo, en las últimas décadas se ha reconocido la presencia de desórdenes menos obvios desde el punto de vista de la sintomatología, tales como el impacto adverso del consumo insuficiente de yodo en el desarrollo mental y físico en niños así como en la productividad de los adultos (Lazarus, 2015).
Adicional a la importancia del consumo de yodo, justificada por la esencialidad para el funcionamiento adecuado de la glándula tiroidea, se ha demostrado recientemente una función distinta a la ya mencionada, asociada con la carcinogénesis y su tratamiento en diversas líneas celulares, mostrando que el yodo es capaz de actuar de dos formas: como antioxidante y como antiproliferativo de células malignas (Aceves y Anguiano, 2009). En bajas concentraciones el yodo puede neutralizar directamente radicales hidroxilo (OH-) y adicionalmente en su forma oxidada (I2) compite con las especies reactivas del oxígeno (ROS) por varios componentes celulares disminuyendo significativamente la lipoperoxidación. En altas concentraciones el yodo actúa como un oxidante moderado, disipando el potencial de membrana mitocondrial y promoviendo la apoptosis en células cancerosas (Arroyo et al., 2006; Shrivastava et al., 2006; Torremante y Rosner, 2011)
Los requerimientos diarios de yodo, de acuerdo con las Recommended Dietary Allowances (RDA) (WHO, 2011; Andersson et al., 2011), son mostrados en el Cuadro 1.
Cuadro 1 Ingesta diaria recomendada de yodo.
| Cantidad diaria | Edad |
| 90 µg | Infantes (0-59 meses) |
| 120 µg | Niños (6-12 años) |
| 150 µg | Adultos (mayores de 12 años) |
| 200 µg | Embarazo y lactancia |
Se han realizado numerosos intentos para mitigar el déficit en el consumo del yodo, principalmente mediante la yodatización universal de la sal de mesa desde la década de 1920 (De Caffarelli et al., 1997; Zimmermann, 2009; Charlton et al., 2013). Sin embargo, a través de los años se ha demostrado que esta técnica por sí sola es insuficiente para asegurar el requerimiento total de yodo (De Benosit et al., 2008). Adicionalmente, en la mayoría de los países industrializados el consumo de sal de mesa va en disminución (Hetzel y Standbry, 1980) además de que se ha demostrado que el yodo en la sal de mesa se volatiliza (Laillou et al., 2015). Por otra parte, el consumo de yodo en formas orgánicas se considera más adecuado (Weng et al., 2014), ya que también se han evidenciado casos de bocio endémico asociado al exceso en el consumo de yodo inorgánico (Zhao et al., 2000). Debido a lo anterior, se hace necesario aumentar el uso de técnicas como la biofortificación de los cultivos para lograr un consumo adecuado de yodo, ya sea como complemento o como alternativa a la yodatización de la sal de mesa. El objetivo de este escrito es revisar los avances acerca de la aplicación de yodo en plantas y de la biofortificación de cultivos con este elemento.
Disponibilidad del yodo en los alimentos
El mayor reservorio de yodo se encuentra en el mar; de allí se moviliza a las zonas terrestres a través de formas químicas volátiles producidas por algas marinas o bien por aerosoles marinos arrastrados por los vientos lo cual explica porque los suelos alejados del océano generalmente están desabastecidos de yodo y por consiguiente las plantas que crecen o se cultivan en estos suelos tendrán baja concentración del elemento (Zimmermann, 2009).
No se considera al yodo como un elemento esencial para las plantas terrestres, aunque diversos estudios demostraron que estas absorben y acumulan yodo (Mackowiak y Grossl, 1999; Zhu et al., 2003). Esta aparente no esencialidad explica el porque el yodo no se contempla en los programas de fertilización mineral de los cultivos, ello a pesar de que se ha demostrado que el aporte de sales inorgánicas de yodo permite elevar la tolerancia al estrés en las plantas (Leyva et al., 2011; Gupta et al., 2015). El no incluir fertilizantes con yodo para los cultivos, ocasiona que el contenido de este elemento en los alimentos vegetales y animales dependa exclusivamente de la disponibilidad natural del elemento en el suelo y en el agua. Por tal razón, hasta la fecha, la principal fuente de yodo para la mayoría de la población mundial es el aporte de sales inorgánicas (yoduro y yodato de potasio: KI y KIO3) en la sal de mesa, agregando de 20 a 40 mg de yodo por kg de sal siguiendo los lineamientos de WHO/ UNICEF/ International Council for the Control of Iodine Deficiency Disorders (WHO, 2007; FAO, 2009; Zimmermann, 2009).
Disponibilidad del yodo en el suelo
La concentración de yodo disponible en el suelo se encuentra en función de la distancia al océano así como de la composición del material madre del suelo. Las zonas montañosas, los valles y las planicies del interior de los continentes muestran bajas concentraciones de yodo (Aston y Brazier, 1979). Se ha señalado que el yodo es único entre los elementos en consideración a su comportamiento geoquímico. La mayoría de los elementos disponibles en el suelo proviene del desgaste de la litosfera, y en general este no es el caso del yodo (Fuge y Jhonson, 1986). Este elemento muestra un amplio rango de concentraciones en el suelo, desde <0.1 hasta 150 mg kg-1. Se considera que la concentración de yodo en el suelo es generalmente más alta que la encontrada en la roca madre del suelo. Los geoquímicos concuerdan con esto último debido a que el mayor abastecimiento de yodo en el suelo proviene de la atmósfera que a su vez esta lo recibe del entorno marino (Fuge, 2013).
Entre los factores edáficos que modifican la disponibilidad y absorción del yodo del suelo se encuentran: la cantidad de materia orgánica, la cual permite mayor absorción del yodo por las plantas, sobre todo cuando este se encuentra en forma de yodato (IO3-) (Seki et al., 1984). Este efecto parece depender de la habilidad de las sustancias húmicas para adsorber el yodo (proceso al parecer mediado por microorganismos) disminuyendo su volatilización (Bostock, 2003), si bien en ausencia de materia orgánica parece ocurrir gran actividad de volatilización de yodo en forma de CH3I a través de la actividad microbiana (Amachi et al., 2003). Este hecho pudiera explicar en parte la aparente relación negativa entre el contenido de arcillas del suelo y la absorción de yodo por las plantas, mientras que el pH del suelo no parece ejercer efecto alguno en el intervalo de 5.4 a 7.6 (Shinonaga et al., 2001).
Contenido de yodo en las plantas
La concentración de yodo encontrada normalmente en tejidos vegetales va de 0.1 a 1 µg g-1, pudiendo alcanzar hasta 3 µg g-1 ó más (Benton Jones, 1998). En un estudio llevado a cabo por Shinonaga y colaboradores (2001) se estableció que la concentración de yodo en cereales de grano de zonas agrícolas continentales de Europa fue particularmente baja, con valores de 0.002 a 0.03 µg g-1, en comparación con los de suelos cercanos al océano. Poco se conoce sobre la forma en que éste elemento es acumulado en plantas terrestres, sin embargo, en una investigación realizada en plantas de calabaza se dedujo mediante un estudio con microscopia electrónica que al aplicarse yodo inorgánico y orgánico directamente al sustrato, la mayor parte del yodo se acumuló en la raíz, mientras otra pequeña porción fue transportada a las partes aéreas para almacenarse en los cloroplastos (Weng et al., 2008a), hecho que pudiera explicar parcialmente su carácter de inductor de tolerancia frente a algunos tipos de estrés ya que un volumen importante de la maquinaria antioxidante celular se encuentra en los cloroplastos.
Fertilización con yodo para la biofortificación en sistemas de cultivo sin suelo
El contenido de yodo en las plantas generalmente aumenta al aplicar el yodo como yoduro, yodato u otras formas químicas (Weng et al., 2008b). Los mejores resultados se han obtenido al aplicar los compuestos de yodo en la solución nutritiva o por aspersión foliar. En cada especie vegetal los resultados son variables en el sentido que se modifica la respuesta frente a la concentración y cambia la distribución en los órganos de la planta. Por ejemplo en un estudio llevado a cabo en espinaca bajo cultivo hidropónico se aplicaron diferentes formas químicas de yodo como acido yodo acético, yoduro y yodato y se comprobó que con concentraciones mayores a 0 y hasta 1 mg L-1 la tasa de absorción del yodo aumentó linealmente frente a la concentración, manteniendo una proporción de concentración de 1:1 en raíces y hojas. Se mostró el siguiente orden de acumulación con las diferentes formas de yodo CH2ICOO- > I- > IO3-.
Adicionalmente se comprobó que inclusive con estas bajas concentraciones se obtuvo un incremento de la biomasa en estas plantas (Weng et al., 2008c). Por su parte Blasco et al. (2008)) demostraron que aplicando yodo en concentraciones ≤5.1 mg L-1 de yoduro (I-) en lechuga hidropónica se obtuvo una adecuada acumulación de yodo foliar, la cual fue de 900 µg g-1 de tejido seco, cantidad que es suficiente para cumplir la demanda diaria de consumo de yodo en humanos (150 µg día-1) (Charlton et al., 2013) cuando se consumen entre 17 y 200 g de tejido fresco de lechuga por semana, ya que esta concentración no excede la máxima cantidad recomendada la cual es de 2 mg por día. Sin embargo a concentraciones superiores a 5.1 mg L-1 de yoduro se presentaba una reducción significativa en la biomasa, caso que no sucedió aplicando las mismas concentraciones de yodato.
Zhu et al. (2003) estudiaron la absorción del yodo en plantas de espinaca bajo cultivo hidropónico a concentraciones de 0.127, 1.27, 6.35 y 12.7 mg L-1 de yoduro y yodato, encontrando como resultado que con 12.7 mg L-1 de yoduro hubo efectos negativos en el crecimiento de las plantas, mientras que con esta misma concentración de yodato ocurrió solo un pequeño efecto sobre la biomasa de la planta. Sin embargo las concentraciones bajas, tal como 0.127 mg L-1 de yoduro y yodato resultaron en una adecuada acumulación de este elemento, presentando 3 y 1.8 µg I g-1 de peso fresco, la cual se considera adecuada.
Voogt et al. (2010) realizaron otro experimento de biofortificación con yodo en forma de yoduro y yodato en plantas de lechuga, aplicaron concentraciones muy bajas de estas formas químicas, las cuales oscilaban entre 0.013 y 0.129 mg L-1, encontrando que en ninguna de las concentraciones mostraron efecto tóxico en las plantas de lechuga y con la concentración de 0.129 mg L-1 de yoduro obtuvieron una acumulación de 0.653 y 0.764 µg I g-1 de tejido fresco, cinco veces menos de la concentración obtenida al aplicar yodato.
En la actualidad existe un creciente interés en la suplementación con yodo en la cadena alimenticia mediante la captación y acumulación de este elemento en plantas de consumo humano (Nestel, 2006), los resultados positivos antes descritos, principalmente en especies hortícolas en sistemas sin suelo son importantes y sugieren que son buenos candidatos para los programas de biofortificación con yodo, sin embargo, el verdadero reto es la biofortificación de cultivos en sistemas extensivos en suelo, dado que es lo que permitiría una cobertura realmente amplia de la población objetivo.
Fertilización con yodo para la biofortificación de cultivos en suelo
La adición de yodo al suelo permite ampliar el espectro de especies vegetales para biofortificación (Cui y Song, 2003), incluyendo además de las hortalizas a las medicinales e inclusive cultivos básicos (Yuita, 1992) que normalmente se cultivan en campo abierto. En el suelo pueden coexistir diversas formas químicas de yodo, entre las más abundantes se encuentran el yodato (IO3) y el yoduro (I-) (Borst Pauwels, 1962). Algunos estudios realizados de aplicación de yodo al suelo han demostrado que las plantas pueden tolerar mayores concentraciones de yodato que de yoduro (Dai et al., 2006; Smolen et al., 2012) y que muy bajas concentraciones de yodo (0.02-0.2 mg kg-1) sin importar la forma, son benéficas para varias plantas de cultivo, sobre todo para las de carácter halofítico (Borst Pauwels, 1961; Dai et al., 2006; Smolen y Sandy, 2012). Dai et al. (2006) llevaron a cabo la aplicación de yoduro y yodato de potasio directamente al suelo para biofortificar plantas de lechuga observando que la mayor acumulación de este elemento fue obtenido con los tratamientos de yodato.
Caso contrario a lo ocurrido al aplicar el yoduro y yodato de potasio mediante hidroponía en plantas de lechuga y arroz (Mackowiak y Grossl, 1999; Zhu et al., 2003). En estudios realizados en plantas de arroz se ha demostrado que estas tienen la capacidad de reducir el yodato a yoduro, hecho que parece conferirles flexibilidad metabólica frente al yodo (Kato et al., 2013). Por otra parte, Weng et al. (2003) encontraron que al aplicar algas kelp y tierra de diatomeas al suelo se logró elevar la disponibilidad de yodo para las hortalizas bajo cultivo. Los mismos autores encontraron que la absorción de yodo por hortalizas estaba en función directa de la concentración del elemento en el suelo, hasta alcanzar un límite que se presentó diferente para cada especie vegetal. En un estudio reciente Weng et al. (2014) demostraron que es posible usar la composta con algas marinas incorporada al suelo como un mecanismo de fertilización con yodo.
No se conoce el origen de las diferencias en la absorción de yoduro o yodato en el suelo y en las soluciones nutritivas. Se atribuyen en parte a la sustancial volatilización del yodo del sistema planta-suelo hacia la atmósfera mediada por diferentes microorganismos (Muramatsu et al., 1995; Fuge, 1996). Sin embargo, se tiene evidencia que la síntesis de las formas volátiles de yodo, llamadas organoyodados, provienen principalmente de la forma química yoduro (Keppler et al., 2003) este hecho pudiera parecer contradictorio ya que el yoduro es la forma química que absorben más fácilmente las plantas del suelo. El yodo contenido en el agua de riego puede ser una fuente de este elemento para las plantas, sin embargo es poco probable que el agua contenga niveles adecuados de yodo en regiones en donde el suelo presente concentraciones bajas del elemento. La aplicación de yodo como yodato de potasio en el agua de riego (0.010-0.08 mg L-1 por cuatro semanas) fue efectiva durante cuatro años para elevar la concentración de yodo en suelos y plantas en regiones de China con severa deficiencia de yodo (Jiang et al., 1998).
En otro estudio Caffagini et al. (2011) realizaron la aplicación de yoduro y yodato mediante irrigación a concentraciones de 500 y 1000 mg L-1 y 500, 1 000, 2 000 y 5 000 mg L-1, respectivamente, en cebada, maíz, tomate y papa. Encontrándose resultados favorables únicamente en los frutos de tomate y tubérculos de papa alcanzando concentraciones de 272 a 6 245 µg I por cada 100 g de peso fresco y de 527 a 5 375 µg I por cada 100 g de peso fresco, respectivamente. Las concentración de yodo alcanzada en los frutos de tomate de las plantas tratadas con yoduro a 500 mg L-1 fue siete veces más elevada que la concentración alcanzada con la aplicación de yodato en 500 mg L-1 (3 900-527 µg 100 g-1). De igual modo sucedió en el caso de los tubérculos de papa, en donde la concentración alcanzada con la aplicación de yoduro a 500 mg L-1 fue siete veces mayor que la concentración alcanzada con la aplicación de yodato a 500 mg L-1 (1875 versus 272 µg I por 100 g de peso fresco). Lo cual corroboró la mayor facilidad de absorción del yoduro frente al yodato.
Una forma para evitar la complejidad de los fenómenos de absorción y transporte del yodo cuando este se aplica al suelo, es aplicarlo por medio de aspersión foliar en forma de yoduro y yodato (Zanirato y Mayerle, 2009), encontrándose buenos resultados al compararlo con las aplicaciones al suelo (Lawson et al., 2015). En otro estudio reciente Tonacchera et al. (2013) lograron aumentar la concentración de yodo en papa, zanahoria, tomate y lechuga aplicando yodo como aspersión foliar. Los resultados obtenidos indicaron que las partes comestibles de las plantas alcanzaron hasta 30% de la recomendación diaria (RDA) de consumo de yodo sin afectar otros aspectos de la calidad de los alimentos.
Mecanismos de absorción y transporte del yodo
Las plantas marinas se encuentran inmersas en un medio rico en yodo, por ello constituyen el modelo más sencillo para estudiar el fenómeno de la absorción del yodo. De acuerdo con el mecanismo propuesto por Küper et al. (1998), la absorción del yodo en las algas café ocurre mediante el paso del yoduro presente en el apoplasto a través de la pared celular por medio de la enzima yodo peroxidasa dependiente de vanadio (V-IPO) (Truesdale et al., 1995; Colin et al., 2003; Winter y Moore, 2009) la cual cataliza la oxidación del yoduro a ácido hipoyodoso (HIO), como se muestra en la reacción 1:
Adicionalmente el ácido hipoyodoso puede reaccionar de forma espontánea con el yoduro manteniendo un equilibro de reacción en medio acuoso como se muestra en la reacción 2 (Truesdale et al., 1995).
Cuando las algas están sujetas a un nivel bajo de estrés oxidativo, el I2 formado en la reacción (2) puede atravesar la membrana celular, someterse a una reducción en el citoplasma y luego almacenarse como yoduro en la vacuola, de donde se movilizará en momentos de estrés oxidativo. En cambio, cuando las algas son sometidas a un nivel alto de estrés oxidativo el I2 se volatilizará a la atmosfera (Le Blanc et al., 2006; Kupper et al., 2008). El mismo destino puede sufrir el HIO, ya que puede acumularse en las vacuolas o bien reaccionar con compuestos orgánicos formando principalmente metil-yoduro (CH3I) que será volatilizado (Le Barre et al., 2008) (Figura 2).
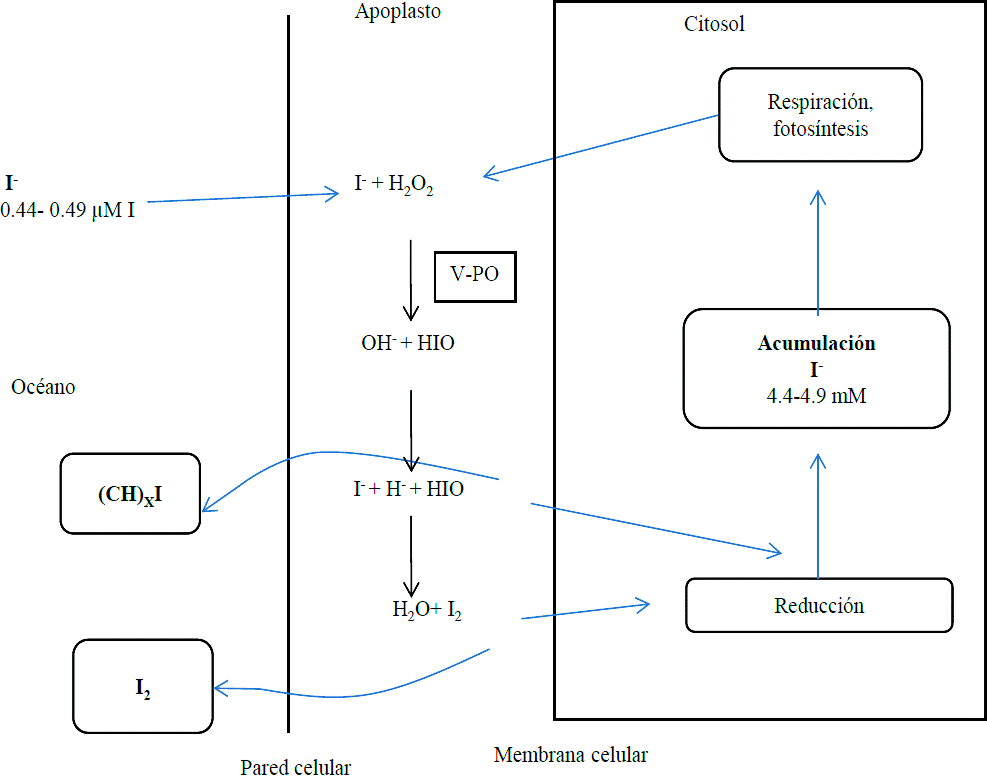
Figura 2 Esquema del mecanismo de absorción y volatilización del yodo por plantas marinas. (Modificado de Le Blanc et al., 2006).
Weng y colaboradores (2013) realizaron una serie de experimentos con plantas de repollo y concluyeron que la absorción del yodo a través de la raíz ocurre de forma distinta a lo observado en plantas marinas. En el repollo el transporte de yodo ocurre por medio de transportadores acoplados a bombas de protones así como a través de canales aniónicos y esto mismo se ha observado en otras especies terrestres (White y Broadley, 2009). En cambio, en las plantas marinas parece operar únicamente el mecanismo asociado al bombeo de protones (Weng et al., 2013). La posterior movilización del yodo de la raíz hacia los tallos y hojas ocurre por el xilema (Herret et al., 1962; Mackowiak y Grossl, 1999; Zhu et al., 2003; Kato et al., 2013) aunque al igual que ocurre con otros elementos parece ocurrir una redistribución posterior del yodo vía floema (Landini et al., 2011).
Los procesos de asimilación y transporte del yodo comienzan a dilucidarse y ello promete obtener grandes beneficios en cuanto a la calidad nutricional de los alimentos vegetales. Sin embargo, aún en ausencia de dicho conocimiento una forma práctica de cuantificar la captación de yodo por las plantas es el denominado factor de transferencia (TF) el cual es calculado por medio de la siguiente ecuación:
La desventaja de dicho factor (TF) es que no indica nada acerca de los factores que lo modifican, sin embargo, si la meta es detectar los tipos de suelo o factores de manejo que elevan la asimilación de yodo o disminuyen su pérdida por volatilización, entonces el TF será muy útil como indicador. Se tiene por ejemplo que el Cl- tiene un alto TF, debido a su flujo en la planta muestra alta correlación con el flujo hídrico del xilema, se ha calculado un valor TF= 785 para el Cl- en Lolium perene (Ashworth y Shaw, 2006). En contraste los valores de TF para yodo suelen ser muy bajos: 0.00034 para pastos (IAEA, 1994), 0.0005-0.02 para cereales en Austria (Shinonaga et al., 2001), 0.024-0.19 para maíz, betabel y calabaza (Sheppard et al., 1993) y 0.01-0.03 para rábanos y lechuga (Kashparov et al., 2005).
Sin embargo se ha reportado que es posible incrementar significativamente el TF del yodo, al aumentarse la concentración de este elemento en el suelo. Dai et al. (2004)) obtuvieron que al aplicar yodo a una concentración de 5 mg kg-1 el TF de las partes comestibles de diferentes vegetales aumentó de 0.1 a 10. Los valores se incrementaron en el siguiente orden zanahoria = cebolla < apio < brote de espinaca < hoja de espinaca. Debido a la problemática descrita anteriormente, y no solo a la irregular distribución del yodo en el suelo se han propuesto técnicas de aplicación de yodo al suelo, agua o por aspersión foliar y se ha comprobado la efectividad de estas prácticas para lograr una mejora en la concentración del yodo en las principales plantas de consumo humano.
Conclusiones
La salud nutricional de cerca de 2*109 personas brinda un enorme incentivo para el desarrollo de nuevas técnicas de biofortificación con yodo para las principales plantas de consumo humano.
El constante de las fuentes de información permite afirmar que la estrategia de fortificación ha permitido un gran avance en el combate contra la deficiencia en el consumo de yodo; sin embargo, se requiere ampliar esta estrategia incluyendo ahora la biofortificación de los cultivos, y para ello es clave la elucidación de los mecanismos concernientes con la absorción, volatilización y acumulación de este elemento por las plantas.











 text in
text in 


