Introducción
En la actualidad, varios son los problemas principales asociados a los combustibles fósiles, tales como la contaminación en su proceso de extracción y su uso (Adams et al., 1999; Di Toro et al., 2007), además de su próximo agotamiento en los yacimientos naturales. Con base en lo anterior, la necesidad de contar con fuentes de energía renovables es una prioridad, en la que evidencian importancia especies vegetales como Jatropha curcas L. que, por la cantidad y calidad de los aceite contenidos en sus semillas, presenta excelentes posibilidades de uso como energético doméstico e industrial (Foidl et al., 1996; Francis et al., 2005; Toral et al., 2008; Verma y Gaur, 2009).
J. curcas, conocida comúnmente como piñón mexicano, naxtli (Nahúatl), Chu’ta (Totonaco) o tempate, pertenece a la familia Euphorbiaceae, de crecimiento rápido y puede alcanzar de 4 a 8 m (Heller, 1996) o más, en suelos fértiles y húmedos. Es originaria de México y Centroamérica, y se desarrolla en la mayoría de las regiones tropicales y subtropicales (Heller, 1996), zonas con precipitaciones medias anuales de 250 a 1 200 mm (Openshaw, 2000; Achten et al., 2008). En México, se le encuentra en diez estados, entre los que destacan: Chiapas, Veracruz, Oaxaca, Morelos, Puebla, Yucatán e Hidalgo (CONAFOR, 2010), ya que las condiciones climáticas que existen algunas regiones de éstos son adecuadas para su desarrollo (SEMARNAT, 2010).
Dependiendo del proceso de análisis, las semillas pueden contener de 35 a 40% de aceite (Kaushik et al., 2006), 27 a 32% de proteína (Makkar et al., 1998b), pudiendo obtenerse hasta 63% de harina seca (Makkar et al., 1997). Por estas y otras características, se está propagando con propósitos comerciales para uso industrial, incluyendo harina para alimento de animales (Aderibigbe et al., 1997). Además, posee propiedades medicinales (Duke, 1985; Kumar y Sharma, 2008). En algunas regiones de México, como en el Totonacapan, los genotipos allí distribuidos evidencian domesticación por su nula o baja toxicidad y las semillas se utilizan como alimento humano (Makkar et al., 1998a). Previamente tostadas, las semillas se comen solas o bien incorporándolas en la preparación de platillos regionales, como pipián o acompañado con frijoles de olla.
Por sus características adaptativas y de fácil crecimiento, esta especie es utilizada en la recuperación de suelos, para evitar la erosión, para reforestación de áreas deterioradas (Ratree, 2004), así como para cerca viva, tutor de la planta de vainilla y sombra dicha especie o bien en plantíos de café (Kumar y Sharma, 2008), entre otros usos. A pesar de que J. curcas evidencia un amplio potencial para incrementar su cultivo mediante su multiplicación somática, la cual es relativamente rápida, aún no se cuenta con protocolos precisos relativos a las condiciones ideales para la germinación de sus semillas, situación que -entre otros aspectos- ha limitado su mejoramiento genético, ya que, como es sabido, para lograr este propósito es indispensable disponer de la diversidad genética derivada de la reproducción sexual (por semilla botánica).
Además de lo mencionado, la semilla de J. curcas es procesada para la obtención de biodiesel, razón por la cual se está propagando masivamente tanto en forma vegetativa como por semilla. Sin embargo, según varios investigadores y productores, el uso de semillas para la obtención de plántulas es la más utilizada, sobre todo en plantaciones extensas, ya que las plántulas obtenidas por este proceso son más robustas, longevas y resistentes a enfermedades y sequía, debido a que el sistema radical generado por estas estructuras es más eficiente que el generado por varetas Saturnino et al. (2005).
Germinación. Las propiedades de las semillas de J. curcas son altamente influenciadas por las condiciones ambientales (Ginwal et al., 2005), además de poseer sustancias inhibidoras, por lo que deben ser secadas hasta 5% de humedad para incrementar el porcentaje de la germinación en corto tiempo. El porcentaje de germinación de J. curcas es muy variado, de 0 a 65% (Moncaleano-Escandon et al., 2013). Algunos autores, mencionan que esta heterogeneidad es causada por dormancia exógena inducida por la testa, al ser restringida la inbibición de las semillas. Además, la germinación y emergencia puede variar desde días hasta meses, evidenciando el proceso fisiológico referido, en el que, al parecer también influye la presencia de la carúncula. Otra característica que necesita de un manejo adecuando, es el almacenamiento, ya que las semillas pierden su viabilidad y potencial de germinación, en periodos tan cortos como 6 meses, sin control ambiental, pudiendo restringirse el periodo de viabilidad si la temperatura y humedad se incrementan (Moncaleano-Escandon et al., 2013).
Debido a los antecedentes mencionados, en el presente trabajo se planteó como objetivo general, evaluar experimentalmente las respuestas de seis diferentes materiales (genotipos), adaptados seis diferentes elevaciones, a los tratamientos pregerminativos indicados.
Materiales y métodos
El experimento se estableció en el laboratorio del “Banco Nacional de Germoplasma Vegetal” (BANGEV), ubicado en el Departamento de Fitotecnia de la Universidad Autónoma Chapingo. El material vegetal evaluado correspondió a seis accesiones provenientes de la Sierra Norte del Estado de Puebla y del estado de Veracruz (Cuadro 1), cultivados en la región denominada Totonacapan. Las semillas empleadas fueron previamente deshidratadas hasta 5% en sus tejidos, para lo cual se utilizó sílica gel con indicador de humedad, cotejando dicho nivel de deshidratación mediante el método conocido comúnmente de la estufa. La reducción de la humedad en las semillas se realizó previo al almacenamiento por un periodo de seis meses en el cuarto frío del BANGEV, a -18 ºC y 15% de HR.
Cuadro 1 Accesiones evaluadas y resguardadas en el Banco Nacional de Germoplasma Vegetal.
| Accesiones | Paraje y municipio | Altitud (m) | Ubicación geográfica |
| A-191 | Martínez de la Torre, Ver. | 191 | 20º02’12’’ N, 97º05’44’’ O |
| A-347 | Tlapacoyan, Ver. | 347 | 19º58’36’’ N, 97º12’30’’ O |
| A-542 | San Rafael, Huehuetla, Pue. | 542 | 20º04’38’’ N, 97º38’12’’ O |
| A-545 | Tuzamapan, Pue. | 545 | 20º03’54’’ N, 97º34’39’’ O |
| A-610 | Ecatlán, Jonotla, Pue. | 610 | 20º03’30’’N, 97º33’51’’ O |
| A-630 | Zozocolco de Hidalgo, Ver. | 630 | 20º05’40’’ N, 97º40’37’’ O |
Preparación de las semillas. La escarificación se realizó manera manual retirando la testa parcialmente. Una vez que se retiró la testa, las semillas se trataron con una solución fungicida (3 g L-1 de Captan), durante diez minutos, con el fin de inhibir el desarrollo de hongos presentes en la estructura retirada.
Establecimiento del experimento. El experimento se llevó a cabo en una cámara de germinación, marca Seedburo, modelo MPG-3000, en donde se introdujeron las charolas con Peat moss® al 80% de humedad, a temperaturas de: 25°, 30° y 35 ºC. Una vez colocadas las semillas en cada cavidad, se cubrió con una capa de sustrato de 1 cm, para mantener la humedad.
Toma de datos. Las variables evaluadas fueron: 1) días a germinación; 2) porcentaje de germinación; 3) días a emergencia; 4) porcentaje de emergencia; 5) días a liberación de las hojas cotiledonares; y 6) porte de plántula a diez días de siembra.
Días a germinación: días transcurridos desde la siembra hasta la germinación de la semilla, se consideró semilla germinada, cuando ésta presentaba un crecimiento de la raíz principal, con una longitud aproximada de 1 cm. Porcentaje de germinación: se calculó contando las semillas germinadas en relación a las semillas puestas inicialmente en el experimento. Días a emergencia: días transcurridos desde la siembra a la emergencia de la plántula con las hojas cotiledonares. Se consideró como planta emergida, aquella cuyas hojas cotiledonares podían apreciarse en la superficie del sustrato. Porcentaje de emergencia: se determinó contabilizando el número de plántulas que emergieron en relación al total de semillas puestas en el experimento. Días a liberación de las hojas cotiledonares: esta etapa se determinó en aquellas plántulas en las que se observó las hojas cotiledonares plenamente desarrolladas. Porcentaje de plántulas que desarrollaron las hojas verdaderas (nomófilos): es la relación de plántulas que llegaron a liberar las hojas verdaderas, tomando en cuenta que las hojas fueran completas y con posibilidad de fotosintetizar, entre el total de semillas colocadas. Porte de plántula a diez días de emergencia: esta variable se determinó midiendo las plantas a partir del cuello de las mismas hasta el ápice.
Diseño experimental. Se aplicó el diseño en bloques completos al azar, con tres repeticiones. Los factores evaluados fueron: temperatura, con tres niveles, 25, 30 y 35 ºC, tratamiento de testa con dos niveles: sin testa “ST”, con testa “CT”, y seis accesiones: A-191, A-347, A-542, A-545, A-610 y A-630.
Análisis de los datos. Los resultados fueron analizados usando el paquete estadístico SAS, con el procedimiento GLM, y comparación de medias con base en el procedimiento de Tukey (α= 0.05).
Resultados y discusión
De acuerdo al análisis de varianza realizado de los datos del experimento, se observó diferencias estadísticas significativas (α= 0.05), en diferentes variables, por efecto de tratamiento de pregerminación, temperatura y accesiones (Cuadro 2 y 3). Por tratamiento de pregerminación, se tuvo efecto en las variables: días a germinación (Cuadro 2), días a liberación de hojas y porte de plántula a los 10 días (Cuadro 3). Por efecto de temperatura se registró diferencias en variables: días a germinación, días a emergencia (Cuadro 2), días a liberación de hojas cotiledonares, y en porte de plántula a los 10 días después de germinación (Cuadro 3). Entre accesiones, se observó diferencias en todas las variables evaluadas. En la interacción de factores, sólo hubo diferencia estadística en el porte de plántulas en la interacción de TEMP x TES (Cuadro 3).
Cuadro 2 Análisis de varianza de días a germinación y emergencia y porcentaje de germinación y emergencia.
| FV | GL | DGER | P | PGER | P | DEMER | P | PEMER | P |
| ACC | 5 | 10.2 | <.0001* | 8.25 | <.0001* | 11.07 | <.0001* | 4.89 | 0.0007* |
| TES | 1 | 11.41 | 0.0012* | 0.18 | 0.6703 | 0.07 | 0.7939 | 2.03 | 0.1587 |
| TEMP | 2 | 24.16 | <.0001* | 0.1 | 0.9045 | 43.7 | <.0001* | 0.94 | 0.394 |
| TEMP*ACC | 10 | 0.45 | 0.9145 | 1.09 | 0.384 | 1.65 | 0.111 | 1.55 | 0.139 |
| ACC*TES | 5 | 0.88 | 0.4972 | 1.65 | 0.1589 | 1.13 | 0.3532 | 0.78 | 0.5692 |
| TEMP*TES | 2 | 0.11 | 0.8917 | 0.95 | 0.3923 | 0.68 | 0.5101 | 0.04 | 0.9587 |
| TEMP*ACC*TES | 10 | 0.66 | 0.76 | 0.76 | 0.6649 | 1.11 | 0.3652 | 0.72 | 0.7046 |
| Error | 72 | 0.384 | 214.12 | 0.538 | 262.962 | ||||
| CV | 13.85 | 16.87 | 11.4 | 19.5 |
Significativa (p≤ 0.05). FV= fuente de variación; GL= grados de libertad; DGER= días a germinación; PGER= porcentaje de germinación; DEMER: días a emergencia; PEMER= porcentaje de emergencia; ACC= accesión; TES= condición de testa; TEMP= nivel de temperatura; CV= coeficiente de variación.
Cuadro 3 Análisis de varianza de días a liberación de hojas cotiledonares, porcentaje de plántulas que liberaron hojas verdaderas y porte de panta.
| FUENTE | GL | DLH | P | PLH | P | ALTP | P |
| ACC | 5 | 7.64 | <.0001* | 4.03 | 0.0028* | 9.8 | <.0001* |
| TES | 1 | 6.23 | 0.0148* | 1.43 | 0.2359 | 99.7 | <.0001* |
| TEMP | 2 | 35.33 | <.0001* | 1.13 | 0.3291 | 10.29 | 0.000* |
| TEMP*ACC | 10 | 1.55 | 0.4405 | 1.63 | 0.1166 | 1.46 | 0.1727 |
| ACC*TES | 5 | 0.19 | 0.9649 | 0.81 | 0.5454 | 1.95 | 0.0959 |
| TEMP*TES | 2 | 1.09 | 0.3432 | 0.7 | 0.4999 | 3.41 | 0.0383* |
| TEMP*ACC*TES | 10 | 1.48 | 0.1635 | 1.16 | 0.3299 | 1.41 | 0.1949 |
| Error | 72 | 0.542 | 259.259 | 5.171 | |||
| CV | 8.36 | 19.13 | 15.48 |
Significativa (p≤ 0.05). FV= fuente de variación; GL= grados de libertad; DLH= días a liberación de hojas cotiledonares; PLH= porcentaje de plántulas que liberaron hojas cotiledonares; ALTP= porte media de las plántulas. ACC= accesión; TES= condición de testa; TEMP= nivel de temperatura; CV= coeficiente de variación.
A 30 °C se obtuvo la mejor respuesta a la germinación, con menor tiempo (3.8 días), mientras que a 25 °C y 35 °C, la respuesta de germinación fue hasta los 4.6 días (Figura 1A). En porcentaje de germinación, la mejor respuesta se registró a los 25 °C (88.7%), seguida por las temperaturas de 30 y 35 °C, con 87.7 y 87.2%, respectivamente (Figura 2A).
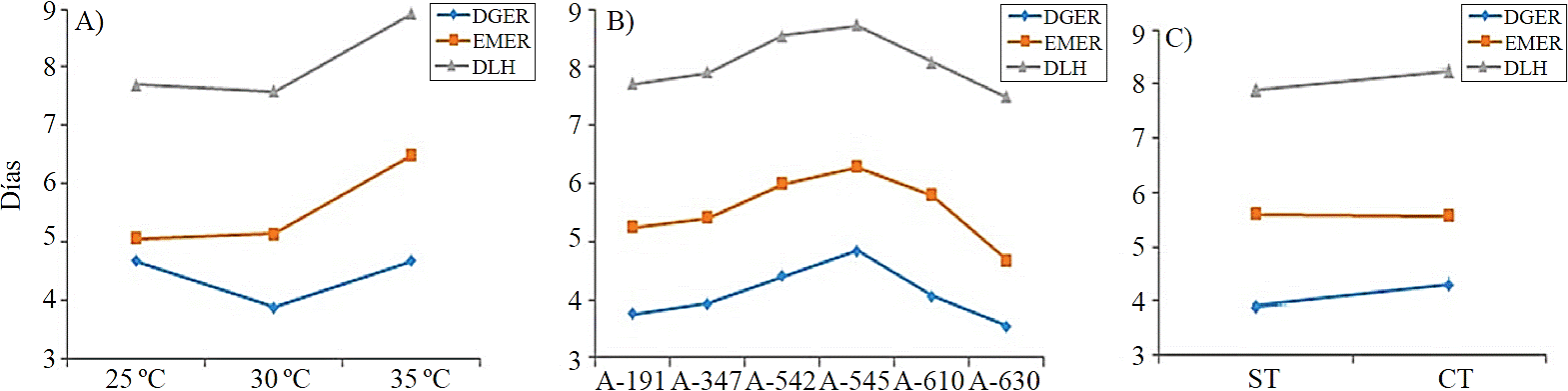
Figura 1 Días a germinación, emergencia y liberación de hojas cotiledonares por efecto de temperatura; (A) accesiones; (B); y separación de la testa (C).
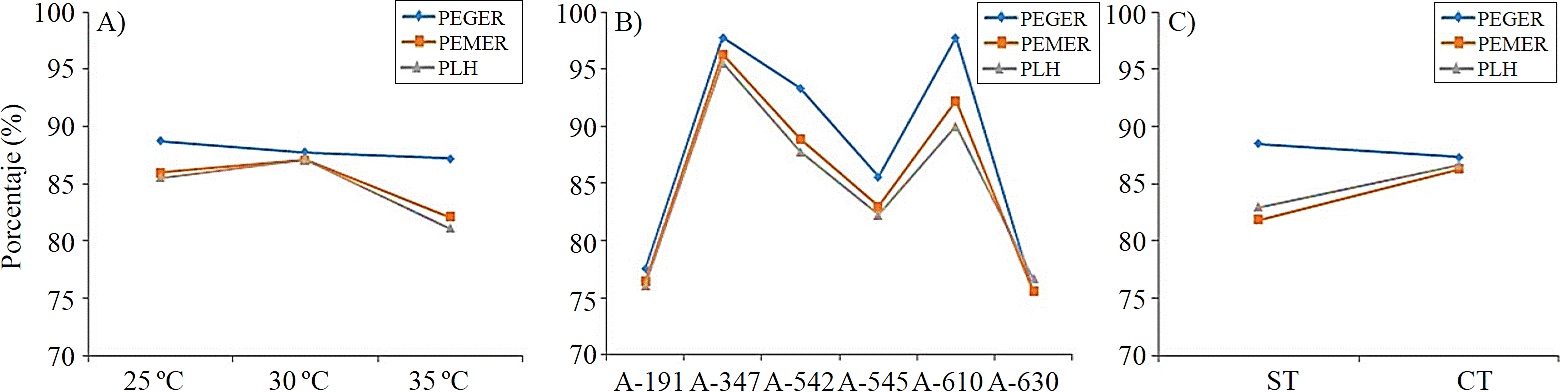
Figura 2 Porcentaje de germinación, emergencia y liberación de hojas cotiledonares por efecto de temperatura (A; accesiones; (B); y testa (C).
En la evaluación de la germinación de las semillas se observó que, la mejor respuesta se registró a los 25 y 30 °C, resultados que concuerdan con lo reportado por Windauer et al. (2012), al estudiar las respuestas de germinación de semilla de J. curcas en diferentes temperaturas relacionadas con diferente potencial hídrico, en donde observó que, a 25 °C las semillas presentan el mayor porcentaje de germinación (82%) y plántula con buen desarrollo inicial, en comparación con el tratamiento de 30°C, aunque para este último la germinación y emergencia ocurrieron más rápido, las plántulas sufrieron elongación. Trindade-Lessa et al. (2015), en estudios sobre semillas de Enterolobium contortisliquum (Vell.) Morong, encontró que la germinación fue mayor a temperatura de 25 a 30 °C (>80%), mientras que a temperatura de 40 °C fue perjudicial para el crecimiento inicial de las plántulas, lo cual evidencia que el control de la temperatura es importante durante la germinación, principalmente porque estimula la actividad metabólica y disponibilidad de algunas sustancias para el inicio de crecimiento del hipocótilo, además con una temperatura estable ayuda favorece la imbibición uniforme de las semillas, propiciando una germinación uniforme (Murcia et al., 2006). Sin embargo, es importante considerar que en otros géneros, el mayor porcentaje de germinación se obtiene en condiciones de temperatura fluctuante, como es el caso de algunas especies de Bursera sp. (Bonfil-Sanders et al., 2008).
Por efecto de tratamiento pregerminativo, las diferencias fueron significativas (p≤ 0.05), en semillas con testa, la germinación se registró a los 4.2 días, mientras que en semillas con el sin testa, la germinación fue a los 3.8 días (Figura 1C). Sin embargo, el mayor porcentaje germinación mayor se obtuvo en las semillas con testa (88.5%) (Figura 2C), no obstante, en las semillas sin testa, no hubo diferencias estadísticamente significativas en la emergencia, presentándose a los 5.5 días en ambas condiciones (Figura 1C); mientras que el porcentaje de plántulas emergidas a partir de semillas con testa fue mayor (87.2%) y 83.8% en aquellas sin testa (Figura 2C).
La separación de la testa de las semillas o escarificación, es un tratamiento frecuentemente utilizado en frutales o especies con semillas de testa dura que impide la absorción libre de agua, ya que en semillas con estas características se retarda la germinación o ésta se presenta pero muy poco uniforme. Pavón et al. (2011), al estudiar la germinación y establecimiento de Mimosa aculeaticarpa (Willd.), registraron que las semillas que fueron escarificadas presentaron mayor porcentaje de germinación, y aún mejores resultados cuando se combina este tratamiento con temperaturas de 25 a 30 °C. Sin embargo, en ocasiones los tratamientos pregerminativos tienen poco efecto en la velocidad o porcentaje de este proceso, pero puede propiciar una germinación homogénea (Brevis, 2003).
Las semillas provenientes de localidades de baja elevación (191 msnm) germinaron a los 1.1 días y las de mayor elevación (630 msnm) germinaron en 3.6 días, en promedio; mientras que las accesiones provenientes de elevaciones intermedias (350- 600 msnm), la germinación se presentó entre los 4 a 4.8 días (Figura 1B).
En porcentaje de germinación entre las accesiones, también se evidenciaron diferencias, teniendo que: para A-630 fue de 75.5%, A-347 y A-610 presentaron germinación 97.7%, A-545 y A-542 los porcentajes fueron de 85.5 y 93.3%, respectivamente (Figura 2B). Sin embargo, estos datos también involucraron sitios diferentes de colecta.
Las accesiones evidenciaron diferencias estadísticamente significativas tanto en los días a germinación (4 a 5 días), como en porcentaje (75 a 100%). Lo anterior puede deberse a que las condiciones de donde se colectaron las semillas, es decir, las condiciones en que se encuentran las plantas madre son contrastantes (Baskin y Baskin, 2001; Windauer et al., 2012). Los resultados aquí obtenidos coinciden, con lo reportado por Hernández-Verdugo et al. (2010), al evaluar semillas de chile silvestre colectados en diferentes ambientes, en el que detectaron diferencias en los patrones de germinación debido en gran parte a las condiciones del ambiente de crecimiento de la planta madre.
La emergencia de las plántulas también evidenció efecto significativo (p≤ 0.05), primordialmente en los factores de accesiones y temperatura. Para esta variable, los mejores niveles de temperatura fueron de 25 °C y 30 °C, pues las plántulas emergieron a los 5 y 5.1 días después de siembra, respectivamente, mientras que a 35 °C, se presentó a los 6.4 días (Figura 1A). Los porcentajes de germinación fueron de 88.1 y 82.1%, a 30 °C y 35 °C, respectivamente (Figura 2A), esto concuerda con lo reportado por Herrera y Elizaga (1995), al estudiar la germinación de semillas de china (Impatiens balsamica), donde el índice de velocidad de germinación aumenta hasta la temperatura optima donde se estabiliza para luego empezar a descender. En relación a la emergencia entre las accesiones, hubo diferencias estadísticamente significativas, teniendo que: la accesión A-630 emergió a los 4.6 días, seguido de A-347 y A-191 a los 5.4 y 5.2 días, respectivamente; mientras que A-545, presentó emergencia hasta los 6.2 días (Figura 1B).
En relación con el porcentaje de emergencia, las accesiones A-347 y A-610 registraron 96.3 y 92.2%, respectivamente, siendo éstas las accesiones con el más altos valores para esta variable; siendo A-630 y A-191 las accesiones con el menor porcentaje, con 75.5 y 76.4%, respectivamente (Figura 2B).
La germinación de las semillas, es un proceso importante en la propagación de una planta que debe llevar al establecimiento de la plántula, y para ello ésta debe finalizar con la emergencia. La emergencia, en muchas ocasiones está relacionada con el vigor de la semillas; es decir, la cantidad de reservas contenida (Windauer et al., 2012), la respuesta al ambiente o condiciones que se le provea (Baskin y Baskin, 2001; Pavón et al., 2011) y la sanidad de las mismas. Gally et al. (2004), realizando pruebas con semillas de soya determinaron que la emergencia de plántulas se incrementa al tratar a éstas con fungicidas, debido a que una gran cantidad de dichas estructuras germinan aun cuando éstas tengan poco vigor, pero si están infectadas por algún patógeno, la plántula no emerge. Al respecto Vázquez et al. (2011), reportaron diferencias en la emergencia y desarrollo temprano de plántulas en tres variantes de maguey. Godínez-Ibarra et al. (2007), en estudios de semilleros de Fagus grandifolia Ehrh., observaron que la germinación y emergencia de las semillas, no garantiza la supervivencia de las plántulas, ya que éstas pueden ser invadidas por enfermedades, consumidas por herbívoros o afectados por un ambiente adverso.
La liberación de hojas cotiledonares se observó en la primera semana después de la siembra, con diferencias estadísticamente significativas (p≤ 0.05) entre tratamientos. Por efecto de temperatura, los días a liberación de hojas cotiledonares se registraron a los 7.5, 7.7 y 8.9 días después de la siembra, a temperaturas de 30°, 25° y 35 °C, respectivamente (Figura 1A).
En cuanto al porcentaje de liberación de hojas cotiledonares, a 30 °C se registró el valor más alto con 87.2%, seguido de 25 °C y el más bajo 35 °C (Figura 2A). Entre las accesiones, hubo diferencias estadísticamente significativas (p≤ 0.05), en el que la accesión A-630 liberó sus hojas en menor tiempo (7.4 días), mientras que A-545 lo hizo en 8.7 días (Figura 1B).
En relación a la variable anterior, el efecto de la escarificación en ésta evidenció diferencias estadísticamente (Cuadro 3), teniendo que las semillas sin testa liberaron las hojas antes (7.8 días) que las semillas con testa (8.2 días) (Figura 1C). Sin embargo, después de varios días a la liberación de las hojas cotiledonares y el tamaño de la plántula ya no está relacionado del todo con las características de la semilla (Vázquez et al., 2011) y la sobrevivencia de las plántulas dependerá de otros factores, principalmente ambientales. Por otra parte, cuando una plántula emerge y se establece rápidamente aumenta la posibilidad de sobrevivencia, mientras que si la semilla es menos vigorosa, la germinación y emergencia se lleva a cabo más lento, la competencia es más fuerte para las plántulas por luz y espacio y posible presencia de enfermedades, lo que dificultará el desarrollo posterior (Godínez-Ibarra et al., 2007), aunque en ocasiones el porte de las plántulas en los primeros días también es influido por factores como la temperatura, que puede modificar la relación entre la parte radicular y aérea (Murcia et al., 2006). Zitacuaro y Aparicio (2004), encontraron diferencias contrastantes en porte y diámetro de plántulas de Pinus oaxacana Mirov. provenientes de tres poblaciones de México. Las diferencias genéticas, constituyen uno de los factores que promueven heterogeneidad en el porte de las plántulas en su desarrollo inicial. Alba et al. (2003), reportan diferencias en crecimiento de P. oaxacana, provenientes de diferentes ambientes, lo que concuerda con lo observado en este estudio.
En la variable porte de plántula a los 10 días después de la siembra, se registraron medias de 11 a 16 cm, por efecto de temperatura, separación de la testa y accesiones, se detectó diferencias estadísticamente significativas; tanto en los factores simples como en la interacción TEMP x TES. Considerando la temperatura, a 30 ºC se obtuvo un promedio de 15.5 cm de porte a diez días después de la siembra, mientras que a 35 ºC fue de 13.1 cm, estos resultados concuerdan con lo reportado por Murcia et al. (2006), quienes al realizar pruebas de germinación en girasol a diferentes temperaturas, registraron plántulas con mayor tamaño y peso seco a temperaturas bajas, mientras que a mayor temperatura tuvieron menor peso.
En la interacción de 35 ºC y semillas sin testa, la altura media de las plantas fue de 19.6 cm, única interacción sobresaliente. Cuando se consideró las accesiones, el porte promedio más alto fue de 16.7 cm, correspondiente a A-630, y la más baja fue 11.7 cm para A-610. En semillas con testa las plántulas que registraron un mayor crecimiento, con un promedio de 16.3 cm., y de 12 cm fueron aquellas derivadas de semillas sin testa, esto puede deberse a que, en ocasiones, la disponibilidad de reservas de los cotiledones se transfiere a la formación de estructuras o destinarse a la respiración (Simon y Meany, 1965).
Condiciones como la temperatura, humedad, luz, nutrientes, época del año de desarrollo, defoliación, ubicación del fruto en el árbol, entre otros, interactúan con la genoma de las plantas dando como resultado valores distintos, relativos a: el tamaño de semilla, color, forma, vigor y potencial germinativo, estas variaciones de condiciones de desarrollo de las semillas obligan a que éstas tengan diferentes respuestas en la germinación, emergencia y crecimiento inicial de la plántula, y de estas condiciones depende su sobrevivencia; ya que en parte de las condiciones de su origen depende las reservas que posee dicha semilla (Baskin y Baskin, 2001; Ginwal et al., 2005), y por tanto afecta la velocidad de germinación, días a emergencia, el crecimiento (Cordazzo, 2002) y el tamaño inicial de las plántulas (Moegenburg et al., 1996).
El ambiente en muchos casos también determina el comportamiento de las semillas, y éste se refleja tanto en la germinación, emergencia, y desarrollo inicial de las plántulas, así como en la dormancia después de la cosecha (Windauer et al., 2012). La respuesta dinámica de las plantas a la variación de condiciones ambientales, se observa en la adaptabilidad, condición necesaria para desarrollarse en diferentes ambientes, de igual manera para sobrevivir a los cambios de las condiciones climáticas, así como manifestar la diversidad genética de la especie (Ginwal et al., 2005).
Conclusiones
De acuerdo a los resultados del experimento, se deduce que las semillas de Jatropha curcas se ven altamente influenciadas en el proceso de germinación, emergencia y crecimiento, por efecto de la temperatura y tratamiento pregerminativo, de lo que se deduce lo siguiente.
La temperatura adecuada para propagar J. curcas desde semilla es de 25 a 30 ºC, ya que la germinación y emergencia es más rápida y ocurre en mayor porcentaje.
El tratamiento pregerminativo (separación de la testa) estimula la germinación y emergencia, ya que permite la absorción de agua sin limitaciones. Sin embargo, las semillas sin tratamiento (semillas con testa completa) incremente el porcentaje de germinación y emergencia.











 texto en
texto en 


