Trompillo, angelitos o encyclia conejo (Encyclia adenocaula (La Llave & Lex.) Schltr), es una orquídea endémica de México distribuida en los estados de Nayarit, Jalisco, Michoacán, México, Guerrero y Oaxaca. En el estado de México se encuentra en los municipios de Temascaltepec, Tejupilco y Valle de Bravo (Ruíz et al, 2008; Szeszko, 2011; Téllez, 2011), es una de las 188 especies enlistadas en la NOM-059-SEMARNAT-2010 (SEMARNAT, 2010) en la categoría "Amenazada". Debido a sus llamativas flores (inflorescencias de 60 cm a un metro de largo, con 10 a 35 flores) y a su agradable fragancia de medio día, la especie ha sido sobrecolectada provocando involuntariamente la disminución considerable de sus poblaciones naturales (Ruíz et al, 2008; Szeszko, 2011), sumando, el cambio climático y los desastres forestales que está sufriendo su ecosistema. Es importante conservar la especie tanto en condiciones in situ como en ex situ, una estrategia fundamental de esta última, es la implementación de bancos de germoplasma (Lascuráin et al. 2009; Sánchez y Jiménez, 2010).
En México la gran mayoría de los bancos de germoplasma están destinados a conservar especies de interés agroalimentario, aunque existen algunos bancos encargados de colectar especies silvestres, prioritarias, con problemas de viabilidad, en alguna categoría de riesgo, etc. (Lascuráin et al. 2009). Los esfuerzos realizados por conservar la familia Orchidaceae han sido exhaustivos, mediante la implementación de bancos de germoplasma vegetal en condiciones in vitro por método de crecimiento mínimo o lento crecimiento. Sin embargo, al igual que en jardines o colecciones vivas el mantenimiento del germoplasma requiere de instalaciones adecuadas y mantenimiento especializado encareciendo los costos de conservación, la conservación de germoplasma por semillas es una estrategia viable para conservar la mayor variabilidad genética posible con menores costos y en espacios muy reducidos.
Determinar la calidad de las semillas almacenadas es un punto importante para determinar el éxito o fracaso de la conservación en los bancos de germoplasma. En el análisis de semillas se deben estudiar características físicas y biológicas de un lote para asignarles un valor, estas pruebas se deben realizar en dos momentos: el primero, inmediatamente después de la extracción y limpia de semillas; y segundo, antes de ser sembradas o utilizadas para cualquier otro destino y los principales análisis son, peso y tamaño de semillas, viabilidad, pureza, humedad, etc. (Raó et al, 2007).
Ossenbach et al., (2007), realizaron pruebas de viabilidad en semillas de orquídeas de 22 accesiones de 10 especies diferentes y determinaron que un pretratamiento con Ca (OCl)2 como desecante afecta significativamente la viabilidad de las semillas y la prueba de Tetrazolio es un método muy válido para determinar la viabilidad de semillas de orquídeas, sin embargo, ellos determinaron que la precisión de estos estudios se ve afectada por la capacidad del analista que los interpreta.
Existen diversos trabajos que evalúan la germinación de semillas de orquídeas; sin embargo, su principal objetivo es evaluar porcentajes de germinación y velocidad de germinación en diferentes medios con la finalidad de establecer el protocolo de propagación in vitro de cada una de las especies, solo Salazar-Mercado (2012), realizó pruebas de germinación comparando las de tetrazolio para demostrar viabilidad de semillas tropicales colombianas.
El objetivo del presente estudio fue analizar la calidad física y fisiológica de semillas de Encyclia adenocaula como especie modelo y prioritaria en el Estado de México, para su conservación en un banco de germoplasma de semillas.
El estudio se realizó en el laboratorio de cultivo de tejidos y en el Invernadero 5 que alberga la colección de orquídeas de la Facultad de CienciasAgrícolas de la UniversidadAutónoma del Estado de México. Se utilizaron semillas de cápsulas maduras de una población de E. adenocaula polinizadas en el año 2012 y colectadas en mayo del 2013 procedentes de plantas de la comunidad denominada "El Peñon" en el municipio de Temascaltepec, México, localizado UTM 14Q 381736 y 2106024 con 1789 msnm; en el laboratorio se procedió a retirar los remanentes de las flores y se colocó en sobre de papel hasta su dehiscencia a temperatura ambiente, una vez abiertas la cápsulas se procedieron a abrir por completo siguiendo las líneas longitudinales sobre una superficie de vidrio. Una vez extraídas todas las semillas, se procedió a retirar partículas extrañas o restos de las cápsulas con ayuda de unas pinzas para su posterior almacenamiento en frasco ámbar en refrigeración (10 oC) hasta su utilización.
En el análisis de semillas de E. adenocaula se tomaron en cuenta aspectos como tamaño, peso y estructura de la semilla y la viabilidad de la misma. Para tamaño y estructura de la semilla se tomó una muestra que fue colocada en tres portaobjetos, con ayuda de un microscopio óptico (Leica Microsystems Ltd. Leica Application Suite V4) y el paquete computacional Image Tool 3.00 (UTHSCSA) se midieron 300 semillas de la especie tomando como dato largo y ancho de la semilla y áreas de cobertura de las estructuras de la semillas. Para determinar el peso, se tomaron 0.0001 g de semilla por triplicado y se contabilizaron, por regla de tres se obtuvo el peso y numero de semillas por gramo.
La viabilidad de las semillas se determinó mediante dos técnicas: 1) la prueba de Tetrazolio (TDZ) que es una prueba rápida y la de germinación. En la primera se siguió la metodología de Bohm (1996), citada en Ossenbach et al., 2007. Se estableció un diseño completamente al azar con tres repeticiones, donde se evaluaron cuatro tratamientos, que consistió en sumergir paquetes de papel filtro con 0.0001 g semillas en: T1) 24 h de imbibición en agua destilada, después se remplazó por solución de Ca(OCl)2 por dos horas y posteriormente 24 h en solución de TDZ; T2) 24 horas de imbibición en agua destilada y 24 h en solución de TDZ; T3) 24 h de imbibición en agua destilada, después se sustituyó por solución de Ca(OCl)2 por dos horas y posteriormente 24 h en solución de TDZ más dos gotas de Twenn 80 y T4) 24 horas de imbibición en agua destilada y 24 h en solución de Tetrazolio más dos gotas de Twenn 80. Se realizó un análisis de varianza y pruebas de Tukey al 5% con ayuda del programa estadístico The SAS System for Windows 9.0.; y 2) La prueba de germinación se utilizó un diseño completamente al azar con diez repeticiones mediante la técnica de siembra in vitro. El medio de cultivo fue Murashige y Skoog (MS) (1962) como medio basal, complementado con glicina (2 mg L-1), mio-inositol (100 mg L-1) tiamina HCl (0.4 mg L-1), piridoxina (0.5 mg L-1), ácido nicotínico (2 mg L-1), sacarosa 30 mg L-1 adicionados como tratamientos: 1 g L-1 Carbón vegetal (MS+CA); 10% de extracto de plátano (MS+P); 10% de agua de coco (MS+AC); se ajustó pH a 5.7 ± 1 con 6 g L1 de agar. Los cultivos fueron incubados a 24 ± 2 °C, 18/6 h de fotoperiodo a una intensidad luminosa de 27 μmol m-2s-1.
Se consideró como germinación la etapa fenológica denominada protocormo inicial, esto porque es una etapa visualmente fácil de detectar. Con ayuda de un microscopio estereoscópico, una cámara fotográfica y el paquete computacional Image Tool 3.00 (UTHSCSA) se obtuvieron imágenes de un campo por repetición. Se realizó un análisis de varianza y pruebas de Tukey al 5% con ayuda del programa estadístico The SAS System for Windows 9.0.
Después de los estudios realizados se pudo determinar que E. adenocaula presenta semillas filiformes y largamente elongadas, con una longitud de 0.56±0.08 mm y un ancho de 0.09±0.01 mm, cubriendo un área de 3.25±0.5 mm2, estos datos se tomaron de semillas completas (embrión y testa) (Figura 1), resultados que concuerdan con lo reportado para otras especies de orquídeas desde 1992 por Arditti así como Hágsater et al. (2005), Verdugo et al. (2007), Téllez (2011) y Aguilar y López (2013), reportando tamaños de semillas de 0.25 a 1.2 mm de largo y 0.09 a 0.27 mm de ancho.
La semilla presentó las dos estructuras básicas de las semillas correspondientes a la familia Orchidaceae; un embrión carente de endospermo (reserva de nutrientes) con un área aproximada de 0.01±0.01 mm2. El peso aproximado de una semilla fue 1.6±0.08 μg, lo que equivale a 63 500 semillas por gramo aproximadamente.
La viabilidad de las semillas permite determinar si una semilla está viva y tiene la capacidad de germinar (Ruiz, 2009). De acuerdo a las pruebas de viabilidad, la prueba de TDZ, denominada prueba rápida, se registraron diferencias estadísticas significativas (p≤ 0.05) entre los tratamientos, no presentando diferencias significativas los tratamientos T2 (50.3 % ) y T4 (48.2%); es decir, que el pretratamiento con Ca(OCl)2 afectó directamente la viabilidad de las semillas, en donde se utilizó esta solución los porcentajes fueron más bajos correspondientes a los tratamientos T1 y T3 con 24.1 %y 48.2 % respectivamente, resultados que concuerdan con Ossenbach et al. (2007) para cinco especies de orquídeas entre ellas Encyclia ochracea donde obtuvo el 95% de viabilidad sin pretratamiento con Ca(OCl)2 y 85% con pretratamiento.
Lallana y García (2013) reportan una viabilidad de 90 y 85% en semillas de Trichocentrum jonesianum,Salazar-Mercado (2012), en semillas de Cattlella mendelii con 93% de viabilidad y Salazar y Cancino (2012) reportan 87.2 y 80.6% de viabilidad en semillas de P. vespay S. klotzcheana respectivamente con el mismo método. De acuerdo al análisis estadístico no existió ningún efecto significativo en la adición de gotas de Twenn 80 con respecto a la perdida de viabilidad, sin embargo, con la adición de este producto se logró una mejor observación en la coloración del embrión.
La evaluación del porcentaje de viabilidad mediante la técnica de germinación in vitro, mostró diferencias estadísticas significativas (p≤ 0.05) entre los tratamientos resultando como mejor tratamiento MS+CA con una germinación del 56.9% a los 30 días, seguido del medio MS+AC con 31.4% de germinación a los 55.7 días, por último el medio MS+P con 23% a los 59.1 días. Resultados que concuerdan con lo reportado en Ruíz et al. (2008) para la misma especie 62.4% de germinación a los 27 días, aunque la diferencia en porcentajes puede estar dada principalmente por la procedencia del material establecido en los experimentos. Sin embargo es de hacer notar que la germinación en los trabajos puede ser considerada desde la imbibición de las semillas como lo consideran varios autores hasta la presencia de primeras hojas, esto debe deberse tal vez al objetivo de los trabajos.
Sin embargo, en un mismo tratamiento las semillas germinaron de manera asincrónica; es decir, en igual condición después de dos meses de su establecimiento se observaron las diferentes etapas de germinación y desarrollo in vitro de las especie: Imbibición, presentando un hinchamiento y el embrión tomó una coloración verde pálido ocasionado por la absorción de agua (Figura 2A); semilla verde, las semillas presentaron un coloración verde acentuada y el embrión comienza a aumentar de tamaño entre los 15 días después de la siembra (Figura 2B); germinación, a los 30 días el embrión rompe la testa (Figura 2C), Protocormo inicial; a los 36 días se formó un complejo de células de color verde muy tenue, apareciendo el primordio foliar (Figura 2D); protocormo tardío, el protocormo siguió su crecimiento, naciendo en el ápice un primordio foliar a los 40 días después del establecimiento (Figura 2E); desarrollo de hojas; el primordio foliar continuó creciendo, el cuerpo del protocormo comenzó a disminuir y a diferenciarse las hojas a los 47 días aproximadamente (Figura 2F); desarrollo de raíces, se presentó a los 57 días aproximadamente, el primordio de la raíz se desarrolló cerca de la base de las hojas de color blanco (Figura 2G); plántula completa, se distinguieron raíces y hojas perfectamente (Figura 2H); as etapas que se observaron coincidieron con lo reportado con Flores et al. (2008), Salazar y Cancino (2012), Aguilar y López (2013) en algunas especies de orquídea.
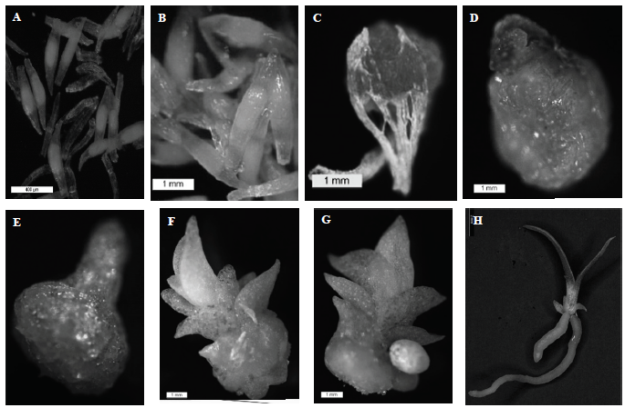
Figura 2 Germinación y desarrollo in vitro de Encyclia adenocaula.A. Imbibición a los ±7 días después de la siembra, barra de escala 400 μm. B. Semillas verdes, ±15 días. Barra de escala 1mm. C. Germinación, ±30 días, barra de escala 1mm. D. Protocormo inicial, ±36 días, barra de escala 1mm. E. Protocormo tardío, ±40 días, barra de escala 1 mm. F. Desarrollo de hojas, ±47 días, barra de escala 1 mm. G. Desarrollo de raíz, ±57 días, barra de escala 1mm. H. Plántula completa, barra de escala 2 mm. Microfotografías.
Conclusiones
El presente trabajo permitió determinar algunas características físicas de las semillas de Encyclia adenocaula como: la estructura, las dimensiones y el número de semillas por gramo (0.56±0.08 mm de largo por 0.09±0.01mm de ancho, y 63 500 semillas por gramo aproximadamente).
En cuanto a la calidad fisiológica se verificó para E. adenocaula que la viabilidad mediante la prueba de Tetrazolio al 1%, es fácil y rápida (en tres días alcanzó 50.3%) comparada con los resultados obtenidos mediante la germinación in vitro en medio MS adicionado con carbón activado a los 30 días (alcanzó un 56.9%). Se observó que el pretratamiento con Ca(OCl)2 (desecante) disminuye la viabilidad de semillas.
La germinación in vitro de E. adenocaula se presentó de manera asincrónica lográndose determinar el proceso de germinación y desarrollo in vitro de la especie, desde su imbibición hasta la formación de plántula.
Conservar los recursos en un banco de semillas permite eliminar problemas intrínsecos de la conservación ex situ, como la pérdida de viabilidad genética debido al efecto de fundador, analizando la calidad de las semillas podemos almacenarlas con la seguridad de que en un tiempo determinado se logrará su regeneración sin problemas.











 texto en
texto en 



