Introducción
El melón (Cucumis melo L.) es un cultivo herbáceo anual, rastrero, de tallos gruesos y hojas pecioladas, perteneciente a la familia Cucurbitaceae. El melón es ampliamente cultivado por su fruto comestible y es una de las hortalizas de mayor importancia, tanto mundial como nacional, por su producción y área sembrada. En 2012 se produjeron 32 millones de toneladas en todo el mundo. El genoma del melón contiene presuntamente 27 427 genes que codifican para proteínas y se le propone como modelo para estudiar la maduración del fruto, determinación del sexo y fisiología del floema (García-Mas et al, 2012).
La proteína que consume la humanidad proviene en su mayoría de los vegetales, siendo las leguminosas el grupo principal de estas, con la soya como el cultivo más importante, seguida del frijol. Los granos de las leguminosas comestibles son nutricionalmente importantes, como la principal fuente de proteínas (20 a 40% o más de la ingesta diaria) de bajo costo en la dieta de la población mexicana (Chagas and Santoro, 1997; Pérez et al, 2002).
La familia de las leguminosas y en particular el caso de la soya, es un claro ejemplo de semillas ricas en proteína usada en la alimentación, y en el caso de la familia de las cucurbitáceas se puede tomar como ejemplo a la pepita o semilla de calabaza (Cucúrbita pepo), ya que la semilla contiene 31% de proteínas, 36% de lípidos y 15% de hidratos de carbono, muy consumida en la República Mexicana, aunque desperdiciada en otros países (Martínez et al., 2011). La semilla de melón, además de poseer cualidades medicinales (Ravishankar y Vishnu, 2012), es una fuente de proteínas (27%) y aceite (35%), lo que permitiría mejorar la alimentación y contribuir a rescatar las raíces culinarias (Leyva y Pérez, 2015).
Concentrados de proteína, como las faseolinas, se han agregado a productos cárnicos, galletas y pan, con éxito. La estabilidad de las emulsiones de alimentos es afectada por el origen de las proteínas, su método de extracción, el pH y la adición de otros compuestos, como polisacáridos. A las bebidas energéticas para atletas se les añaden aminoácidos ramificados (valina, leucina, isoleucina) por el supuesto que estos disminuyen la síntesis de serotonina en el cerebro, neurotransmisor relacionado con la fatiga, y que la ingesta de aminoácidos ramificados podría retrasar el cansancio e incrementar el rendimiento deportivo. Las proteínas de melón aportan 167% de las necesidades diarias de ingesta de isoleucina, 113% de leucina, 51% de lisina, 37% de metionina y 169% de fenilalanina (Hu y Ao, 2007; Makri y Doxastakis, 2006).
Además, en las proteínas de la semilla de melón se han encontrado propiedades antifúngicas (Ferreira et al., 2007). Un mejor conocimiento de las proteínas de reserva permite su utilización para aplicaciones novedosas, como la producción de vacunas (Maruyama et al, 2014) o usos especiales, como dietas para prevenir o tratar enfermedades (Tandang et al., 2011). Por ejemplo, en la ingesta de proteína, la relación lisina:arginina se recomienda sea menor a 2 ya que esto es importante para el control de la hiperlipidemia y arterioesclerosis (Martínez y Sánchez, 2004). La semilla de melón es un recurso usado en la alimentación humana de manera tradicional pero que ha caído en desuso por lo que consideramos que su estudio permitirá reconsiderarla como un recurso alimenticio y valioso por su composición.
Materiales y métodos
La semilla (aproximadamente 50 g) se molió finamente y se desgrasó con una mezcla de cloroformo-metanol 2:1. La harina desgrasada se usó para la extracción de proteínas (Syros et al, 2003). Las proteínas de reserva se extrajeron de manera secuencial, incubando 1 h cada vez, primero con agua destilada, para extraer albúminas; al término de la hora de incubación, con agitación, se centrifugó 25 min a 13 000 x g en la microfuga (marca Eppendorf) y se tomó el sobrenadante; al precipitado se le agregó cloruro de sodio 0.5 M en Tris 50 mM pH 8, para la extracción de globulinas, incubando una hora a temperatura ambiente con agitación, se centrifugó como se mencionó y se tomó el sobrenadante; a la pastilla se le agregó 2-propanol al 55% (v/v), se incubó una hora en agitación y se centrifugó nuevamente para extraer prolaminas, guardando el sobrenadante.
A la pastilla se le agregó amortiguador de boratos 0.1 M con SDS 0.5%, pH 8; para la extracción de glutelinas, se incubó una hora con agitación a temperatura ambiente (Syros et al., 2008). Para la separación de proteínas se emplearon geles desnaturalizantes al 10% con amortiguador de tricina (Shagger y von Jagow, 1987). Para la extracción de proteína a diferentes valores de pH (2, 4, 6, 7, 8, 10, 12); se pesó 1 g de harina desgrasada y se agregaron 5 mL de agua destilada y se llevó al pH correspondiente agregando pequeñas cantidades de NaOH o HCl (1N ó 0.1 N), se completó el volumen a 10 mL, se incubó con agitación durante una hora y se centrifugó una hora a14 000 x g en centrifuga (Wolfy Sathe 1998; Meng y Ma, 2002; Tavano y Neves, 2008). El contenido de humedad de la semilla se determinó pesando 20 granos e incubando a 80 °C durante 24 h (Raya et al, 2014). Crioprecipitación: se pesó 0.1 g de harina desgrasada y se agregó 0.5 mL de agua, se agitó durante una hora y se centrifugó por 30 min a 15700 x g en la microfuga; se extrajo el sobrenadante.
Al residuo (pastilla) se le agregó nuevamente 1 mL de H2O destilada y se extrajo por 12 h a 4 °C (toda la noche), al día siguiente se centrifugó nuevamente bajo las condiciones mencionadas, y se juntaron los sobrenadantes de ambas extracciones en un tubo de 1.5 mL y fueron llevados a refrigeración (4 °C) por 12 h y se centrifugó 45 min a 15 700 x g. Al sobrenadante se le agregó ácido clorhídrico para lograr una concentración de (HCl) al 0.025 M. Se refrigeró por una hora y se centrifugó 30 min a 15 700 x g a fin de obtener el precipitado de proteína (Montoya et al., 2008). La proteína se cuantificó por triplicado mediante el método de Bradford (1976).
La cuantificación de minerales se llevó a cabo usando un microscopio electrónico de barrido, marca Jeol, acoplado a una sonda dispersiva de Rayos X en pastillas de la harina de semilla de melón. Se hicieron al menos tres análisis por muestra. Esta técnica de cuantificación da resultados equiparables a otras y ha sido utilizada para muestras biológicas (Liu et al, 2007; Raya y Aguirre, 2009).
Digestibilidad in vitro: se tomaron muestras por triplicado de 100 µl del extracto de proteína y se colocaron por separado, ajustando con HCl a pH 2; se preincubaron 30 min a 39 °C en baño María y se le agregó 10µl de la enzima pepsina (10 mg mL-1) (pepsin from porcine gastric mucosa, Sigma); se tomó una alícuota de 25 µL y al resto se le agregó tripsina-quimotripsina (10mg/mL) (Trypsin type IXS from porcine pancreas, Sigma; chymotrypsinogen A type II from bovine pancreas, Sigma) y se incubó 120 min a 39 °C; tomando 20 µL de cada una de las alícuotas obtenidas en la digestibilidad in vitro, las muestras fueron cargadas en el gel. Al término de la electroforesis el gel se tiñó con azul de Coomassie (Montoya et al, 2008).
Extracción de aceite: se pesó 1 g de harina; se colocó dentro de un filtro previamente pesado y este se puso dentro de un vaso; se le agregó hexano en una relación de 4:1 volumen/ peso, se cubrió el vaso para evitar que se evaporara el solvente y se dejó incubar por 18 h.Al término de este tiempo el vaso fue llevado al Soxleth marca Tecator modelo 1043; el vaso en el equipo se calentó por dos horas y se destiló por otras dos horas y se evaporó el solvente. Una vez extraído el aceite se pesó el vaso y el filtro y por diferencia, se obtuvo el rendimiento de aceite. Actividad inhibitoria contra enzimas tipo tripsina: se determinó midiendo el incremento de absorbencia a 253 nm en un lector espectrofotométrico VELAB modelo 722-2000 y utilizando como sustrato sintético el N-a-Benzoil-L-Arginina p-nitroanilida (BApNA) (Raya et al, 2014).
Esta actividad está definida como el número de unidades de enzima inhibidas, y es calculada por la fórmula:
Donde: UI/mL = unidades de inhibición por mililitro; Abs Enz = absorbencia de la enzima; Abs Inh = absorbencia del inhibidor; Vi = volumen del inhibidor en mL.
Se usaron 60 µL de cada extracto proteico, se usó de control de enzima a la tripsina bovina (200 µg mL-1) y como sustrato se utilizó el N-benzoil-arginina-p-nitroanilida (BApNA).
Determinación de cenizas: se pesaron dos gramos de la muestra en un crisol previamente tarado y seco; el crisol y su contenido se calcinaron, primero sobre una llama baja, evitando en lo posible la formación excesiva de hollín, hasta que se carbonizó y luego se pasó a una mufla durante 4 h.
Resultados y discusión
El contenido de aceite para semilla de melón se reporta como de 35.36%, un contenido similar al hallado en este estudio para el melón chino, aunque el melón verde presentó un contenido menor (23.28%), pero importante, superior al de otras oleaginosas (Hu y Ao, 2007; Raya et al, 2012).
Un melón chino puede contener unos 14 gramos de semilla por fruto, en promedio; el verde o liso puede rendir unos 21 gramos. La composición del aceite de la semilla de melón es de un 53.9% de linoleico, 12.1% de oleico, 23.9% de palmítico y 5.7% de esteárico. Un 67.5% son ácidos grasos insaturados (Hu y Ao, 2007). Comparativamente, el aceite de oliva contiene 71.9% de oleico (18:1) y 7.5% de linoléico (18:2) (Dubois et al, 2007).
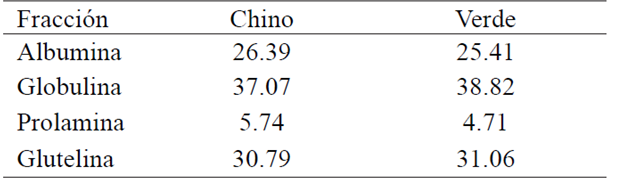
El contenido de proteína total, dio 27.34% para melón chino (Hu y Ao, 2007). Para melón verde se reportó un valor de 29.9% (Cuadro 1), cantidad similar a la encontrada en este estudio. La distribución de las fracciones proteicas para la harina desgrasada (Cuadro 2) muestra que la fracción que se encuentra en mayor presencia es la globulina 37%, mientras que la que se encuentra en menor contenido es la fracción prolamina con 6%, respecto a la proteína. De la semilla de capulín se extrajo más proteína soluble en agua (fracción albumina) que con los otros solventes, aunque también se logró extraer una buena cantidad con solución salina y con boratos. Esto concuerda con lo reportado por otros autores, ya que las dicotiledóneas presentan como principales proteínas de reserva albúminas y globulinas. Otros autores han reportado diferencias en el contenido de proteína y en la abundancia relativa de las distintas fracciones, lo cual podría deberse a las variedades usadas o condiciones de cultivo (Mandal y Mandal, 2000; Tavano y Neves, 2008; Raya, et al, 2012).
Cuadro 1 Contenido de aceite, proteína, cenizas y humedad de la semilla de melón chino y melón verde.

El contenido de carbohidratos se calculó por diferencia con el resto de los componentes.
La distribución de las fracciones proteicas para la harina de melón verde (Cuadro 2) muestra que la fracción más abundante es la de globulinas con 38% mientras que la que se encuentra en menor cantidad es la fracción prolamina con un 4.7%.; en la fracción globulinas se obtuvo una concentración de 5.83 mg/mL. En frijol criollo, las albúminas constituyen un poco más de la mitad de la proteína soluble extraída (Raya et al, 2014), aunque las leguminosas contienen cantidades altas de globulinas (Tavano y Neves, 2008).
La fracción que más abunda en la proteína de melón chino es la fracción globulina que está en el tercer carril (Figura 1A, B), seguida de la fracción glutelina en el quinto carril y donde se puede apreciar que es de bajo peso molecular. En el segundo carril se encuentra la albumina la cual contiene proteínas de alto a bajo peso molecular, siendo más abundantes las de bajo peso molecular. La fracción menos abundante es la prolamina, con proteínas de bajo peso molecular (Figura 1).
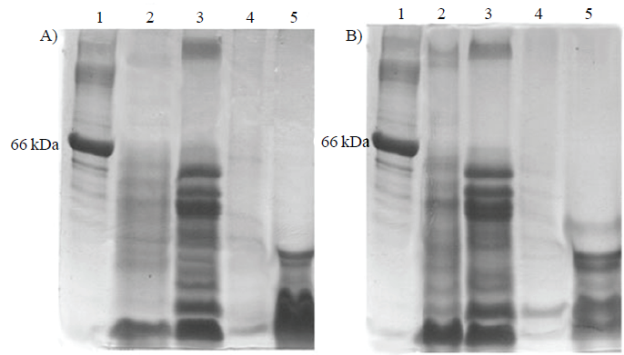
Figura 1 Patrón electroforético de las fracciones proteicas de la semilla de melón. A. Melón chino. Carril 1 marcadores de peso molecular (MPM); 2 fracción albumina; 3 fracción globulina; 4 fracción prolamina; y 5 fracción glutelina. B. melón verde. Carril 1 MPM; 2 fracción albumina; 3 fracción globulina; 4 fracción prolamina; y 5 fracción glutelina.
En la Figura 1B se aprecia el patrón electoforético de proteínas de semilla de melón verde, muy semejante al del melón chino (1A). Esto indicaría que al menos en este nivel es poca la diversidad existente y que probablemente una variedad dio origen a la otra.
En la Figura 2 se muestran proteínas solubles precipitadas de ambas variedades, donde nuevamente se observa un patrón muy semejante entre ambas variedades. En el verde se observan algunas bandas enriquecidas un poco por debajo de la altura del marcador de peso molecular (66 kDa, carril 1). Extracción de proteína de semilla de melón a diferentes pHs. De acuerdo a los datos obtenidos para la concentración de los extractos de proteína, el tratamiento que resultó en una mayor concentración fue la extracción con agua a pH 8, 6.29 mg mL-1.
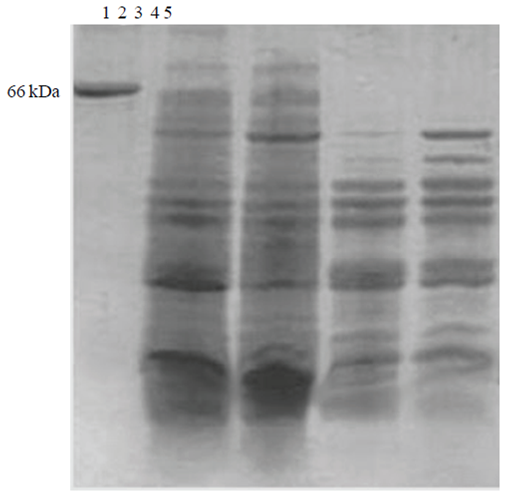
Figura 2 Patrones electroforéticos de proteína precipitada con ácido clorhídrico o con baja temperatura. Carril 1 MPM (66 kDa); carril 2 proteína de melón chino precipitada con ácido clorhídrico; carril 3, proteína de melón verde precipitada con ácido clorhídrico. Carril 4, proteína de melón chino crioprecipitada; carril 5, proteína de melón verde crioprecipitada
La alta solubilidad de la proteína se debe a la baja hidrofobicidad de su superficie; su alta solubilidad a pH neutro y ácido posibilita su uso en bebidas y alimentos líquidos (Meng y Ma, 2002). La proteína de semilla de capulín es insoluble a pH muy ácido, (Raya et al., 2012), La proteína de frijol rojo ("red bean") tiene un mínimo de solubilidad a pH 5; algo similar a lo observado con la de melón, que es poco soluble a pH 4 (carril 4, Figura 3), (Chagas y Santoro, 1997). La proteína de Cicer arietinum tiene un mínimo de solubilidad entre pH 4.5 a 6 y es prácticamente insoluble a pH 5 (Tavano y Neves, 2008).
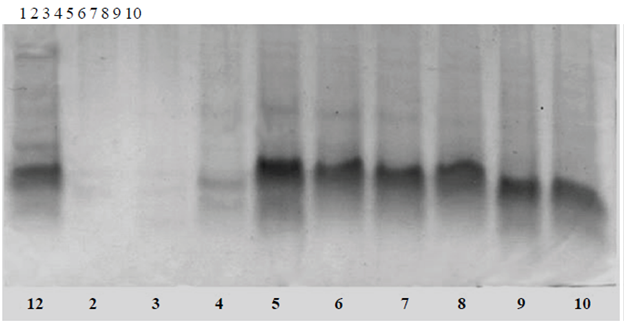
Figura 3 Extracción de proteína a diferentes valores de pH. La extracción de proteína a pH 8 parece ser la mejor; a pH ácido, 2,3 y 4 casi no se extrae proteína, seguramente por la baja solubilidad a estos pH. La mayor cantidad se extrajo a valores de pH básicos o ligeramente ácidos (pH5.6).
En la Figura 4 se muestra la digestión de proteína extraída de semilla y tratada con enzimas digestivas; las observaciones indican que es una proteína de fácil digestión. Esto daría pie para su utilización en dietas especiales donde se requiere proteína con estas características. Por ejemplo, alimento para bebés, deportistas (Ardura et al., 2000).
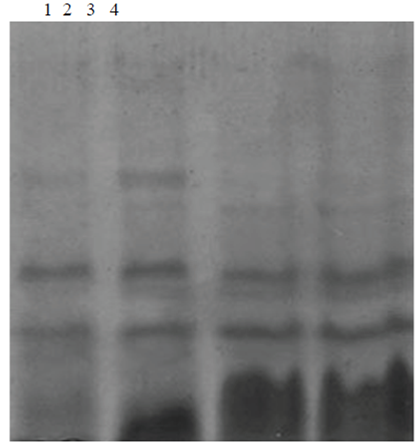
Figura 4 Proteínas solubles de melón tratadas con enzimas digestivas. Se muestran en el carril 1 proteína digerida solo con pepsina. En el carril 2, proteína digerida con pepsina y quimotripsina. En los carriles 3 y 4 se observan los péptidos al fondo del gel en los tratamientos con pepsina, tripsina y quimotripsina.
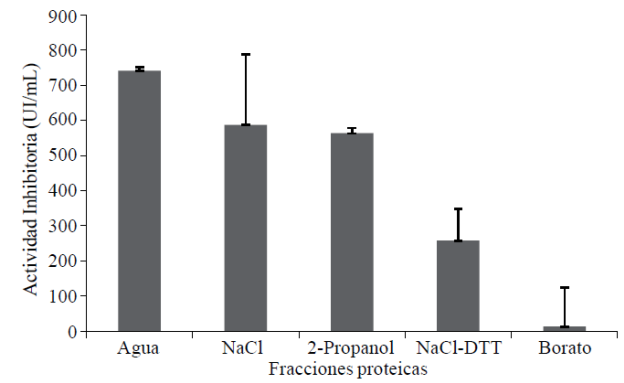
El extracto que presentó mayor actividad inhibitoria contra proteasas fue el extracto proteico obtenido con agua, el cual corresponde a la fracción albúminas; los extractos correspondientes a globulinas y prolaminas tienen una actividad similar entre ellos (Figura 5), el extracto de globulinas con el agente reductor ditiotreitol (DTT) muestra una gran disminución de la actividad enzimática y en el extracto de glutelinas tiene poca actividad inhibitoria. En la semilla de capulín y en la de C. arietinum, la fracción de albúminas presenta la actividad más alta, seguida de las glutelinas (Tavano y Neves, 2008; Raya et al, 2012). No obstante, observaciones en el laboratorio indican que estas semillas son fácilmente colonizadas y consumidas por plagas de almacén, su alto contenido proteico y lipídico sin duda permite proponerlas como ingrediente para dietas para este tipo de organismos, algo que valdría la pena explorar (Wang et al, 2014).
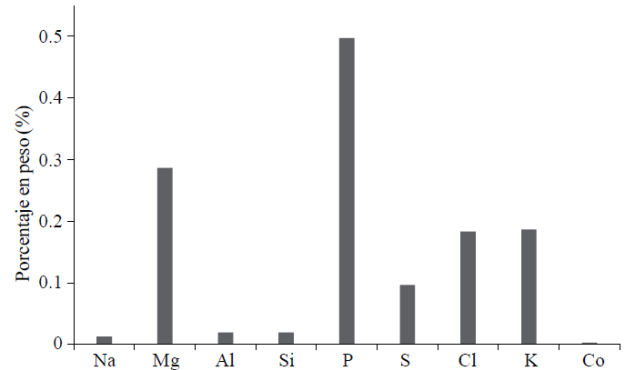
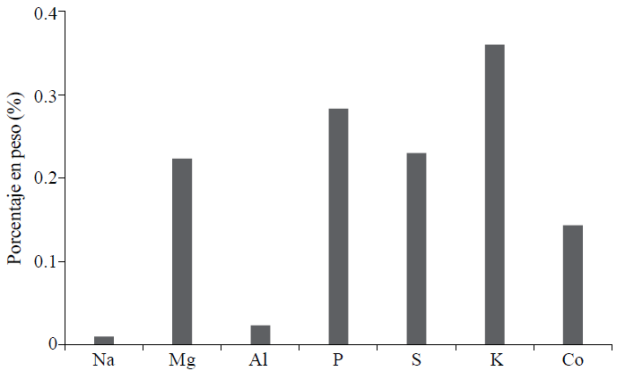
La semilla de melón chino contiene gran cantidad de fósforo (P) en relación a los otros elementos que contiene, seguido de magnesio (Mg) (Figura 6), por lo cual se puede considerar a esta semilla como alimento con buen aporte de fósforo y magnesio. En comparación con la semilla de melón verde, la de melón chino contiene silicio (Si) y cloro (Cl) (Figura 7).
La semilla de melón verde es rica en potasio (K), seguido por fósforo (P), magnesio (Mg) y azufre (S); la de melón contiene entre un 0.3% y 0.5% de fósforo (Figura 7), un contenido algo más bajo que lo reportado para la semilla de Nicotiana glauca (Hoeking, 1980). Ambas variedades presentaron un contenido de potasio, entre 0.2 y 0.35%; para semillas de Nicotiana reportaron 1030 mg/100 g y para capulín 700 mg/100 g. El azufre se aproxima a lo reportado para Nicotiana (190 mg/100 g), lo mismo que el magnesio 350 mg/100 g; para semilla de capulín se hallaron 120 mg/ 100 g (Hoeking, 1980; Raya et al, 2012).
En la semilla de frijol (Phaseolus vulgaris) el contenido de molibdeno (Mo) difiere por un orden de magnitud entre suelos ricos y pobres en este elemento; la cantidad de minerales presente en la semilla es, en algunos casos, lo que tendrá a disposición la planta para su desarrollo (Tyler y Zohlen, 1998). En el grano de sorgo (Sorghum halepense), las concentraciones de fósforo (P), potasio (K), y magnesio (Mg) decrecen significativamente cuando disminuye la suplementación de estos elementos (Tyler y Zohlen, 1998). El contenido de cobalto (Co) y el de azufre es mayor que en la semilla de melón chino. El Co es requerido para la fijación biológica de nitrógeno, pero la absorción en melón podría deberse simplemente a que está presente en el suelo; el cobalto presente en la semilla puede prevenir la clorosis de la futura planta (Tyler y Zohlen, 1998). Hay un gran componente hereditario en cuanto a la acumulación de elementos minerales por parte de las plantas (Hodson et al., 2005). El Instituto Nacional de la Nutrición, en México, recomienda una ingesta diaria, para adultos, 350 mg de Mg, fosfatos 800 mg y potasio 900-2 700 mg diarios.
La semilla de melón es una fuente adecuada de potasio, fosforo (fosfatos) y magnesio, e incluso de azufre tratándose de la semilla de melón verde o liso. Las proteínas se han extraído de manera secuencial, usando agua, solución salina, alcohol (2-propanol) y álcali (buffer de boratos pH 9.5), lo cual nos ha permitido averiguar que se extrae más y mejor proteína con solución salina. Por otra parte, el aceite que se extrae es de color ámbar y de olor agradable. Se midió la actividad inhibitoria contra tripsina y resultó prácticamente nula, lo cual indica que esta proteína se puede consumir en crudo sin preocuparse por este aspecto. La medición de actividad inhibitoria se realizó mediante un método espectrofotométrico y usando un substrato sintético. El contenido mineral de la semilla es semejante al de otras (frijol, maíz, capulín) aunque destaca la presencia de molibdeno.
También se extrajo proteína a diferentes pH, lo cual nos permite conocer que no se disuelve bien en solución ácida, pero si se logra disolver en pH neutro o alcalino. Esto posibilitaría su uso en alimentos con esta característica. La semilla de melón contiene 35% de aceite, lo cual la hace susceptible de aprovecharse para la extracción de este, sea para uso humano o para biodiesel (Dubois et al., 2007). Esto podría ser especialmente indicado, el uso humano, en las zonas donde la ingesta calórica es deficiente; es decir, zonas marginadas y rurales (Leyva y Pérez, 2015). De colectarse y usarse la semilla de melón podría sin duda equipararse a la de calabaza en cuanto a volumen manejado. Existen en el mercado harinas para preparar agua de horchata, que al parecer contienen harina de arroz y gran cantidad de azúcar; resultaría más sana y nutritiva sin duda una harina a base de semilla de melón; se probó a combinarla con harina de amaranto a fin de mejorar su composición aminoacídica, logrando buena aceptación entre los probadores. Esta fue calificada como muy buena en cuanto a sabor, acidez y apariencia.
Conclusiones
El perfil electroforético de las fracciones proteicas de los materiales empleados así como el perfil electroforético de la proteína crioprecipitada de los materiales empleados presentaron el mismo tipo de proteínas. La crioprecipitación de las proteínas permitió obtener bandas bien definidas, lo que permite proponer la técnica como un método de fraccionamiento. El melón chino y verde tienen una cantidad muy similar de proteína; a pH 2, 3, 4 no se extrajo proteína. La proteína de semilla de melón podría integrarse a la dieta, ya sea como extracto proteico o consumiendo las semillas, ya que aparentemente, es de fácil digestión por no ser rica en inhibidores de proteasas. El contenido de aceite fue mayor en el melón chino que en el verde; esto hace factible su uso para fines alimenticios o incluso para la obtención de biodiesel. La semilla de melón es una fuente adecuada de minerales, en especial, potasio, fosforo (fosfatos) y magnesio.











 texto en
texto en