Introducción
Para obtener rendimientos óptimos en cualquier cultivo de interés agronómico, se requieren cantidades importantes de fertilizantes químicos; sin embargo, su uso impacta negativamente en la rentabilidad del mismo, además de incrementar el problema de la salinidad debido a las características fisicoquímicas del suelo. Una alternativa al uso de fertilizantes químicos son los microorganismos promotores de crecimiento vegetal (PGPR) denominados "bioestimulantes", "biofertilizantes" o "inoculantes" (Cárdenas et al, 2010).
Los microorganismos más utilizados con este fin son las bacterias pertenecientes a los géneros, Rhizobium, Azospirillum, Azotobacter, Gluconacetobacter y Pseudomonas, así como hongos micorrícicos del género Glomus que generalmente provienen de otras regiones lo cual limita su accionar afectando de este modo el proceso de producción (Hirsch et al, 2001; Sevilla et al., 2001). Así, los estudios sobre adaptación y eficiencia biofertilizante de nuevas cepas deberán conducirse en las regiones donde habrán de utilizarse. La inoculación con Azospirillum brasilense es altamente benéfica en gramíneas como maíz, caña de azúcar, pastos y sorgo, pues aporta de 30 a 50% de nitrógeno de dichos cultivos (Martínez et al, 2003; Vivienne et al, 2004). Además de fijar nitrógeno, esta bacteria es capaz de producir hormonas de crecimiento vegetal como ácido indol acético (AIA), generando un crecimiento importante del sistema radicular, incluyendo su mayor absorción y de los propios fertilizantes químicos aplicados (Aguilar et al, 2008).
Gluconacetobacter diazotrophicus, microorganismo cuyo descubrimiento abrió un nuevo capítulo en la fijación de nitrógeno en plantas no leguminosas, potencial que se amplió cuando Fuentes et al. (1999) demostraron que libera hasta 50% del nitrógeno fijado y produce diversas auxinas, principalmente AIA y citocininas (Lee et al., 2004; Madhaiyan et al, 2006). Pertenece a la familia Acetobacteraceae, la que a su vez se inserta en la subclase a-proteobacteria. No obstante, es evidente que aún queda mucho por investigar en el campo de la biofertilización, con respecto al efecto que puede producir la adecuada incorporación de G. diazotrophicus al sistema planta, dadas las bondades y potencialidades de este microorganismo. El objetivo de esta investigación es aislar y caracterizar microorganismos de los géneros Azospirillum y Gluconacetobacter como promotores de crecimiento vegetal, promisorios para la elaboración de biofertilizantes que permitan disminuir los esquemas tradicionales de fertilización química y que a su vez generen un impacto positivo sobre el suelo donde son aplicados.
Materiales y métodos
Obtención de aislamientos de Azospirillum y gluconacetobacter. Azospirillum se aisló en medio de cultivo PY, adicionado con 20 µg mL-1 de ácido nalidíxico y 10 µg mL-1 de tetraciclina (Caballero-Mellado et al. (1992). Para el caso de Gluconacetobacter se empleó el medio de cultivo LGI semisólido tomando cortes de raíces de 2 cm de longitud de Jatropha y de Caña de azúcar, se lavaron y esterilizaron en superficie con etanol al 70% por 5 min, enjuagadas en agua destilada estéril y transferidas a los medios de cultivo arriba mencionados, permaneciendo en incubación por espacio de 10 días a 30 °C (Reis et al, 1994).
Caracterización de las cepas aisladas. Se seleccionaron los medios de cultivo con crecimiento positivo y se siguió la metodología descrita por Dóbereiner et al. (1995) para la identificación de Azospirillum y por Collins y Lyne (1980) para Gluconacetobacter. En ambos casos se determinó también la capacidad para crecer en diferentes fuentes de carbono según la metodología propuesta por Barbosa (2006). Adicionalmente se desarrolló un protocolo de amplificación por Reacción en Cadena de la Polimerasa de los genes DNAr 16S usando los iniciadores F 5-AGAGTTTGATCCTGGCTCAG-3' y R 5-TACCTTGTTTTACGACTT-3' los cuales generan un amplificado descrito por Singh et al. (2013) de 1499 pb en Azospirillum sp. yAC 5'-CTGTTTCCCGCAAGGGAC-3' y D1 5'-GCGCCCCATT GCTGGGTT-3' que generan un amplificado descrito por Sievers et al. (1998) de 445 pb en Gluconacetobacter sp., adicionalmente se emplearon los iniciadores 1 440 5'-GTTGGCTTAGAAGCAGCC-3' y AD 5'-TGCGGCAAAAGCCGGAT-3' que generan un producto descrito por Kirchhof et al. (1998) de 411 pb del gen ADNr 23S de Gluconacetobacter diazotrophicus y AzD 5' GTGAGTAACACGTGGGAACCTG 3' y AzR 5' GCTTCCACTTAGACCTCATGCT 3' que generan un amplificado de 780 pb del gen DNAr 16S de Azospirillum brasilense.
La mezcla de reacción constó de 5 µL de DNA genómico, 2.5 µL de Buffer enzimático 10X, 3 µL de MgCl2 50mM, 1.25 µL de mezcla de dNTPs, 1.25 µL de cada iniciador, 0.2 µL de Taq Polimerasa y agua libre de DNAsas hasta un volumen de 25 µL. La reacción se llevó a cabo en un termociclador Mycicler de BioRad® y programado de la siguiente manera: Desnaturalización inicial 94 °C 5 min, seguida de 30 ciclos con un paso de desnaturalización a 95 °C por 1 min, alineamiento 71 °C, 66 °C, 61°C y 60 °C por 1 min para F-R, AC-D1, 1440-AD y AzD-AzR respectivamente, Extensión de 73 °C por 1 min para AC-D1, 1440-AD y AzD-AzR, de 2 minutos para F-R, con una Extensión final a 73 °C de 10 min para todos los casos. Todos los amplificados fueron corridos en geles de agarosa al 0.7% teñidos con bromuro de etidio y visualizados bajo un sistema UV de documentación de geles GelDocXR+ de BioRad®.
Cuantificación de AIA. Las cepas aisladas se desarrollaron en medio líquido Luria-Bertani (LB) adicionado con triptona de caseína como fuente de triptófano, con incubación a 30 °C y 150 rpm de agitación constante. Además de cuantificar el AIA producido por cada cepa, se determinaron factores que podrían afectar la producción de este metabolito secundario, las variables a evaluar son la concentración de triptona en LB (2, 4 y 8 g L-1), el pH (4, 5, 6 y 7) y la actividad de agua (0.01M, 0.1M y 1M de NaCl y 20% y 30% de sacarosa) ésta última cuantificada en medio mínimo con sacarosa como fuente de carbono y adicionado con 0.5 g/L de triptófano. Se colectaron alícuotas de 1 mL del cultivo a las 24, 48, 72 y 96 horas de incubación y se centrifugaron a 9000 rpm por 5 min, el sobrenadante se mezcló con 3 ml del reactivo de Salkowski preparado según Glickman y Dessaux (1994) y se midió en un espectrofotómetro UV-VIS Jenway® a 535 nm tomando como referencia una curva patrón de AIA comercial sigma-aldrich®.
Cuantificación de nitrógeno amoniacal. Para cuantificar el nitrógeno fijado se inocularon 50 µL de cada suspensión bacteriana en 5 mL de caldo extracto de suelo 10% y en 5ml de Medio Mínimo incubando a 30 °C durante 72 h a 120 rpm. Se tomaron 700 µL de cultivo y se agregaron 1.5 mL de KCl 2M, los tubos se agitaron durante 5 minutos y luego se dejaron en reposo durante 1 h adicional. Posteriormente se añadieron 150 µL de solución alcohólica de fenol 10%, 150 µL de nitroprusiato de sodio 0.5 % y 700 µL de solución oxidante. Se agitó para mezclar y luego de 1 h de reposo se observó una coloración azul, realizando la lectura en espectrofotómetro a 633 nm. Las concentraciones se calcularon en una recta patrón obtenida con diluciones sucesivas de una solución de 100 ppm de cloruro de amonio (García et al., 2010).
Efecto de la inoculación en maíz, caña de azúcar y pitahaya. Se determinó el efecto de la inoculación de las cepas aisladas en ensayos in vitro en semillas de maíz germinadas en placas de agar agua por 48 h inoculadas con 1X107 UFC de M1 y G1 crecidas según Dóbereiner et al. (1995))en medio líquido LB adicionado con 8 g L-1 de triptona, incubado durante 72 h a 30 °C y 150 rpm de agitación constante, una vez germinadas, las semillas fueron colocadas en solución nutritiva y se realizaron inoculaciones simples de cada modelo bacteriano y coinoculación, las semillas inoculadas se dejaron en incubación por espacio de 10 días y se valoró su efecto midiendo la masa radicular y el número de raíces. Adicionalmente se realizaron ensayos in situ en caña de azúcar variedad ATE MEX 9640 la cual se inoculó 10 días después de germinación con suspensiones bacterianas que contenían 1X1011 UFC/mL (Cuadro1), los tratamientos fueron distribuidos en bloques completamente al azar con 5 repeticiones, las variables a medir fueron grosor de tallo, altura, peso y número de brotes a los 12 meses después de siembra (Dibut et al, 2005). Finalmente se valoraron los mismos modelos microbianos en Pitahaya propagada ex vitro a través de esquejes los cuales fueron inoculados 20 días después de trasplante con 50 mL de una solución que contenía 1X108 UFC mL-1, empleando como referencia un control - no inoculado y un control + con enraizador Radix 1500®, en este caso se midió la masa radicular y el número de raíces a los 60 días pos inoculación.
Análisis estadístico. Todos los ensayos se realizaron por triplicado y los datos fueron sometidos a un análisis estadístico de varianza y de comparación de medias de Tukey a un nivel de significancia p≤ 0.05 utilizando el paquete SAS (Statistical Analysis System).
Cuadro 1 Tratamientos evaluados en caña de azúcar.

*G1= Gluconacetobacter sp., M1= Azospirillum sp., G1-M1= coinoculación Gluconacetobacter sp. y Azospirillum sp., FQ= fertilización química al 100% (220-80-80) con nitrato de potasio, fosfato diamónico y cloruro de potasio. El testigo y los tratamientos 1, 2 y 3 tuvieron fertilización química al 30%.
Resultados y discusión
Se obtuvieron cepas en cada uno de los medios de cultivo con morfología colonial y características fenotípicas sugerentes de los géneros Azospirillum la cual fue denominada M1 y Gluconacetobacter denominada G1 descritas por Hynes et al. (2008); Cavalcante et al. (1988), aisladas de muestras de raíz dejatropha y de caña de azúcar respectivamente (Cuadro 2). Adicionalmente se observa al microscopio que la cepa M1 posee movilidad en espiral y forma ovoide, en medio Nfb con rojo congo se observan colonias rojo escarlata con bordes redondeados y ligeramente mucoides de acuerdo a Pérez y Casas (2005), para la cepa G1 se observan colonias anaranjadas mucoides de forma irregular con producción de ácido en medio LGI y colonias café-marrón en agar papa dextrosa, con capacidad de tolerar concentraciones de sacarosa de hasta 30% y con producción de ácido acético (Fuentes et al, 2001).
Cuadro 2 Caracterización bioquímica y uso de fuentes de

*Cat= catalasa; Ox= oxidasa; Mov= movilidad; Sac= sacarosa; Glc= glucosa; Lac= lactosa; Cit= citrato; Man= manitol; Mal= maltosa; Et= etanol; Gli= glicerol; Ino= inocitol; Ac= acetato sódico, (+) crecimiento abundante, (-) sin crecimiento, (+/-) crecimiento ligero.
Los resultados de caracterización bioquímica y morfológica para las cepas M1 y G1 coinciden con las descripciones del manual de clasificación de bacterias de Bergey para los Azospirillum y Gluconacetobacter respectivamente (Holt et al., 1994).
El protocolo de PCR del gen DNAr 16S de las cepas M1 y G1 amplifican productos de 1.5 Kb y 450 pb respectivamente (Figura 1), en concordancia a lo reportado por Singh et al. (2013) y Sievers et al. (1998). La amplificación del gen DNAr 23S para la cepa G1 generó un producto estimado de 410 pb reportado para especies del género Gluconacetobacter (Kirchhof et al., 1998).
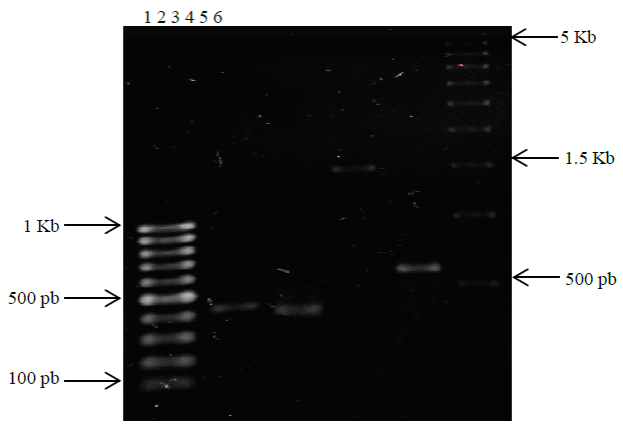
Figura 1 Productos de amplificación por PCR de los genes DNAr 16S de G1 y M1 y DNAr23S de G1. Carril 1 MPM 100 pb, carril 2 DNAr 16S de G1, carril 3 DNAr 23S de G1, carril 4 DNAr 16S M1 iniciadores F-R, carriles 5 DNAr 16S M1 iniciadores AzD-AzR, carril 6 MPM 500 pb.
Cuantificación de AIA. En la cuantificación de este regulador de crecimiento se encontró que la producción máxima de AIA ocurre a concentraciones de 0.01 M de NaCl tanto para M1 como para G1 a las 96 horas de incubación (Figura 2) con valores de 19.19 y 27.28 mg L-1 respectivamente, del mismo modo se observa que la concentración de AIA disminuye de manera considerable para ambas cepas conforme el estrés es más severo (Spaepen et al., 2007). Finalmente se encontró que G1 continua presentando buen crecimiento y produciendo este compuesto, a concentraciones menores, aun a 20 y 30% de Sacarosa (6.24 y 7.46 mg L-1 de AIA respectivamente) lo cual nos habla de su capacidad para tolerar altas concentraciones del carbohidrato contrario a M1 cuya producción se reduce hasta 0.8 y 1.1 mg L-1 a las mismas concentraciones de sacarosa, probablemente debido a una disminución en su crecimiento bajo éstas condiciones.

Figura 2 Producción de ácido indol acético con estrés osmótico inducido por diferentes concentraciones de NaCl y sacarosa en medio mínimo a) cepa G1; y b) cepa M1.
Se encontró que el pH óptimo para la producción de AIA es de 7 tanto para M1 como para G1 (Cuadro 3) y que ambas cepas ven afectada la producción de este metabolito a valores de pH inferiores, semejante a lo reportado por Sahasrabudhe (2011), cabe resaltar que G1 presenta mayor tolerancia y por ende mayor producción de AIA que M1 a valores inferiores de pH. También se observa que la concentración de triptona influye de manera directa en la producción de este compuesto, de forma que concentraciones elevadas de esta proteína incrementan de manera considerable la cantidad de triptófano y la producción de AIA en ambas cepas, lo cual indica la posibilidad de que la síntesis de este metabolito secundario siga rutas dependientes de triptófano (Aguilar et al, 2008). Según se observa en el Cuadro 2, G1 es capaz de producir una cantidad significativamente mayor del regulador de crecimiento en comparación con M1 y la co-inoculación no presenta incremento estadísticamente significativo en cada valor de pH cuando se compara con G1, estos resultados coinciden con lo reportado por Lara et al. (2012) y Cheang et al. (2005) en relación a la cantidad de AIA producido por cepas de Azospirillum y Gluconacetobacter.
Cuadro 3 Producción de AIA a diferentes valores de pH y concentraciones de triptona.

*Concentración de AIA en mg/L, valores con la misma letra son estadísticamente iguales para p≤ 0.05.
Cuantificación de nitrógeno amoniacal. En la determinación de amonio se observa que tanto M1 como G1 son capaces de fijar nitrógeno (Cuadro 4), se muestra que en caldo extracto de suelo la cepa M1 produce cantidades significativamente mayores (14.74 umol L-1) a las producidas por G1 (5.17 umol L-1) y las generadas por la co-inoculación de ambas cepas (11.21umol L-1), también se observan concentraciones mayores de amonio para ambas cepas en caldo extracto de suelo en comparación con medio mínimo. Las concentraciones de amonio encontradas en este ensayo concuerdan con las reportadas previamente para cepas de Azospirillum sp. (García et al., 2010).
Cuadro 4 Cuantificación de nitrógeno amoniacal en diferentes medios de cultivo.

*Valores con la misma letra son estadísticamente iguales para p≤ 0.05.
Asimismo, en caña de azúcar para las variables altura, número de brotes y peso se observa que la inoculación de G1 presenta valores estadísticamente iguales al control + en concordancia con lo reportado por Sevilla et al. (1998) quienes observaron un incremento considerable en la biomasa de plantas de caña de azúcar inoculadas con promotores de crecimiento vegetal en comparación con plantas no inoculadas, del mismo modo se encontró en esta investigación que el efecto de su inoculación es mayor en comparación con los controles negativos empleados para cada modelo vegetal (Muñoz y Caballero, 2003). También puede observarse que la coinoculación no posee mayores efectos que la inoculación simple de M1 y G1 en las variables medidas para cada modelo vegetal (Cuadro 5). La producción de ácido indol acético, y la alta sensibilidad de las raíces a dicha hormona son fundamentales, en la respuesta a la inoculación de Azospirillum donde se observa frecuentemente un mayor desarrollo radical, que se traduce en mayor superficie de absorción de nutrientes, y así, un mayor desarrollo de la parte aérea de la planta (Cholula, 2005).
Cuadro 5 Efecto de la inoculación de M1 y G1 sobre pitahaya y caña de azúcar.

Valores con la misma letra son estadísticamente iguales para p< 0.05. *masa radicular medida en gramos, **Altura medida en centímetros, ***peso medido en kilogramos.
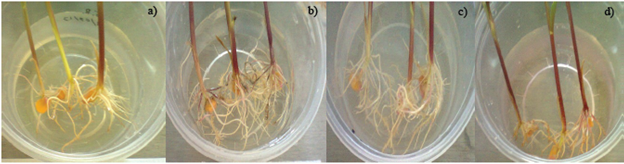
La inoculación sobre semillas de maíz muestra que M1 posee efectos mayores en comparación con G1 en volumen radicular (Figura 3), se puede apreciar que la coinoculación de ambos modelos bacterianos resulta en un efecto semejante al mostrado por M1 y que los tratamientos inoculados poseen mayor volumen radicular que el testigo no inoculado (Ilyas et al., 2012). Estos resultados ponen de manifiesto la potencialidad de los modelos microbianos aislados como promotores de crecimiento vegetal.
Conclusiones
De acuerdo a los resultados observados en cada uno de los ensayos se demuestra que las cepas aisladas son promotoras de crecimiento vegetal caracterizadas de forma parcial como Azospirillum sp. (G1) y Gluconacetobacter sp. (M1). Ambos modelos microbianos son capaces de sintetizar AIA con una producción mayor por parte de G1, por otro lado, M1 demuestra mayor capacidad de producción de nitrógeno amoniacal. Se encontró que tanto la concentración de Triptona, como el pH y el estrés osmótico son factores que inciden de manera directa en la producción de AIA. Finalmente se puede afirmar que no existe un efecto mayor en planta generado por la co-inoculación de ambas cepas en comparación con los esquemas de inoculación simple en los tres modelos vegetales empleados y finalmente que tanto G1 como M1 inoculadas a razón de 200 mL/36 m2 con concentración de 1X1011 UFC mL-1 logran disminuciones de hasta del 70% en los esquemas de fertilización química en Caña de azúcar obteniendo variables de rendimiento semejantes al control +, por lo que estos modelos microbianos pueden ser considerados promisorios en la elaboración de biofertilizantes en esta región.











 texto em
texto em