Introducción
La interacción entre los componentes de una comunidad microbiana en los sistemas agrícolas puede manifestarse o no en algún atributo morfológico o fisiológico de interés antropocéntrico de la planta huésped. En algunos cultivos anuales y perennes se ha encontrado incremento en los diferentes componentes del rendimiento al inocular juntos hongos y bacterias (Aguirre-Medina et al., 2012). Estos beneficios se han intentado en otros cultivos con el fin de identificar los sinergismos entre algunas asociaciones de microorganismos del suelo y el cultivo de interés. Algunos de los beneficios sobre el crecimiento de las plantas se expresan con la combinación de las bacterias asociativas y los hongos micorrízicos.
La interacción entre rizobacterias promotoras del crecimiento vegetal y hongos endomicorrízicos, puede ser selectiva y dependiente de la bacteria y el hongo implicado (Azcón, 2000). Interacción positiva en el crecimiento y rendimiento de algunos cultivos se ha encontrado con la inoculación de Rhizophagus intraradices, Azospirillum brasilense y/o Rhizobium etli (Aguirre Medina, 2006), además de incrementos en el contenido de nitrógeno (N) y fósforo (P) en el tejido vegetal y el grano (Aguirre-Medina et al, 2012). Las pseudomonas son un grupo importante de microorganismos que pueden promover el crecimiento de plantas y protegerlas de patógenos (Unno et al, 2005).
Para la producción de chile es de gran importancia la evaluación en conjunto, de la utilización de los biofertilizantes a base de hongos-rizobacterias que han sido evaluadas en otros cultivos y han demostrado acción eficaz sobre las plantas. Tomando en cuenta estos antecedentes, el presente trabajo tuvo como objetivo estudiar la efectividad agrobiológica de la coinoculación micorriza-rizobacterias sobre el crecimiento y rendimiento del chile.
Materiales y métodos
Sitio experimental, suelo y material biológico
La investigación se desarrolló en el vivero del Campo Experimental Rosario Izapa, del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP), ubicado en el km 18 de la Carretera Tapachula-Cacaohatán
municipio de Tuxtla Chico, Chiapas, geográficamente en 14° 40' latitud norte y 92° 10' longitud oeste a 435 msnm, de septiembre de 2013 a mayo de 2014.
En el sitio la precipitación media anual es de 4700 mm, la temperatura media máxima de 25.4 °C, la mínima de 17 °C con una humedad relativa del 85 %. El suelo utilizado se obtuvo de 0-3 0 cm de profundidad en los terrenos de Rosario Izapa Chiapas, caracterizados como andosoles (Grajales, De la Piedra y López, 2008).
El sustrato se formó con la mezcla de suelo y arena de rio lavada y tamizada, en proporción 1:1 (V/V) se agregó 30% de gallinaza (v/v). El sustrato presentó las siguientes características físico-químicas; textura arena-migajosa, (Bouyucos), (78.66 % de arena, 18.36% de limo, 2.98% de arcilla), porosidad (36.12%), densidad real (1.91 g m-r), densidad aparente (1.22 g ml-1), materia orgánica (7.3%), pH de 6.64, N (0.32%), P (136 ppm), K (825 ppm) y con el mismo se llenaron bolsas de plástico con capacidad de ocho kg que se colocaron sobre bancales o camas de fierro.
Tratamientos y su aplicación. Se sembraron las semillas de Capsicum annuum L tipo jalapeño regional en charolas con el sustrato y antes de la siembra fueron adheridos a la semilla los microorganismos Azospirillum brasilense, Rhizophagus intraradices y Pseudomonas fluorescens con carboximetilcelulosa, individualmente o juntos. En los tratamientos con más de un microorganismo, primero fue adherida la bacteria y después el hongo endomicorrízico. El trasplante se realizó 30 días después a bolsas de polietileno con un par de hojas verdaderas. La bacteria A. brasilense fue adquirida en la Universidad Autónoma de Puebla (UAP) con una concentración de 109 bacterias por (g) de turba, P. fluorescens fue proporcionada por el INIFAP-Campo Experimental Celaya, con 9 x106 UFC por gramo de turba y R. intraradices se desarrolló en el INIFAP-Campo Experimental Rosario Izapa, Chiapas, con al menos 40 esporas por g de suelo y 95% de colonización radical en la planta huésped de Brachiaria decumbens L. Los datos de las concentraciones de microorganismos se indican en cada producto.
La cantidad de hongo utilizada se calculó con base 6% del peso de la semilla y de las bacterias A. brasilense y P. fluorescens se calculó con base 4% del peso de la semilla. Los tratamientos fueron el testigo, R. intraradices, A. brasilense, P.fluorescens, R. intraradices + A. brasilense, A. brasilense + P. fluorescens y R. intraradices + A. brasilense + P. fluorescens con cinco repeticiones distribuidas en un diseño completamente al azar. Se consideró una planta como repetición. Las plantas se regaron con aproximadamente 100 ml de agua cada tercer día.
Variables. Las variables morfológicas (altura de planta, diámetro del tallo, número de hojas y frutos) y fisiológicas (biomasa seca de la raíz, tallo y hoja) se registraron cada 28 días hasta el día 84. Así mismo la colonización radical cada 28 días y el número y peso fresco de fruto a la cosecha. La altura de planta se registró con cinta métrica en cm a partir de la corona radical hasta la yema apical. El diámetro del tallo en mm con vernier digital (AutoTECTM, China) a cinco cm de distancia de la corona radical hacia el ápice de la planta después de la deshidratación, además del número total de hojas en cada plantas y el número y peso de frutos al momento de la cosecha determinando su peso individual en báscula semianalítica (Ohaus, Adventurer Pro, USA).
La biomasa como peso seco de parte aérea y radical, fue obtenida mediante una báscula semianalítica (Ohaus Adventurer Pro, USA) después de secarse en estufa de aire forzado a 75-80 °C hasta peso constante. La colonización micorrízica expresada como porcentaje, se determinó según Phillips y Hayman (1970). El análisis estadístico fue realizado mediante el paquete Statistical Analysis System, versión 8.1 (SAS, 1999-2000) y las comparación entre medias de tratamientos por Tukey con un α=0.05.
Resultados y discusión
El Cuadro 1 muestra el crecimiento de las plantas de C. annuum L. con los tratamientos aplicados. La altura de la planta fue estadísticamente diferente (p≤ 0.05) durante los tres muestreos. En los dos primeros muestreos se incrementó la altura de las plantas al inocular las semillas con un microorganismo en comparación con la inoculación de dos o los tres microorganismos. La altura máxima alcanzada fue de 63 cm y se registró en las plantas inoculadas con A. brasilense. Con Azospirillum se favorece el crecimiento vegetal por el incremento en el desarrollo radical de la planta huésped mediante la producción de hormonas y la fijación de nitrógeno (Bashan y de-Bashan 2010).
Cuadro 1 Comparaciones de medias de altura de planta, número de hojas y diámetro del tallo de Capsicum annuum L. biofertilizada con diferentes microorganismos en suelo andosol-mólico del Soconusco, Chiapas.

CV= coeficiente de variación (%). *Valores con diferente letra dentro de cada factor y columna son estadísticamente diferentes (p ≤0.05).
Las plantas inoculadas con los tres microorganismos presentaron aproximadamente la mitad de la altura en comparación con A. brasilense. En tomate Alonso y Galán (2006) citan incremento de la altura de las plantas con A. brasilense.Karthikeyan et al. (2009) consignan aumento en la altura de planta al inocular las semillas de Catharanthus roseus (L.) G. Don. con dos bacterias, A. brasilense y P. fluorescens y Neetu et al. (2012) citan mayor altura de planta al inocular Linum usitatissimum L. con P. fluorescens + G. mosseae. Por su parte Reyes-Ramírez et al. (2014) informaron de incremento en altura en plantas de chile habanero (Capsicum chinense Jacq.) después de 90 días de ser inoculadas con Pseudomonas spp. en comparación con las plantas inoculadas con A. brasilense y el testigo.
En algunos cultivos la respuesta a la inoculación es más alta con un solo microorganismo y puede estar relacionada con el incremento de la demanda de carbono por la colonización de más simbiontes (Sylvia, 2005). En cultivos anuales como maíz y frijol, se ha encontrado respuesta diferencial con la inoculación simple y la coinoculación de más de un microorganismo (Aguirre-Medina., 2006), la respuesta anterior parece estar influenciada por la capacidad de colonización de los microrganismos, por la interacción con la planta y con los microorganismos naturalizados presentes en el suelo.
El diámetro del tallo también presentó diferencia estadística significativa (p≤ 0.05) entre los tratamientos evaluados durante los dos primeros muestreos. A los 28 días después del trasplante (ddt), el mayor grosor del tallo se encontró con la inoculación de A. brasilense y P. fluorescens. A los 56 ddt, el diámetro del tallo fue muy semejante entre los tratamientos, pero las diferencias estadísticas favorecieron al tratamiento inoculado con P. fluorescens. Resultados contrarios presentan Reyes-Ramírez et al. (2014) en chile habanero (Capsicum chinense Jacq.) quienes no encontraron diferencias entre los tratamientos para diámetro del tallo en las primeras fechas de muestreo, sino a partir de los 90 ddt y fue mayor con la inoculación de Pseudomonas spp. en comparación al testigo y las plantas inoculadas con A. brasilense.
En otros cultivos perennes se ha consignado este mismo efecto pero con G. intraradices (Chattopadhyay et al., 2006; Aguirre-Medina et al, 2007 y 2011), y con Gigaspora margarita en plantas de C. canephora (Tristáo et al, 2006). El número de las hojas presenta respuesta contrastante entre tratamientos a los 28 ddt y con A. brasilense inoculada individualmente fue estadísticamente diferentes (p≤ 0.05) al resto de los tratamientos. En los siguientes muestreos, el número de hojas fue similar entre los tratamientos, incluyendo al testigo, y la menor cantidad de hojas se presentó con la inoculación de los tres microorganismos. Al respecto existen evidencias que la combinación de más de un microorganismos no necesariamente induce un efecto aditivo o sinérgico en la planta huésped (Trabelsi y Mhamdi, 2013), como sucedió en nuestra investigación.
En los muestreos dos y tres se incrementó el número de hojas de las plantas inoculadas con un microorganismo y fue muy semejante entre las coinoculaciones de dos microorganismos. Es probable que a este tiempo se haya mejorado la relación planta-microorganismo. Entre las plantas y las bacterias existe también un lenguaje dinámico y complejo para su colonización, como su capacidad de utilizar los exudados radicales como fuentes de carbono y su habilidad para interactuar y colaborar con otros microorganismos en la rizosfera (Holguín, 2008). En cultivos perennes en invernadero, la respuesta vegetal de los mismos microorganismos se expresa alrededor de 90 días después de la inoculación, como en Tabebuia donnell-smithii Rose (Aguirre-Medina et al., 2014), en Cedrela odorata L. (Aguirre-Medina et al, 2014) y en café robusta Coffea canephora (Pierre) ex Froehner (Ibarra-Puón et al., 2014).
En el caso del tratamiento testigo, la respuesta se debe a la presencia de otros microorganismos naturalizados asociados en su sistema radical que favorecieron su desarrollo. En ésta investigación, solamente se realizó el conteo de la colonización radical por el hongo endomicorrízico y en el caso del testigo, la colonización radical inicial fue de 72% y al final 27%. Valores muy semejantes a los encontrados en los tratamientos donde se aplicó R. intraradices. Estos antecedentes sugieren la contrastante funcionalidad de las coinoculaciones en interacción con las plantas (Jáderlund et al, 2008).
Peso seco de lámina foliar, tallo y raíz. La mayor acumulación de biomasa seca de la lámina foliar en las plantas inoculadas se presentó con A. brasilense, P. fluorescensy la combinación R. intraradices + A. brasilense a los 28 ddt, R. intraradices y A. brasilense inoculadas por separado a los 56 ddt, y al final de la evaluación a los 84 ddt, todos los tratamientos superaron al tratamiento inoculado con los tres microorganismos (Cuadro 2). Reyes-Ramírez et al. (2014) no encontraron diferencia en la biomasa de la lámina foliar del chile habanero (Capsicum chinense Jacq.) al inocularse con Pseudomonas spp, R. irregularis o A. brasilense. En cultivos perennes como Leucaena leucocephala (Lam.) De Wit y Theobroma cacao L. coinoculado con los microorganismos Glomus-Rhizobium y Azospirillum respectivamente, se presentan incrementos en estos mismos componentes del rendimiento (Aguirre-Medina et al., 2007).
Cuadro 2 Peso seco de lámina foliar, tallo y raíz en plantas de Capsicum annnum L. biofertilizadas con diferentes microorganismos en un suelo andosol-mólico del Soconusco, Chiapas.
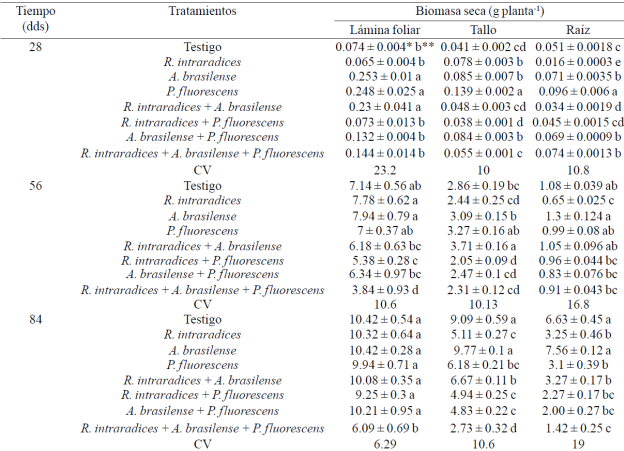
CV= coeficiente de variación (%). * ± error estándar. *Valores con diferente letra dentro de cada factor y columna son estadísticamente diferentes (p≤ 0.05).
El crecimiento inicial lento en los tratamientos inoculados con dos microorganismos, es probable que se relacione a la mayor demanda de fotosintatos requerida por los mismos durante la fase de establecimiento de la simbiosis y en consecuencia, disminuye su crecimiento inicial. En Tabebuia donnell-smithii Rose al evaluar diversas colectas de hongos endomicorrízicos de diferentes regiones del sur sureste de México, se encontró que la inducción en el crecimiento de los componentes del rendimiento se expresó en tiempos diferentes (Aguirre-Medina et al., 2014).
El peso seco del tallo principal presentó mayor biomasa en los tratamientos inoculados con P. fluorescens a los 28 y 84 ddt y la simbiosis R. intraradices + A. brasilense a los 56 ddt en comparación con la inoculación de los tres microorganismos y fueron estadísticamente superiores (p≤ 0.05) al resto de los tratamientos. Con Pseudomonas spp. se incrementó la biomasa del tallo en chile habanero (C. chinense Jacq.) pero no con la combinación del hongo endomicorrízico (Reyes-Ramírez et al., 2014). En Coffea canephora (Pierre) ex Froehner, la biomasa del tallo también se incrementa con la inoculación por separado de los mismos microorganismos (Aguirre-Medina et al., 2011).
La mayor biomasa acumulada en el sistema radical se registró con P. fluorescens y fue estadísticamente diferente (p≤ 0.005) a los otros tratamientos y coincide con lo reportado por Reyes-Ramírez et al. (2014) en C. chinense Jacq. Durante los siguientes muestreos, esta respuesta también se presentó con A. brasilense. El mayor crecimiento en el sistema radical puede estar relacionado con el incremento de algunas sustancias del crecimiento, producto de la simbiosis entre la planta y los microorganismos. A. brasilense y P. fluorescens promueven el desarrollo de la raíz mediante la producción de ácido indol acético (Patten y Glick, 2002; Hungria et al., 2004; Ahmad et al, 2006; Neetu et al, 2012) que modifica la morfología de la raíz e incrementan su biomasa.
De igual forma, A. brasilense puede inducir mayor desarrollo radical en diferentes plantas anuales cuando se inoculan juntos Azospirillum+Glomus en Phaseolus vulgaris L. y Zea mays L. (Dobbelaere et al., 2003). P. fluorescens puede estimular la proliferación de raíces y ha sido relacionada con la promoción del crecimiento vegetal (Gamalero et al., 2004) y la posible supresión de microorganismos patógenos en el suelo (Neetu et al., 2012). Los resultados anteriores indican que la acumulación de materia seca en los componentes de la planta de Capsicum annuum L., varía según el microorganismo aplicado a través del tiempo. Al inicio de la evaluación, los tratamientos inoculados con A. brasilense, P. fluorescens y la simbiosis doble R. intraradices+A. brasilense, acumularon la mayor cantidad de materia seca en sus diferentes componentes del rendimiento, y a este tiempo se alcanzó la mayor colonización micorrízica en el tratamiento combinado, que fue superior a 90%.
Con el registro individual del peso de los frutos se clasificaron en tres categorías. Del promedio total de frutos por planta, los que pesaron arriba de diez g representaron 13.7% del total de la producción. El 41% de los frutos pesaron entre cinco y diez g y menor a cinco g, 45.5% de los mismos (Figura 1).
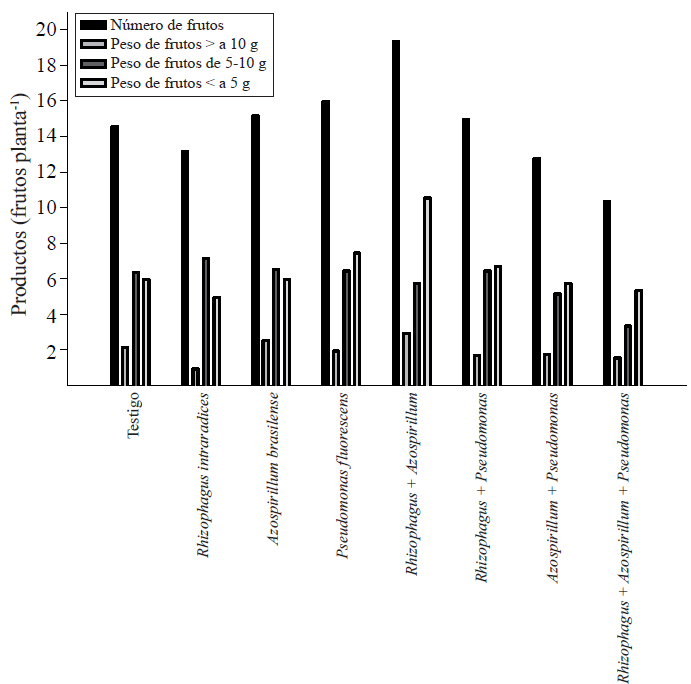
Figura 1 Número y peso fresco de frutos de Capsicum annuum L. biofertilizado con diferentes microorganismos solos o combinados en un sueloAndosol mólico de Chiapas. Los valores son promedios de cinco repeticiones.
Los frutos con peso superior a 10 g fueron dos en promedio casi en todos los tratamientos, con excepción del tratamiento con la simbiosis R. intraradices, P. fluorescens, y con los tres microorganismos.
En el rango de peso de cinco a diez g, la proporción entre los tratamientos fue muy semejante, es decir, se produjeron entre seis y siete frutos. La mayor variación se presentó en los frutos que pesaron menos de cinco g. Al respecto, con la simbiosis doble R. intraradices + A. brasilense se encontró el mayor número de frutos de tamaño menor a cinco g, y representó aproximadamente 50% de este excedente. Este hecho sugiere la importancia de la inoculación de un microorganismo a las plantas de chile para favorecer la fructificación. Si se introducen más de un microorganismo, es probable que la demanda de fotosintatos por los mismos, reduzca la posibilidad de que sean transportados a la floración y el amarre de frutos. Se ha demostrado que P. fluorescens en la rizosfera aumenta la biomasa y la productividad en los cultivos (Sood, 2003), como en el caso de chile habanero (Reyes-Ramírez et al, 2014).
Colonización radical. La colonización radical de las plantas a los 28 ddt, fue alta en todos los tratamientos donde se aplicaron los microorganismos (Figura 2). En promedio, el rango de colonización fue del orden de 60% a 96%. En el caso del testigo sin aplicación de microorganismos la colonización radical inicial fue alta, 72%, seguramente por hongos endomicorrízicos presentes en el sustrato y la misma es común en especies que se han adaptado a las condiciones ambientales de la región.
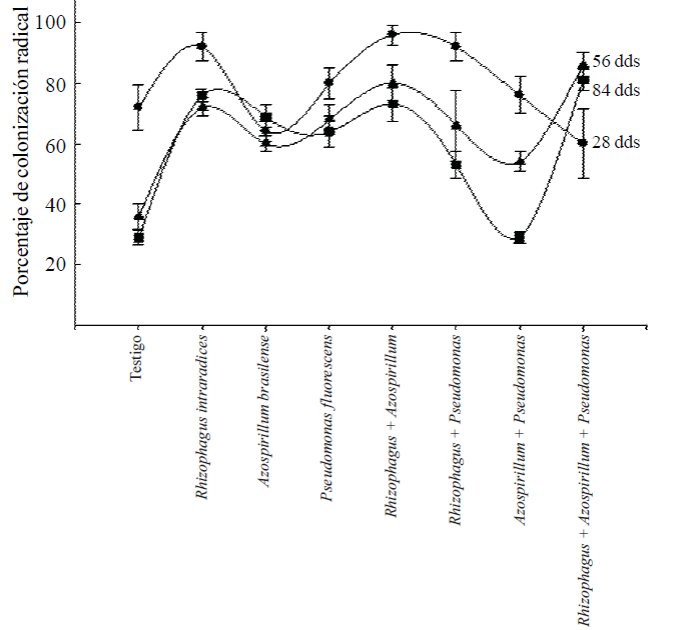
Figura 2 Colonización radical de Capsicum annuum L. biofertilizado con diferentes microorganismos solos o combinados en un suelo Andosol mólico de Chiapas. Los valores son promedios de cinco repeticiones ± el error estándar en cada muestreo.
Se esperaba que la inoculación de las bacterias Azospirillum y Pseudomonas favorecerían el incremento de la colonización radical, como ha sucedido en otras plantas (Aguirre-Medina, 2006); sin embargo, en el segundo y tercer muestreo, los valores de colonización radical, cuando se aplicaron los microorganismos solos, fue de 60 a 68% y se incrementó de 80 a 86% cuando se incluyó R. intraradices.
El menor porcentaje de colonización micorrízica en los tratamientos inoculados con las bacterias se debe a la colonización de los hongos endomicorrízicos presentes en el sustrato. Cuando se aplicaron juntos R. intraradices + P. fluorescens, también el porcentaje de colonización fue bajo, del orden de 66% y con las dos bacterias juntas, lo fue de 29%. Esto indica que no todos los microorganismos tienen la facultad de asociarse para inducir mayores beneficios a la planta huésped.
En la evaluación final, los porcentajes de colonización radical por hongos micorrízicos fue 76% con R. intraradices, 69% con A. brasilense, 64% con P. fluorescens y 73% con la simbiosis doble R. intraradices + A. brasilense y fue en estos tratamientos donde se encontraron los efectos mayores en el incremento de biomasa de la planta, el mayor grosor del diámetro del tallo, el número de hojas, de flores y de frutos. En los otros tratamientos con la coinoculación de dos microorganismos, la colonización radical fue menor de 53 y 29% para R. intraradices + P. fluorescens y A. brasilense + P. fluorescens y en ninguna de las variables evaluadas presentaron valores importantes o superiores a los otros, tampoco diferencias estadísticas significativas.
Los efectos de los microorganismos en el desarrollo vegetal de las plantas se han documentado (Barea et al., 2002) y en otros casos, la aplicación de hongos micorrízicos seleccionados han favorecido el rendimiento de diversos cultivos, cuando se aplican solos, o en combinación con alguna bacteria, como P. fluorescens, que en tomate estimula la colonización micorrízica e incrementa la producción (Gamalero et al., 2004).
Conclusiones
Los componentes morfológicos y fisiológicos de la planta de chile presentan variaciones iniciales y finales contrastantes en interacción con los diversos microorganismos. La inoculación individual de los microorganismos Pseudomonas fluorescens, Azospirillum brasilense y la coinoculación de R. intraradices +A. brasilense incrementaron el número de frutos. La coinoculación de R. intraradices + P. fluorescens y la inoculación individual de A. brasilense indujeron frutos más grandes











 texto em
texto em 


