Introducción
El mango (Mangifera indica L.) ha sido cultivado y naturalizado tan extensamente que su distribución se puede considerar como pantropical -aun cuando su punto de origen exacto es desconocido- (de los Santos-Villalobos et al., 2011). Además, este fruto es considerado como uno de los más populares en áreas tropicales y países en desarrollo (FAO, 2013).
La producción mundial de mango es aproximadamente de 31 × 106 t año-1. India contribuye con 43% de esta producción (principal país productor), y México ocupa el quinto lugar en este sector con una producción de más de 4%. El panorama para nuestro país cambia al considerar las exportaciones de mango fresco en el mercado internacional, debido a que México es el segundo exportador a nivel mundial con una participación 21%, lo que representa alrededor de 2 × 105 t año-1 (FAO, 2013), traduciéndose aproximadamente en USD $86 millones.
La producción de mango nacional y mundial presenta una cadena de valor similar, donde se han identificado etapas que la desestabilizan (puntos críticos), debido a la escasez de conocimiento científico y/o tecnologías sostenibles en torno a ellas, éstas son: el evento de floración, la generación/aprovechamiento de residuos agro industriales y el control de la antracnosis, siendo este último el principal problema en pre y poscosecha (de los Santos-Villalobos et al., 2011).
La antracnosis, causada por el hongo Colletotrichum gloeosporioides, es la enfermedad de mayor impacto en la productividad y calidad del mango, la cual se encuentra distribuida en todas las zonas productoras del mundo (Litz, 2000). La clasificación taxonómica del agente causal es clase: Sordariomycetes, subclase: Hypocreomycetidae, orden: Hypocreomycetidae incertaesedis, familia: Glomerellaceae, género: Glomerella, especie: cingulata, siendo C. gloeosporioides su estado anamorfo (NCBI, 2014).
Este patógeno ubicuo produce hifas hialinas unicelulares, ovoides y alargadas, con conidios ligeramente curvados (10 - 15 µm de longitud y 5 - 7 µm de ancho). Los acérvulos que se producen en el tejido infectado pueden ubicarse en forma subepidermal, epidermal o subcuticular con conidióforos cortos y erguidos (Bruce da Silva y Michereff, 2013). Esta enfermedad se presenta a nivel mundial y en todas las etapas fenológicas del cultivo, causando pérdidas considerables en producción ya que provoca la caída de más de 90% de los frutos cuando la enfermedad se presenta en intensidades superiores a 80%; incluso cuando los niveles de daño alcanzó 40%, la caída de frutos es superior a 50% (Espinosa et al., 2004). Por esta razón, el manejo de la antracnosis en mango requiere de un control constante debido a que condiciones climáticas (temperatura y humedad) promueven la infección y desarrollo de la enfermedad, impactando negativamente la productividad de este cultivo.
Por décadas, la práctica agrícola mayormente utilizada para el control de esta enfermedad ha sido la aplicación de fungicidas sintéticos, los cuales incluyen benzimidazoles, ditiocarbamatos, cloroalquitios e inhibidores de la síntesis de ergosterol: difenoconazol, miclobutanil, y procloraz (Peres et al., 2004; Arias y Carrizales, 2007). Sin embargo, el uso de estos fungicidas no es una práctica económica y ambientalmente sustentable, ya que el uso excesivo de éstos ha conducido a fuertes problemas de contaminación ambiental, generando residuos tóxicos en los frutos y resistencia de los patógenos (Wu et al., 2009). Así, por años, la presión social para reducir el uso de estos fungicidas sintéticos en la producción de mango y su presencia en el ambiente ha incrementado significativamente, conduciendo a la necesidad del desarrollo de alternativas sostenibles contra la antracnosis que permitan disminuir el uso y los problemas causados por estos fungicidas sintéticos.
En los últimos años, la aplicación de agentes de control de origen microbiano ha incrementado significativamente como una alternativa para el combate de enfermedades en cultivos agrícolas, a través de diversos mecanismos, tales como: antagonismos (parasitismo y antibiosis), y competencia por espacio y nutrientes, i.e. el control exitoso de C. gloeosporioides en mango se ha logrado a través del uso Burkholderia cepacia XXVI (producción de sideróforo), Trichoderma viride Tv1 (mecanismo de acción desconocido), Bacillus subtilis Pla10 (producción de antibióticos), entre otros (Ragazzo-Sánchez et al., 2011; de los Santos-Villalobos et al., 2012; Lakshmi et al., 2013). Sin embargo, el nivel de éxito de esta alternativa en campo es variable debido a su naturaleza biológica, donde su eficiencia se ve alterada por los estímulos ambientales (bióticos y abióticos) al cual son expuestos. El objetivo del presente trabajo fue el desarrollo y evaluación in vitro de una alternativa eficiente y amigable con el ambiente para el control del agente causal de la antracnosis del mango, C. gloeosporioides. Esta alternativa se basa en el uso combinado y sinérgico de un agente de control de origen microbiano (T. asperellum T8a) y un fungicida sintético (Captan 50®), con la finalidad de minimizar las pérdidas en la producción de mango ocasionadas por esta enfermedad, así como los problemas ambientales del uso de fungicidas sintéticos utilizados convencionalmente.
Materiales y métodos
Hongo fitopatógeno y agentes de control de origen microbiano y sintético utilizados. El hongo fitopatógeno utilizado como agente causal de la antracnosis del mango fue la cepa ATCC MYA 456 de Colletotrichum gloeosporioides, obtenida de la American Type Culture Collection (ATCC). La cepa Trichoderma asperellum T8a (aislada de la rizósfera del árbol de mango) fue utilizada como agente de control biológico contra C. gloeosporioides ATCC MYA 456. La cepa T8a fue proporcionada por Colección de microrganismos edáficos y endófitos nativos (Colmena) del Laboratorio de Biotecnología del Recurso Microbiano, con sede en el Instituto Tecnológico de Sonora. Además, Captan 50® fue utilizado como fungicida sintético de uso convencional contra el hongo fitopatógeno en estudio.
Caracterización macroscópica, microscópica y molecular de los microorganismos en estudio. Los microorganismos utilizados fueron identificados a través de sus características macroscópicas y microscópicas, tales como: presencia de hifas hialinas; coloración del micelio y forma de las conidias (Gunnel y Gubler, 1992; de los santos-Villalobos et al., 2013). Además, estos microorganismos fueron identificados molecularmente mediante la amplificación del gen 5.8S RNAr en su DNA genómico, por la técnica de Reacción en Cadena de la Polimerasa (PCR) (White et al., 1990). Previamente, los microorganismos en estudio fueron crecidos en Caldo de Papa Dextrosa (PDB) para la obtención de micelio (incubación por 3 días a 28 ºC), el cual se usó para la extracción del DNA genómico (Rader y Broda, 1985). Los amplicones obtenidos (~ 300 pb) fueron purificados utilizando el kit GFX PCR DNA and Gel Band Purification (Illustra) y secuenciados en ambos sentidos por la plataforma Sanger. Los electroferogramas obtenidos fueron analizados utilizando el programa Sequence Scanner v1.0 (Applied Biosystems). Las secuencias obtenidas fueron comparadas con aquellas depositadas en el banco de genes del NCBI.
Ensayos de patogenicidad de C. gloeosporioides ATCC MYA 456 in vivo. Los ensayos de patogenicidad de C. gloeosporioides ATCC MYA 456 fueron realizados en mangos verdes (cinco frutos por tratamiento), mediante la inoculación de 1 x 106 esporas en cinco puntos distantes de cada fruto. Posteriormente, éstos fueron incubados en una cámara húmeda a 28 ± 1 °C, humedad relativa de 85 ± 5%, fotoperiodo de 12 h (540 Lux) - 12h (20 Lux) durante 15 días. El número de frutos que mostraron los síntomas característicos de la antracnosis fueron registrados, aislando el patógeno en estudio de las lesiones observados de dichos frutos (de los Santos-Villalobos et al., 2013).
Ensayos de confrontación in vitro. Ensayos de confrontación se llevaron a cabo con la finalidad de cuantificar la capacidad de control de T. asperellum T8a contra C. gloeosporioides ATCC MYA 456. Estos ensayos se desarrollaron co-inoculando 1 x 105 esporas de la cepa ATCC MYA 456 con 1 x 105 esporas de la cepa T8a (a una distancia de 6 cm del patógeno), en cajas de Petri conteniendo agar papa dextrosa (PDA) como medio de cultivo, incubando éstas a 28 °C durante 8 día (de los Santos-Villalobos et al., 2013). El porcentaje de inhibición de C. gloeosporioides ATCC MYA 456 se calculó utilizando la ecuación:
Donde: %I= porcentaje de inhibición (%), A1= área de la caja de Petri (en mm2) cubierta por C. gloeosporioides inoculado sin el agente de control, A2 = área de la caja de Petri (en mm2) cubierta por C. gloeosporioides co-inoculado con T. asperellum T8a (de los Santos-Villalobos et al., 2013).
Ensayos de concentración mínima inhibitoria in vitro. El impacto de diferentes dosis de Captan 50® sobre C. gloeosporioides ATCC MYA 456 y T. asperellum T8a fue evaluado a través de ensayos de concentración mínima inhibitoria. Para ello, 1 x 105 esporas de cada microorganismo estudiado fueron inoculadas en cajas de Petri conteniendo PDA como medio de cultivo, adicionado con un gradiente de concentraciones de Captan 50® (g L-1): 0, 0.1, 0.25, 0.5, 1.0, 1.5, 3.0, 6.0, 9.0, 12.0, 15.0. Las cajas de Petri fueron incubadas a 28º C durante 8 días. Las tasas de crecimiento fueron cuantificadas mediante la ecuación:
Donde: TC= tasa de crecimiento (mm2 h-1); C1= crecimiento inicial (mm2); C2= crecimiento final (mm2); T1= tiempo inicial (h); T2= tiempo final (h) (de los Santos-Villalobos et al., 2013).
Ensayos de sinergismo T. asperellum T8a - captan 50® contra C. gloeosporioides ATCC MYA 456. Ensayos de confrontación triple se llevaron a cabo con la finalidad de cuantificar la capacidad de control del sinergismo T. asperellum T8a - Captan 50® contra C. gloeosporioides ATCC MYA 456. Los ensayos fueron desarrollados mediante la co inoculación de 1 x 105 esporas de la cepa ATCC MYA 456 y T8a (a una distancia de 6 cm) en cajas de Petri conteniendo PDA como medio de cultivo, adicionado con 0.1 g L-1 de Captan 50®. Las cajas de Petri inoculadas fueron incubadas a 28 °C durante 8 día (de los Santos-Villalobos et al., 2013). El porcentaje de inhibición de C. gloeosporioides ATCC MYA 456 fue calculado utilizando la ecuación 1.
Análisis estadísticos. Todos los experimentos fueron replicados independientemente tres veces. Los datos obtenidos fueron analizados por la prueba de análisis de varianza (ANOVA) de una vía y el método de Tukey-Kramer (p= 0.05), utilizando el software JMP-SAS v 8.0.2.
Resultados y discusión
Características macro y microscópicas de los microorganismos estudiados. La antracnosis, causada por el hongo fitopatógeno C. gloeosporioides, es la principal enfermedad que afecta la producción de mango a nivel mundial, conduciendo a pérdidas de 90% de la producción cuando las condiciones ambientales son favorables para el desarrollo de este agente causal (Arauz, 2000). En el presente estudio se evaluó el control de este fitopatógeno a través del sinergismo entre un agente de control biológico y un fungicida sintético (T. asperellum T8a y Captan 50®, respectivamente).
La cepa ATCC MYA 456 de C. gloeosporioides presentó, a nivel macroscópico, micelio hialino que rápidamente se convirtió en algodonoso de color gris oscuro, presentando lento crecimiento en cajas de Petri conteniendo PDA como medio de cultivo, cubriendo dichas cajas en su totalidad después de 7 días, en incubación a 28 ºC (Figura 1a); a nivel microscópico presentó micelio y conidias septadas, estas últimas de forma ovoide (Figura 1b), dichas características han sido previamente reportadas para esta especie por Montero-Tavera et al. (2010). El agente de control de origen microbiano, T. asperellum T8a, presentó macroscópicamente micelio con anillos concéntricos verdes/blancos en presencia de periodos de 12 h de luz/oscuridad, crecido en cajas de Petri conteniendo PDA como medio de cultivo, e incubado a 28º C (Figura 1c), y a nivel microscópico mostró hifas septadas y la presencia de las fiálides típicas de éste género, albergando las conidias (Figura 1d ) (Druzhinina et al., 2011). La caracterización molecular de estos microorganismos realizada mediante la amplificación y secuenciación del gen 5.8S RNAr, mostró una cobertura 100% e identidad 99% comparada con las secuencias de nucleótidos de las especies de C. gloeosporioides y T. asperellum previamente reportadas en la base de datos del NCBI, confirmando la taxonomía e identidad de los microorganismos estudiados.
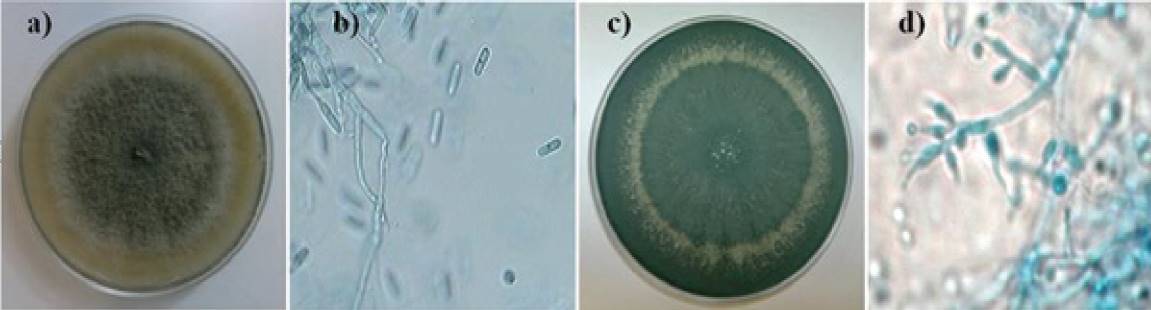
Figura 1. Microorganismos utilizados en este estudio. Características macroscópicas y microscópicas de C. gloeosporioides ATCC MYA 456 (a y b), y T. asperellum T8a (c y d), inoculados en cajas de Petri conteniendo PDA como medio de cultivo, e incubadas a 28 ºC durante 7 días.
Ensayos de patogenicidad de C. gloeosporioides ATCC MYA 456. El principal problema en el control de la antracnosis es la gran diversidad genética, y en consecuencia patogénica, de las cepas de C. gloeosporioides en campo, por ejemplo, en 1992 se reportaron alrededor de 600 variantes de esta especie (Bailey y Jeger, 1992). Además, Bonde et al. (1991) distinguieron diversas formas patogénicas basadas en sus hospederos específicos y características culturales. De esta manera, estudios sobre el grado de patogenicidad específico de cada cepa de este fitopatógeno son necesarios para diseñar estrategias eficientes de control en campo. Así, ensayos de patogenicidad de C. gloeosporioides ATCC 456 fueron desarrollados in vivo, observando que esta cepa presentó la capacidad de causar la antracnosis en 100% de los mangos inoculados, enfermedad caracterizada por la aparición de manchas negras que coalescen para formar lesiones irregulares (Figura 2). Lo anterior refuerza las evidencias reportadas sobre las especies del género Colletotrichum, consideradas como las más exitosas dentro del grupo de hongos fitopatógenos para la severidad de la enfermedad que causa a su planta hospedera. Además, su capacidad de causar infecciones latentes o quiescentes ubica a este género dentro de los patógenos más importantes a nivel post-cosecha (Jeffries et al., 1990).
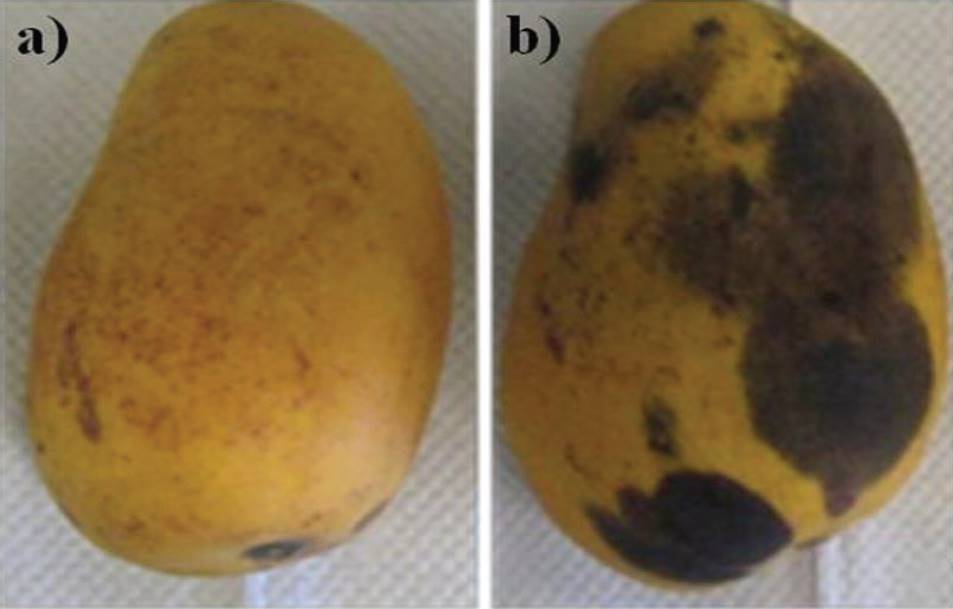
Figura 2. Ensayo de patogenicidad de C. gloeosporioides ATCC MYA 456 in vivo. a) fruto no inoculado; y b) fruto inoculado con 1 x 106 esporas del fitopatógeno estudiado, e incubado en una cámara húmeda (28 ± 1 °C, humedad relativa de 85 ± 5%, fotoperiodo de 12 h (540 Lux) - 12 h (20 Lux), durante 15 días).
Ensayos de confrontación entre T. asperellum T8a y C. gloeosporioides ATCC MYA 456. En los últimos años, el control de la antracnosis se ha centrado principalmente en el uso de métodos físicos (poda, luz ultravioleta y atmósferas modificadas) y químicos (fungicidas sintéticos, cobre e inhibidores de colesterol) (Stevens et al., 1997; Ker, 2001; Karabulut y Baykal, 2004; Arias y Carrizales, 2007). Sin embargo, estas alternativas presentan problemas económicos, ambientales y de eficiencia en el control del agente causal. Por lo cual, la generación u optimización de alternativas de control sostenible de esta enfermedad es determinante para incrementar la competitividad del cultivo del mango. En el presente trabajo, la cepa T. asperellum T8a fue evaluada como agente de control de origen microbiano contra C. gloeosporioides ATCC MYA 456, y posteriormente el impacto de la incorporación de Captan 50® a dicha interacción fue estudiado.
Los ensayos de confrontación mostraron la capacidad de T. asperellum T8a para inhibir el crecimiento de C. gloeosporioides ATCC MYA 456, en 91%, esto a través de mecanismos micoparasíticos, observando un sobre-crecimiento en el hongo fitopatógeno por la cepa T8a (Figura 3), evidenciando la capacidad de la cepa T8a como alternativa promisoria de control de origen microbiano contra el agente causal de la antracnosis (de los Santos-Villalobos et al., 2013). El comportamiento micoparasítico observado de la cepa T8a, ha sido evidenciado para el género Trichoderma (estado teleomorfo: Hypocrea), el cual ha sido estudiado por poseer formas de vida biotrófica y saprófita, cuya capacidad para micoparasitar (mediante la biosíntesis de enzimas líticas) ha sido enfocada para la protección de plantas contra diversas enfermedades fúngicas, es decir, su aplicación como agente de control biológico (Atanasova et al., 2013).
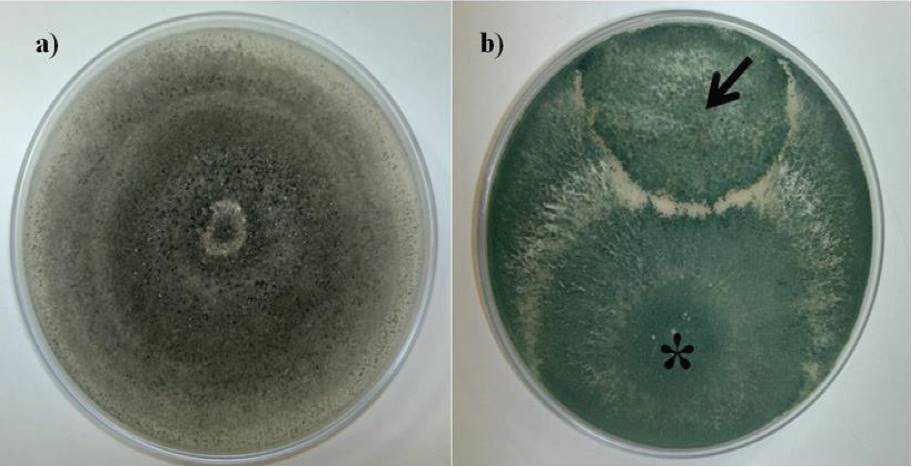
Figura 3. Ensayos de confrontación entre T. asperellum T8a y C. gloeosporioides ATCC MYA 456, a través de mecanismos micoparasíticos (indicado por una flecha).
Ensayos de concentración mínima inhibitoria de los microorganismos estudiados por captan 50®. captan 50® es un fungicida de contacto muy potente que contiene el grupo N-triclorometiltio, y pertenece al grupo de las Ftalimidas. Este fungicida interactúa con los tióles celulares produciendo tiofosgeno, el cual es un compuesto tóxico que interfiere en el proceso de respiración de las células fúngicas, inhibiendo la germinación de las esporas y dificultando su crecimiento y desarrollo (Bravoag, 2013).
El control de la antracnosis en mango a través de captan 50® se ha llevado a cabo mediante cinco aplicaciones de 2 kg ha-1 cada una, para un total de 10 kg ha-1; sin embargo, este fungicida es muy persistente en el ambiente (Alpuche, 1990), conduciendo a efectos residuales en los frutos. Además, estas aplicaciones de captan 50® propician la generación de resistencia por parte de hongos fitopatógeno, así como la represión de la población y diversidad de aquellos hongos susceptibles a este fungicida, limitando su papel ecológico.
De esta manera, ensayos de concentración mínima inhibitoria de captan 50® sobre C. gloeosporioides ATCC MYA 456 y T. asperellum T8a fueron desarrollados con la finalidad de conocer: i) el potencial efecto inhibitorio del fungicida residual sobre T. asperellum T8a cuando sea inoculado, lo cual limitaría su efectividad; y ii) la mínima concentración de captan 50® que en co-inoculación con T. asperellum T8a no interfiera con su desarrollo, pero que contribuya al control incrementado de C. gloeosporioides ATCC MYA 456.
Estos ensayos mostraron que concentraciones iguales o mayores a 0.5 g L-1 de captan 50® adicionadas a cajas de Petri conteniendo PDA como medio de cultivo, inhibieron en su totalidad el crecimiento de C. gloeosporioides ATCC MYA 456, sin embargo, concentraciones menores (0.1 y 0.25 g L-1) inhibieron el crecimiento del patógeno 36% (Figura 4).
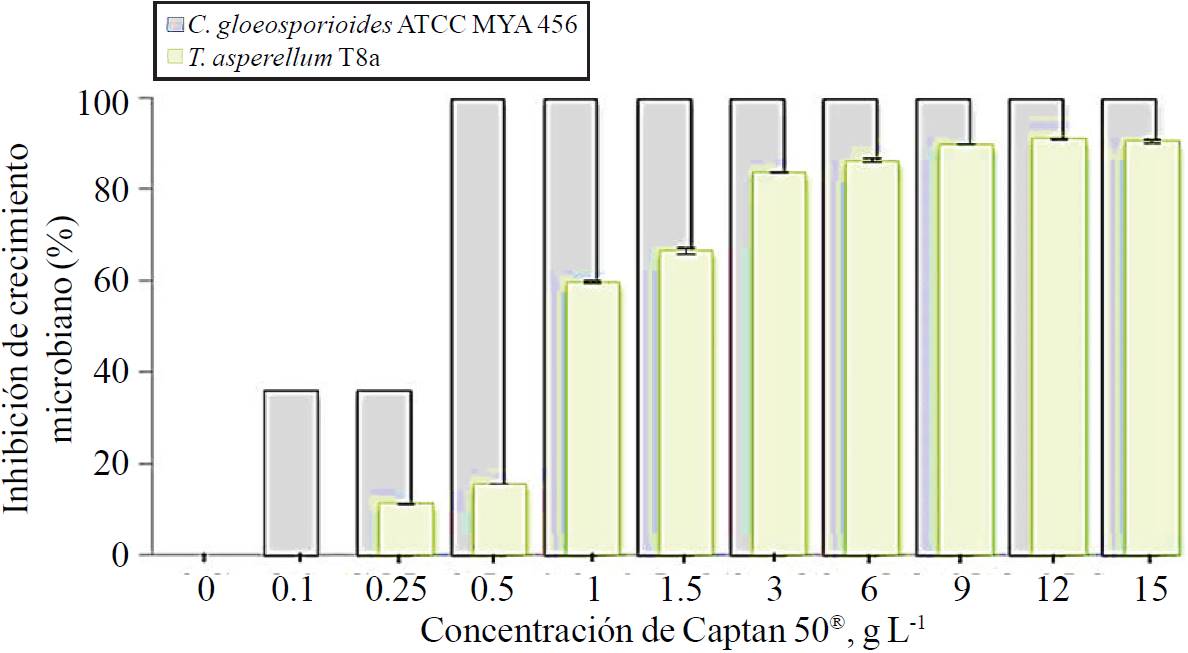
Figura 4. Concentración mínima inhibitoria de Captan 50® sobre C. gloeosporioides ATCC MYA 456 (barras color gris) y T. asperellum T8a (barra color verde), en cajas de Petri conteniendo PDA como medio de cultivo e incubadas a 28 ºC durante 7 días.
Por otro lado, el crecimiento de T. asperellum T8a fue inhibido 93% cuando se inoculó en la concentración más alta evaluada (15 g L-1), y sólo 16% cuando se utilizó 0.5 g L-1 de Captan 50®, en comparación con la inhibición 100% en el crecimiento del fitopatógeno a la misma dosis. Estos resultados evidencia una mayor resistencia del agente de control de origen microbiano a los efectos inhibitorios de captan 50® en comparación con el hongo fitopatógeno en estudio, observaciones similares sobre la resistencia de cepas del género Trichoderma a fungicidas sintéticos han sido reportados, i.e. cepas de Trichoderma asperelloides y Trichoderma harzianum se desarrollaron en concentraciones incrementadas de fungicidas sintéticos, tales como: captan, 2350 ppm; tiabendazol, 20 ppm; y una mezcla de captan-carboxina, 1 500 ppm (Chaparro et al., 2011).
En el presente estudio la concentración de captan 50® seleccionada para ensayos posteriores fue 0.1 g L-1, esto con la finalidad de potenciar el control del fitopatógeno a través de la sinergia del fungicida estudiado y la cepa micoparasítica T8a, debido a que 0.1 g L-1 de captan 50® inhibe el crecimiento de C. gloeosporioides ATCC MYA 456 en 36%, sin mostrar efectos inhibitorios sobre T. asperellum T8a.
Ensayos de sinergismo T. asperellum T8a - Captan 50® contra C. gloeosporioides ATCC MYA 456. El ensayo de confrontación entre la co inoculación de los agentes de control (0.1 g L-1 de captan 50® + T. asperellum T8a) vs. C. gloeosporioides ATCC MYA 456 mostró un efecto sinérgico de esta interacción para el control del agente causal de la antracnosis; es decir, la dosis seleccionada de captan 50® (0.1 g L-1) inhibió 36% el crecimiento de C. gloeosporioides ATCC MYA 456, y T. asperellum T8a en 91%, después de 8 días de incubación a 28 ºC, utilizando PDA como media de cultivo. Sin embargo, la interacción de los agentes de control (0.1 g L-1 de captan 50® + T. asperellum T8a) incrementó la inhibición del crecimiento del fitopatógeno hasta 99%, bajo las mismas condiciones de cultivo (Figura 5).

Figura 5. Inhibición del crecimiento de C. gloeosporioides ATCC MYA 456 a través de la sinergia entre T. asperellum T8a y 0.1 g L-1 Captan 50®. Los ensayos fueron desarrollados en cajas de Petri conteniendo PDA como medio de cultivo, adicionado con 0.1 g L-1 Captan 50®, co-inoculando los microorganismos en estudio a una distancia de 6 cm, con incubación a 28º C por 8 días.
Estos resultados sugieren el siguiente mecanismo de acción de la combinación de los agentes de control utilizados: la concentración de 0.1 g L-1 de captan 50® no afecta el crecimiento de T. asperellum T8a, pero sí el desarrollo de C. gloeosporioides ATCC MYA 456, por lo cual, cuando ambas cepas microbianas son co-inoculadas en cajas de Petri conteniendo PDA adicionado con 0.1 g L-1 de captan 50®, se inhibe o retarda el crecimiento del fitopatógeno sin afectar el desarrollo de T. asperellum T8a, proporcionando primeramente una ventaja en la competencia por espacio y nutrientes de la cepa T8a, y posteriormente cuando T. asperellum T8a intercepta el micelio del fitopatógeno con crecimiento retardado por la dosis de captan 50® utilizada, se inicia el micoparasítismo. De esta manera, se demuestran la capacidad de la cepa T8a para sobrevivir en ambientes con moléculas remanentes de captan 50®, lo cual potencia su capacidad de control biológico bajo la compatibilidad específica con dicho fungicida sintético, representando una promisoria herramienta para el control sostenible de enfermedades fúngicas en los cultivos.
Resultados similares han sido reportados por Shaiesta et al. (2013), mostrando la capacidad de una cepa de Trichoderma harzianum para tolerar altas dosis de captan (3 g L-1), carbendazim (1 g L-1), bitertanol (1 g L-1), hexaconazole (1 g L-1), y mancozeb (3 g L-1), cuantificando una inhibición de su crecimiento en 36.6%, 90.8%, 40%, 16.1% y 11.7%, respectivamente. Además, Ordentlich et al. (1990) reportó un incremento de la productividad de papa cv. Draga y cv. Desiree 46% y 80%, respectivamente, debido a la reducción de la infección causada por Verticillium dahliae, mediante un control integrado por la aplicación de Trichoderma harzianum y captan.
Conclusión
El uso integrado de T. asperellum T8a y una dosis baja de captan 50® (0.1 g L-1) condujo a la inhibición del crecimiento in vitro, de manera incrementada y sinérgica, de C. gloeosporioides ATCC MYA 454, cepa patogénica causante de antracnosis en el mango. Lo cual representa una alternativa sostenible promisoria para el control de la antracnosis en huertas de mango, así como el control de diversas enfermedades en cultivos de interés. La aplicación de esta alternativa presenta potenciales ventajas en comparación con la aplicación excesiva de fungicidas sintéticos, i) la cepa T8a fue aislada de la rizósfera de árboles de mango de huertas en producción, lo cual sugiere una interacción planta x microorganismo y microorganismos x microorganismo exitosa cuando sea aplicada en campo; ii) T. asperellum T8 mantuvo su capacidad de inhibir el crecimiento del fitopatógeno in vitro en presencia del fungicida sintético evaluado, lo cual evidencia que su capacidad micoparasítica no se ve comprometida aun cuando existan moléculas remanentes de captan 50® en el agro-sistema, como consecuencia de su aplicación excesiva y constante al cultivo del mango; y iii) el uso de esta tecnología permitirá la aplicación reducida de captan 50® debido a la baja dosis utilizada, la cual en combinación con la cepa T8a potenciará el control de C. gloeosporioides, reduciendo los problemas económicos y ambientales por el uso de captan 50®.











 texto en
texto en 


