Introducción
Colletotrichum es un hongo de distribución cosmopolita y con predominancia en las regiones tropicales y subtropicales (Xiao et al., 2004). Comprende principalmente patógenos de plantas y frutos, incluye a más de 100 especies responsables de causar la antracnosis, por tal motivo es esencial identificar las especies para mejorar el control de la enfermedad (Crounch et al., 2014). Colletotrichum gloeosporioides es considerada como la especie más desafiante de resolver, comprende la gama de huéspedes más amplia de todas las especies de Colletotrichum (Du et al. 2005; Prabhakaran, 2010).
En la Figura 1A podemos observar los síntomas en chile pimiento morrón (Capsicum annuum var. annuum) y en la Figura 1B y C se aprecian los frutos de carambola (Averrhoa carambola L.) y mango (Mangifera indica L.) con los síntomas típicos de la enfermedad; la Figura 2A muestra los síntomas de antracnosis en el fruto de papaya (Carica papaya L.), otras especies afectadas son banano (Musa paradisiaca L.), café (Coffea arabica L.), aguacate (Persea americana Mill.), gandul (Cajanus cajan L. Mill sp.), fresa (Fragaria vesca L.), manzana (Malus domestica Borkh.), almendra (Prunus dulcis Mill.) y chirimoya (Annonna cherimola Mill.); en ornamentales como las violetas (Viola odorata L.), orquídeas (orchidaceae) de diferentes géneros y especies, lluvia de oro (Cassia fistula L.); otras plantas como soja (Glycine max (L.) Merr.), menta (Menta piperita L.), lenteja (Lens culinaris L.) y algodón (Gossipium hirsutum L.) (Freeman et al., 2001; Freeman, 2008); ésta misma especie puede causar elevadas pérdidas de los frutos en poscosecha (Gomes et al., 2013).
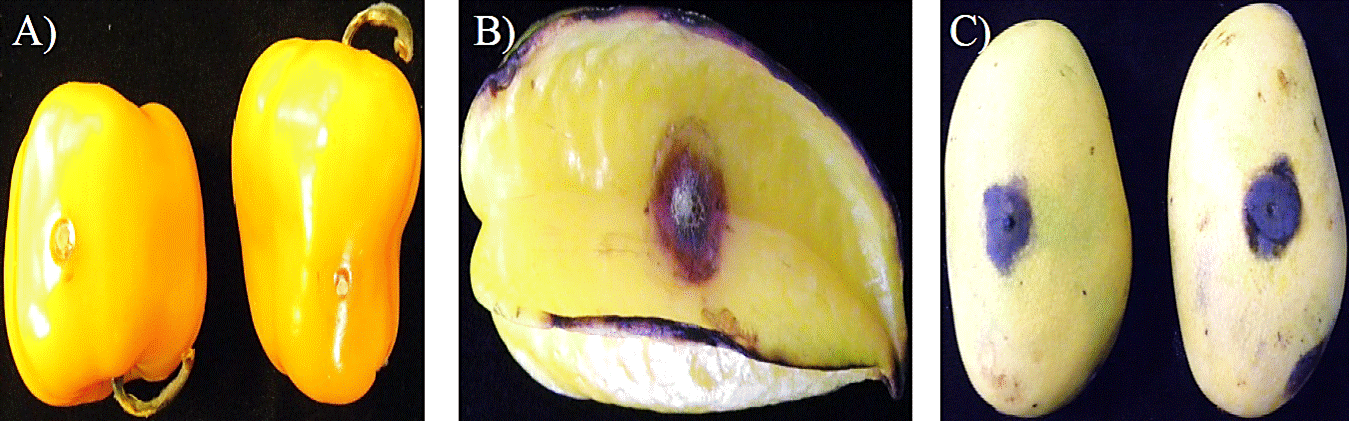
Figura. 1 Síntoma de antracnosis causado por Colletotrichum gloeosporioides, inoculado en A) chile morrón Capsicum annuum var. annuum; B) carambola (Averrhoa carambola L.); y C) mango (Mangifera indica L.).

Figura 2 Colletotrichum gloeosporioides A) Fruto de papaya con antracnosis causada por Colletotrichum gloeosporioides; B) Colletotrichum gloeosporioides. creciendo en medio de cultivo PDA; C) Esporas de Colletotrichum gloeosporioides.
Actualmente las alternativas de control para Colletotrichum spp. son variadas debido a que la estrategia más común, los plaguicidas, han causado resistencia en los organismos patógenos. Entre los métodos de control del patógeno en precosecha y poscosecha se encuentran el uso de aire caliente, tratamientos hidrotérmicos, atmósferas modificadas (Karabulut y Baykal, 2004; Gutiérrez et al., 2004; Ragazzo et al., 2015), luz ultravioleta, ozono (Cia et al., 2009), extractos de plantas (Bautista-Baños et al., 2003) y microorganismos agentes de control biológico que actúan como antagonismo contra diversos patógenos como Rodhotorula minuta, Bacillus subtilis, Trichoderma spp., por mencionar algunos (Janisiewics y Korsten, 2002; Spadaro y Gullino, 2004; Pérez, 2006; Vos et al., 2014).
Bioracionales en contra de Colletotrichum gloeosporioides. En la actualidad, los productos naturales gozan de amplia aceptación y reemplazan cada vez más a los productos sintéticos o materiales generados artificialmente. Como respuesta a esta tendencia se ha producido un creciente interés en la investigación de la posible utilización de aceites esenciales, extractos de plantas, entre otros. Por lo anterior, una alternativa al uso de moléculas químicas sintéticas para el control de organismos dañinos en la agricultura es la aplicación de biorracionales, los cuales son definidos como sustancias producidas por microorganismos, plantas o minerales, que se descomponen en pocas horas después de aplicarlos y son específicos para el organismo que se desea controlar (O’Farril, 2008).
Respecto al uso de plantas con propiedades antimicrobiales, Lara et al. (2014) encontraron que los glucosinolatos aislados de floretes de brócoli a concentraciones de 1.54 y 0.92 µg/ µL-1 inhibieron en su totalidad la germinación de esporas de Colletotrichum gloesporioides aislado de mango (Mangifera indica L.). Extracto de raíces de Gliricida sepium contra C. gloeosporioides fue probado reduciendo la severidad de la antracnosis 94% sobre frutos de papaya Hawaiana en poscosecha, mientras que el testigo químico la redujo 84% (Loaiza y Rivera, 2000). Otro extracto que se ha utilizado para control de C. gloeosporioides en papaya en poscosecha es de semilla de este mismo fruto, solo y mezclado con quitosano, inhibiendo este último el crecimiento micelial de C. gloeosporioides a concentraciones de 2.5 y 3%. Los resultados in vivo demostraron que a una concentración de 1.5% de quitosano, la severidad fue de 1% (Bautista-Baños et al., 2003).
Lo anterior demuestra que el quitosano tiene potencial fúngico en contra de diferentes patógenos que pertenecen al reino fungi, lo cual se debe a que posee carga policatiónica, mientras que las paredes de los hongos poseen carga negativa desactivando la germinación de las esporas de Botryosphaeria parva y C. gloesporioides (Everett et al., 2005).
Otro de los bioracionales a utilizar son los aceites esenciales de diversas especies de plantas con propiedades antimicrobiales, estos afectan el desarrollo de hongos tanto in vitro como in vivo de productos hortícolas (Molina et al., 2010). Una de estas especies es Thyme vulgaris L., cuyo aceite esencial se ha encontrado que es antibacterial y antifúngico, ensayado sobre varios microorganismos patógenos (Hammer et al., 1999; Vanneste y Boyd, 2002; Rassooli y Mirmostafa, 2003; Yang y Clausen, 2007).
Cuando se ensayó la efectividad biológica del aceite en contra de C. gloeosporioides aislado de papaya en poscosecha tuvo un efecto fungicida, el desarrollo del hongo se vio reducido a medida que las concentraciones aumentaron (Molina et al., 2010). De manera similar Landero et al. (2013) encontraron que el aceite de canela tuvo un mejor efecto en la inhibición micelial cuando las concentraciones aumentaron; sin embargo, estas fueron bajas (0.0015, 0.0025 y 0.005%) comparadas con el extracto de ajo que inhibió 100% del desarrollo del hongo cuando utilizó 10% de concentración del mismo. Lo anterior indica que debido a la efectividad de los aceites utilizados a bajas concentraciones podrían considerarse con mayor potencial para uso promisorio a nivel comercial.
Control biológico de Colletotrichum gloeosporioides. El control biológico de antracnosis ha sido reportado en manzanas (Janisiewicz et al., 2003), papaya (Gamagae et al., 2004), aguacate (Korsten et al., 1995) y mango (Carillo et al., 2005). La mayor parte de los experimentos de control biológico en enfermedades poscosecha se han realizado aplicando los antagonistas en condiciones controladas de humedad y temperatura. Pocos trabajos se han realizado con aplicación de microorganismos en condiciones de campo, en donde la efectividad de los antagonistas es afectada por otros factores, como cambios de temperatura, humedad, luz ultravioleta e interacción con otros microorganismos. Paradójicamente uno de los mayores obstáculos para el desarrollo del control biológico en poscosecha es su relativa inhabilidad para controlar infecciones establecidas en precosecha, como son las infecciones latentes (Spadaro y Gullino, 2004). Sin embargo, Ippolito y Nigro (2000) afirman que la aplicación en campo de los agentes de control biológico puede propiciar la colonización de la superficie del fruto y prevenir el establecimiento de infecciones latentes en los frutos de la huerta productora.
En antracnosis de mango, Juárez (2001) reportó una extensiva búsqueda de microorganismos antagonistas al agente causal de esta enfermedad, donde se aislaron 120 cepas (5 levaduras y 115 bacterias) de la filósfera de mango, de las cuales dos cepas, una bacteria (Bacillus subtilis) y una levadura (Rodhotorula minuta) fueron las que presentaron mayor actividad antagonista en ensayos in vitro contra C. gloeosporioides.
Por su parte, Baños-Guevara et al. (2003) empleó bacterias antagonistas y extractos de plantas con propiedades fungitóxicas, para evaluar los efectos de la antracnosis sobre algunas características físicas, químicas y fisiológicas de frutos de papaya Maradol roja. Los resultados mostraron que dos cepas de B. firmus y cuatro de Pseudomonas fluorescens redujeron in vitro el crecimiento de C. gloeosporioides. Algunos ejemplos de microorganismos antagonistas utilizados exitosamente para controlar enfermedades en poscosecha son: B. licheniformis contra C. gloeosporioides en mango (Govender et al., 2005).
Trichoderma spp. (Figura 3A, B, C, D, E y F) es considerado el antagonista más estudiado para el control de fitopatógenos. Infante et al. (2009) estudiaron y realizaron un resumen sobre los modos de acción. En la integración de los resultados mencionaron que los mecanismos de acción que permiten el control de patógenos a Trichoderma spp., se encuentra la competencia por el sustrato, parasitismo (Figura 3A, B, C, D y F), antibiosis, desactivación de enzimas del patógeno, penetración (Figura 3F) y resistencia inducida, principalmente.

Las flechas rojas indican las hifas de Colletotrichum, las flechas negras indican las hifas de Trichoderma.
Figura 3 Colletotrichum gloeosporioides, hifa interactuando con A) Trichoderma viride; B) Trichoderma longibrachiatum; C) Trichoderma asperellum 1; D) Trichoderma asperellum 2; E) y F) Trichoderma harzianum parasitando, lisando o deformando el micelio de Colletotrichum gloeosporioides.
Control de Colletotrichum spp. a través de la manipulación molecular. La manipulación de genes a través de técnicas de ingeniería genética ha permitido disminuir la síntesis de etileno, considerada la hormona de la madurez en especies vegetales, Colletotrichum spp., se desarrolla en el fruto precisamente cuando este inicia su maduración. Con la finalidad de disminuir la síntesis de etileno se han llevado a cabo trabajos donde se desarrollaron plantas a las cuales se les ha silenciado los genes ACC oxidasa mostrando diversas alteraciones (Wi y Park, 2002). Frutos en poscosecha también han sido sometidos a este tipo de técnicas, retrasando la madurez en el caso del jitomate, además de detener la descomposición debida a la presencia de C. gloeosporioides, cuya infección estuvo detenida hasta la aplicación de etileno externo (Cooper et al., 1998). Otra especie a la cual se le han silenciado exitosamente un gran número de genes es Nicotiana benthamiana (Robertson, 2004) que también es susceptible a infección por Colletotrichum orbicularie (Shen et al., 2001).
Las principales fuentes de resistencia a antracnosis han sido identificadas en Capsicum baccatum L. y C. chinense Jacq. Por el Centro de Desarrollo e Investigación Asiática de Vegetales en 1999, y los investigadores han usado estas fuentes para estudiar la herencia de la resistencia a antracnosis (Pakdeevaraporn et al., 2005; Kim et al., 2010; Lee et al., 2010. Análisis genéticos de poblaciones segregantes mostraron que los patrones de herencia de la resistencia varían dependiendo de la especie y aislamiento de Colletotrichum, la fuente de la resistencia, y también la etapa de madurez del fruto. Considerando a Colletotrichum acutatum, la resistencia provino de C. chinense ‘PBC932’ en la línea ’0038-9155’. El patógeno fue controlado por dos genes dominantes complementarios en frutos verdes, pero dos genes recesivos en frutos rojos (Lin et al., 2007).
Colletotrichum capsici ha sido otra de las especies sobre las cuales se ha trabajado para su control, debido a que puede causar pérdidas poscosechas hasta de 30% (Lakshmesha et al. (2002). Por ello, Lakshmesha et al. (2007) redujo la actividad de celulasa (42.86%) y pectinasa (40%) de este patógeno, exponiendo durante tres días el micelio maduro bajo rayos ultravioleta (312 nm de longitud de onda a una distancia de 12 pulgadas) durante diferentes tiempo, encontrando que a 45 min de exposición C. capsici fue menos virulento. La reducción en la actividad de las enzimas resultó en 3.5 días de retraso en la manifestación de la antracnosis. Para el caso específico de chile maduro en interacción con C. gloeosporioides se encontró que el gen esterasa de chile (PepEST) es altamente expresable durante interacciones incompatibles, así como que la expresión del gen es específica para el fruto en respuesta a la inoculación del patógeno, además puede ser regulada por heridos y tratamientos con ácido jasmónico durante la maduración. Esta expresión de genes PepEST no se presenta en frutos sin madurar (Ko et al., 2005).
Inductores de resistencia a Colletotrichum spp. Actualmente la inducción de resistencia a patógenos en frutos cosechados usando elicitores, físicos, químicos y biológicos está pasando a ser un enfoque prometedor para controlar enfermedades postcosecha como una alternativa a los fungicidas (Terry y Joyce, 2004). El ácido β-aminobutirico no proteíco (BABA), un raro compuesto encontrado en la naturaleza, se ha mostrado que induce resistencia en contra de un amplio rango de organismos patógenos, incluyendo hongos, virus, bacterias y nematodos en plantas (Zimmerli et al., 2001; Cohen, 2002; Van der Ent et al., 2009; Quaglia et al., 2011). Otros inductores que han sido probados en contra de C. gloeosporioides son ácido salicílico, ácido 2,6-dicloroisonicotinico, ácido benzo1,2,3-tiadiazole-7-carbotioico S metil ester y ácido jasmónico, encontrándose que ácido salicílico a una concentración de 1 mM sobre frutos inmaduros de chile no se presentaron síntomas de la enfermedad, al igual que en frutos maduros sin tratar (Lee et al., 2009) etapa en la cual la resistencia a fitopatógenos incrementa (Oh et al., 1999).
Conclusiones
La principal forma de control de Colletotrichum spp., es a través del uso de productos químicos sintéticos. La resistencia a los fungicidas y la presión regulatoria respecto a residuos de pesticidas y la preocupación por la salud humana están en aumento. Los productos biorracionales como son los extractos vegetales son productos naturales que han aumentado su importancia y aplicación en las últimas tres décadas, no como una moda, sino por el conocimiento de sus propiedades químicas, necesarias para defenderse eficientemente de microorganismos e insectos, propiedades que el hombre ha aprovechado para su beneficio, sin verse afectado negativamente el ambiente.
Otra de las alternativas son los biofungicidas, ampliamente estudiados, han demostrado ser compatibles con otros productos, así como operar a través de una amplia variedad de mecanismos. En lo que respecta a la compatibilidad de microorganismos benéficos con otros productos es limitada, así tenemos para el caso de hongos biofungicidas que solo toleran la mezcla con ciertos fungicidas químicos sintéticos, es necesario que el productor conozca los diferentes grupos químicos a los que pertenecen los fungicidas y poder hacer uso eficaz y eficiente de los biofungicidas. Los inductores de defensa de la planta han demostrado ser eficaces en la supresión de Colletotrichum spp., tanto por sí solos como en combinación con otros productos.
La manipulación genética constituye una de las alternativas más viables en la actualidad; sin embargo, es una estrategia cara que requiere de mayor conocimiento para considerarla segura, además, la obtención de un producto manipulado puede tardar años en lograrse, lo cual implica gasto de diversos recursos.
Cabe destacar que la necesidad de controlar las enfermedades poscosecha es lo que ha permitido desarrollar estrategias que contribuyan al éxito de la agricultura sustentable. La integración de diversas actividades tiene el objetivo de disminuir la dependencia por el control químico. Además, la integración de éstas actividades tiene la finalidad de impulsar un sistema de producción modelo, que beneficie al productor y al mismo tiempo permita al consumidor contar con un producto que satisfaga los requerimientos de calidad, sin impactar de forma negativa al ambiente.











 texto en
texto en 


