Introducción
Los pueblos indígenas y mestizos americanos han aprovechado varias especies de agave desde hace siete mil años. Los agaves son especies monocotiledoneas de los que obtienen diversos bienes y servicios, tales como sustancias para uso medicinal, combustible, cobijo, ornato, abono, materiales para la construcción de viviendas y elaboración de implementos agrícolas (García-Mendoza, 2007). El Agave potatorum Zucc es una especie silvestre propia de selva baja caducifolia, que es aprovechada de manera no planificada, por lo que sus poblaciones han sido disminuidas en los Valles centrales, sierra sur y Mixteca del estado de Oaxaca. Se le usa principalmente para la elaboración artesanal de una bebida alcohólica destilada denominada mezcal (Pérez y Casas, 2007), con un sabor y aroma característicos debido a la proporción de compuestos aromáticos volátiles (Molina et al., 2007; Vera et al., 2009; Vera-Guzmán et al., 2010).
De tres a cinco meses antes de que las plantas adultas se colecten, los campesinos evitan que desarrollen el tallo floral y por consiguiente se evita la producción de semillas, vitales para su propagación, de tal manera que las poblaciones de esta especie han disminuido notablemente (Enríquez, 2008). Se tienen antecedentes no documentados que desde fines de los años 1990’s grupos de campesinos de la sierra sur de Oaxaca han implementado su propagación mediante semilla y establecen plantaciones. Sin embargo, la cantidad de plantas que se producen aun no compensa la cantidad de plantas adultas que se cosechan, por lo que se propone la propagación in vitro como complemento a los métodos convencionales.
La micropropagación, consiste en la propagación asexual de plantas utilizando las técnicas de cultivo de células, tejidos u órganos vegetales, con la cual se pueden obtener producciones masivas en poco tiempo y que ayudaría a aumentar en un mediano plazo la disponibilidad de materia prima de esta especie. Para incrementar la producción de plantas de esta especie, se necesita generar protocolos en que se definan las condiciones de cultivo en cada etapa: selección de plantas a propagar, propagación in vitro, aclimatización en invernadero, crecimiento en vivero, cultivo en campo.
En un proceso de micropropagación se presenta el riesgo de que ocurra la muerte de plantas producidas in vitro cuando éstas se transfieren al suelo y deben adaptarse a las nuevas condiciones del ambiente ex vitro (Domínguez y Donayre, 2006). Lo anterior se puede superar al someter las plantas a un proceso de aclimatización en invernadero y vivero durante el cual las plantas micropropagadas desarrollan estructuras resistentes a las condiciones ambientales ex vitro, en que se presentan condiciones de baja humedad relativa, alta intensidad de luz, fluctuaciones de temperatura y constante estrés de resistencia a enfermedades.
La aclimatización satisfactoria, aumenta la tasa de sobrevivencia de las plantas cuando éstas se establecen en vivero y campo. Se tienen antecedentes de micropropagar y la aclimatización de diversas especies de agaves: A. tequilana (Valenzuela-Sánchez et al., 2006); A. cocui (Salazar et al., 2009); A. fourcroydes (Garriga et al., 2010); A. americana (Enríquez et al., 2013). En la aclimatización en invernadero de plantas micropropagadas de A. angustifolia Enríquez et al. (2012) mostraron que el nivel de abastecimiento de nutrimentos tuvo efecto positivo en el tamaño que estas plantas alcanzaron al término de 70 días de esta etapa.
Diversos factores ambientales afectan la productividad de las plantas: temperatura, disponibilidad de agua, CO2, radiación solar, abastecimiento de nutrimentos. Para el buen desarrollo de las plantas es necesario el aporte de nutrimentos, tales como el nitrógeno, fósforo, potasio, azufre, calcio y magnesio y los micronutrimentos fierro, cobre, manganeso, zinc, molibdeno, cloro, boro y níquel. Cuando un suelo no proporciona alguno de estos nutrimentos en la cantidad suficiente que la requerida por las plantas, es necesario aplicarlo a través de un fertilizante que contenga dicho nutrimento. Dentro de los nutrimentos esenciales, el nitrógeno es el más importante, pues aunque la planta cuente con un abastecimiento adecuado del resto de los elementos minerales, su disponibilidad en cantidades inferiores al óptimo se manifiesta con un crecimiento, desarrollo y producción deficientes (Martínez et al., 2013). En plantas de Agave potatorum en campo, su abastecimiento influyó en el tamaño del área foliar, concentración de clorofila, la fotosíntesis neta lo que influye en la productividad (Moya, 2002; Martínez-Ramírez et al., 2012).
Debido a los pocos estudios de producción in vitro de Agave potatorum Zucc, es necesario investigar por medio de la experimentación, los medios adecuados para su propagación, por lo que el objetivo del presente trabajo fue evaluar el desarrollo en vivero de plantas de Agave potatorum micropropagadas-aclimatizadas, las que se fertirrigaron durante cinco meses con dosis diferentes de nutrimentos.
Materiales y métodos
La presente investigación se llevó a cabo en el laboratorio de cultivo de tejidos vegetales, invernadero de aclimatización y en el vivero del Instituto Tecnológico del Valle de Oaxaca, en la población de Nazareno, municipio de Santa Cruz Xoxocotlán, a 12 km de la ciudad de Oaxaca. Se ubica en las coordenadas 96° 44’ longitud oeste, 17° 02’ latitud norte y a una altura de 1 530 msnm (INEGI, 2010).
Se obtuvieron in vitro 300 plantas de Agave potatorum Zucc a partir de la proliferación de brotes adventicios y el posterior enraizado de éstos. Las plantas, homogéneas en características, se retiraron de la condición in vitro, enjuagaron cuidadosamente para retirar el agar impregnado en las raíces y se transfirieron individualmente a macetas de 300 cm³, con un sustrato que fue una mezcla 1:1 en volumen de perlita y turba; y se colocaron en condiciones de invernadero de aclimatización.
Las plantas para su aclimatización estuvieron 60 días en el invernadero con alta humedad relativa (80- 90%) creada por un sistema de riego por nebulización intermitente que funcionaba 10 s cada 12 min de las 10:00 a las 15:00 h; radiación solar difusa a 500-700 µmol m-2 s-1. La frecuencia de los riegos se controló mediante temporizadores. Posterior al periodo de nebulización las plantas se fertirrigaban a nivel de sustrato con la solución universal de Steiner (1984) a 50% de concentración de nutrimentos. A partir del día 61 y hasta el día 120, las plantas estuvieron en vivero, con piso de concreto, expuestas a radiación solar disminuida 40% con malla sombra. En el vivero las plantas ya no recibieron riegos por nebulización, pero si fertirriego a nivel de sustrato. Transcurridos los 120 días se seleccionaron 210 plantas homogéneas en tamaño y se separaron en seis grupos de 35 plantas cada uno, para que cada grupo recibiera durante los días 121 a 270, fertirriego con una concentración diferente de nutrimentos, de 10 mL por maceta con alguna alícuota (1, 20, 40, 60, 80 y 100%) de la solución universal de Steiner (1984). El fertirriego se aplicó durante 150 días, desde el día 121 al día 270. La formulación de Steiner a 100% contiene en mg L-1: 166.01 N, 31.35 P, 277.38 K, 182.06 Ca, 49.08 Mg, 110.898 S; 1.33 Fe, 0.00065 Cu, 0.201 Mn, 0.0375 Zn, 0.077 B, 0.019 Mo.
En el día 270 se tomaron al azar diez plantas por tratamiento, en las cuales se contabilizó su número de hojas; el área foliar (cm2) se cuantificó al colocar el conjunto de hojas en un acetato, del que se obtuvo una fotocopia; las imágenes de las hojas se recortaron y pesaron en una balanza analítica con capacidad de 160 g y precisión de 0.1 mg y este peso se comparó con el correspondiente de un trozo de papel de la misma calidad y de área conocida. El diámetro del tallo (cm) se determinó mediante un vernier; número de raíces primarias; para el volumen de raíz (cm3) ésta se separó del resto de la planta, se sumergió en un volumen conocido de agua en una probeta graduada de 250 ml, determinando el volumen mediante el desplazamiento del agua. Para determinar en cada planta su peso seco foliar (g), peso seco del tallo (g), y peso seco de las raíces (g) estas se pusieron por separado en bolsas de papel, las que se colocaron durante 72 h en estufa de secado a 70 °C para después pesar cada uno en balanza analítica con capacidad de 160 g y precisión de 0.1 mg.
El experimento se estableció según un diseño completamente al azar. La unidad experimental fue una planta en una maceta de 300 cm3 y se tuvieron 10 repeticiones por tratamiento. Los datos se sometieron al análisis de varianza, la prueba de Tukey para comparación de medias (α= 0.05) y además se realizaron análisis de correlación.
Resultados y discusión
Al aplicar un protocolo de micropropagación vegetal, interesa obtener gran cantidad de plantas de morfología normal y que gran proporción de éstas se adapte con éxito a condiciones de invernadero, vivero y campo. Se tienen antecedentes de la micropropagación de A. potatorum (Domínguez et al., 2008) en que la proliferación de brotes se logró en un medio de cultivo con citocininas, e incubados por 30 a 45 días bajo luz continua a 54 µmol m-2 s-1. Los brotes obtenidos se transfirieron para su enraizado a medio de cultivo sin citocininas, en condiciones similares de incubación que la etapa anterior y transcurridos 30 días; 87% de los brotes había formado raíces adventicias. Las plantas se transfirieron a macetas y condiciones de invernadero, y transcurridos 45 días el 73% de estas plantas se había adaptado. En dicho trabajo se consideró que la adaptación de las plantas había sido exitosa cuando éstas mostraron reinicio de crecimiento. No se tienen antecedentes del desempeño en vivero de las plantas de Agave potatorum micropropagadas- aclimatizadas. Abreu et al (2007) describieron que plantas micropropagadas de A. fourcroydes cuando habían transcurrido 45- 60 días de aclimatización en invernadero perdieron su hoja de mayor edad, formada durante el cultivo in vitro, pues estas hojas no fueron capaces de asumir los cambios anatómicos necesarios para la adaptación.
En el presente trabajo, al someter las plantas micropropagadasaclimatizadas de Agave potatorum a fertirriego durante los días 121 al 270, los análisis de varianza (Cuadro 1) mostraron que las dosis de fertilización (1, 20, 40, 60, 80 y 100%) tuvieron efecto diferente altamente significativo (Pr≤ 0.01) sobre el desarrollo de las plantas en su número de hojas (NH), peso seco de las hojas (PSH), área foliar (AF), diámetro del tallo (DT), peso seco del tallo (PST), número de raíces primarias (NRP), volumen de raíz (VR) y en el peso seco de las raíces (PSR).
Cuadro 1 Resumen de análisis de varianza de las características de las plantas de Agave potatorum Zucc, obtenidas in vitro que durante cinco meses en vivero de aclimatización recibieron soluciones nutritivas con concentraciones diferentes de nutrimentos.
| FV | GL | Cuadrados medios y significancia | |||
| NH | PSH | AF | DT | ||
| Trat | 5 | 65.42 ** | 19.65 **** | 102583.91 ** | 0.792 ** |
| Error | 54 | 2.59 | 0.82 | 1827.08 | 0.071 |
| Total | 59 | ||||
| fv | GL | PST | NRP | VR | PSR |
| Trat | 5 | 0.0537 ** | 65.50 **** | 19.14 ** | 0.192 ** |
| Error | 54 | 0.0073 | 6.79 | 4.21 | 0.05 |
| Total | 59 | ||||
FV= fuente de variación; TRAT= tratamiento; GL= grados de libertad; NH= número de hojas; PSH= peso seco de las hojas (g); AF= área foliar (cm2); DT= diámetro del tallo (cm); PST= peso seco del tallo (g); NRP= número de raíces primarias; VR= volumen de raíz (cm3); PSR= peso seco de las raíces (g); **altamente significativo con Pr≤ 0.01; *significativo con Pr≤ 0.05; ns= no significativo.
Las plantas de Agave potatorum Zucc, que se sometieron a la solución nutritiva con concentración al 100% y las plantas que se sometieron a la solución nutritiva al 1% (Cuadro 2) presentaron 6.5 y 2.79 g de peso seco foliar, 392.35 y 126.53 cm2 de área foliar, 2.84 y 2.22 cm de diámetro del tallo; 7.4 y 4.0 cm3 de volumen de raíz, 0.92 y 0.6 g de peso seco de raíces, magnitudes que en cada caso fueron significativamente diferentes (Tukey, 0.05). En el análisis de correlación la variable número de hojas tuvo correlación positiva, altamente significativa (Pr≤ 0.01) con el peso seco de las hojas (r= 0.76), área foliar (r= 0.88), diámetro del tallo (r= 0.63), volumen foliar (r= 0.84) y con el peso seco de raíces (r= 0.48). Teixeira et al. (2005), menciona en la aclimatización de plantas de banano micropropagadas, debe incluir alta humedad relativa, una temperatura que va desde 18 a 28 °C, radiación solar disminuida en 50% mediante el uso de sombras, el sustrato con suficiente porosidad para adecuada aireación de las raíces y drenaje de exceso de agua. Además, el suministro de nutrientes tiene efecto sobre el tamaño de la planta, ya que Enríquez et al. (2009) describieron que plantas de Agave angustifolia Haw. micropropagadas-aclimatizadas durante 70 días en invernadero en contenedores con sustrato perlita y posteriormente con mezclas de arena-compost en vivero. Se encontró, que las plantas que recibieron solución nutritiva tuvieron crecimiento superior que las no fertirrigadas, aun cuando ambos tipos de plantas hubieran estado en sustratos con contenido alto de materia orgánica.
Cuadro 2 Características de las plantas micropropagadas-aclimatizadas de Agave potatorum Zucc después de cinco meses en vivero aplicándoles diferentes concentraciones de la solución Steiner.
| Trat | Con | Promedios | |||||||||
| PSH | AF | DT | VR | PSR | |||||||
| 1 | 1% | 2.79 | C | 126.53 | D | 2.22 | C | 4 | B | 0.6 | B |
| 2 | 20% | 3.64 | C | 205.53 | C | 2.47 | BC | 6.4 | AB | 0.85 | AB |
| 3 | 40% | 5.07 | B | 265.41 | B | 2.71 | AB | 7.5 | A | 0.97 | A |
| 4 | 60% | 5.13 | B | 313.16 | B | 2.89 | A | 7.6 | A | 0.94 | A |
| 5 | 80% | 5.98 | AB | 370.91 | A | 2.94 | A | 7.2 | A | 0.93 | A |
| 6 | 100% | 6.5 | A | 392.35 | A | 2.84 | A | 7.4 | A | 0.92 | A |
Trat= tratamiento; CON= concentración; PSH= peso seco de las hojas (g); AF= área foliar (cm2); DT= diámetro del tallo (cm); VR= volumen de raíz (cm3); PSR= peso seco de las raíces (g). En cada columna valores con la misma letra no son significativamente diferentes (Tukey, 0.05).
Conforme se incrementó la cantidad de nutrimentos en la solución nutritiva Steiner las plantas de Agave potatorum Zucc. micropropagadas- aclimatizadas, alcanzaron tamaños mayores, de tal manera que las plantas más grandes fueron las que se fertirrigaron con la solución nutritiva al 100%. Transcurridos cinco meses, de que las plantas se estuvieron fertirrigando con concentraciones diferentes de nutrimentos, se observó que todas las plantas sometidas al abastecimiento de diversos niveles nutrimentales incrementaron en el número de hojas (Figura 1), pero el incremento estuvo en relación positiva con las dosis de fertirriego que recibieron. Las plantas que se fertirrigaron con la solución nutritiva a 100% de concentración de nutrimentos desarrollaron en promedio 9.75 hojas, cantidad significativamente (Tukey, 0.05) superior a las 2.55, 5.35, 6.65, 7.45 y 8.65 hojas que tuvieron las plantas que fueron fertirrigadas a 1, 20, 40, 60 y 80% de concentración de nutrimentos. El análisis de correlación mostró que las dosis de fertirriego tuvieron una correlación positiva altamente significativo (r= 0.82; Pr≤ 0.01) con la cantidad de hojas que formaron las plantas. Medrano et al. (2010), micropropagaron Agave durangensis y evaluaron la aclimatización de varios grupos de plantas al establecerlos en diversos sustratos que consistieron de mezclas de tierra, grava volcánica, y abono ovino. Al término de la aclimatización plantas que crecieron en el sustrato con grava y materia orgánica, alcanzaron mayor tamaño que las plantas establecidas en sustrato de solo grava, que no aporta nutrimentos. Uvalle y Vélez (2007) en experimento de nutrición de Agave tequilana Wever var. Azul mencionan que las plantas a las que se abasteció con nutrimentos mediante fertilización, aumentaron su capacidad fotosintética para la fijación de CO2 y la acumulación de biomasa. En plantas micropropagadas de Agave cocui se evaluó el efecto del nitrato de amonio en tres tratamientos (0, 0.5 y 1 g L-1 respectivamente), y se determinó que las plantas fertilizadas con 0.5 g L-1 formaron mayor cantidad de hojas que las plantas no fertilizadas (Díaz et al., 2011).
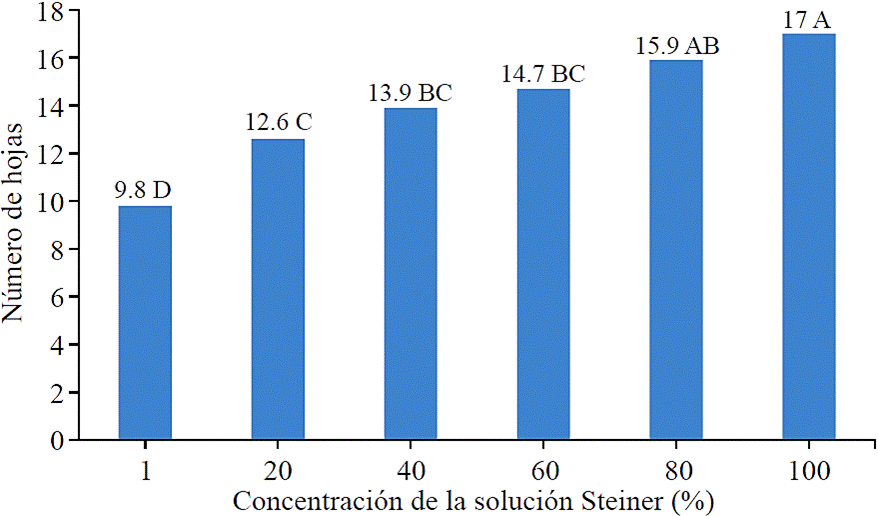
En la gráfica, valores con la misma letra no son significativamente (Tukey, 0.05).
Figura 1 Cantidad de hojas que tuvieron las plantas de Agave potatorum Zucc micropropagadas-aclimatizadas, después de cinco meses en vivero, durante las cuales recibieron diferentes concentraciones de la solución nutritiva de Steiner.
Las plantas acumularon más materia seca conforme se les incrementó el abastecimiento de nutrimentos, de tal manera que las plantas fertirrigadas con concentraciones de 1, 20, 40, 60, 80 y 100% de nutrimentos, sus tallos tuvieron 0.18, 0.25, 0.33, 0.32, 0.37 y 0.37 g de materia seca (Figura 2), y su biomasa total fue de 3.57, 4.74, 6.37, 6.39, 7.28 y 7.79 g, respectivamente. Entre el 76.8 y 83.4% de la biomasa total se concentró en las hojas, entre el 4.7 y 5.2% se concentró en el tallo y entre 11.8 y17.9% se concentró en la raíz. Las plantas que se fertirrigaron a 100% de concentración de nutrimentos, tuvieron 2.05 veces la cantidad de materia seca en el tallo, comparadas a las plantas que se fertirrigaron a 1% de concentración de nutrimentos. Las plantas sometidas al tratamiento de 100% de concentración de nutrimentos, no mostraron acumulación adicional de materia seca en el tallo, ni en la raíz, pero si incrementaron su materia seca foliar, y por lo tanto en la biomasa, comparadas a las plantas fertirrigadas a 80% de concentración de nutrimentos. De lo anterior se obtiene que las plantas fertirrigadas a 1, 20, 40, 60 80 y 100% de concentración de nutrimentos su relación parte aérea/raíz fue de 4.95, 4.47, 5.56, 5.79, 6.82 y 7.46.
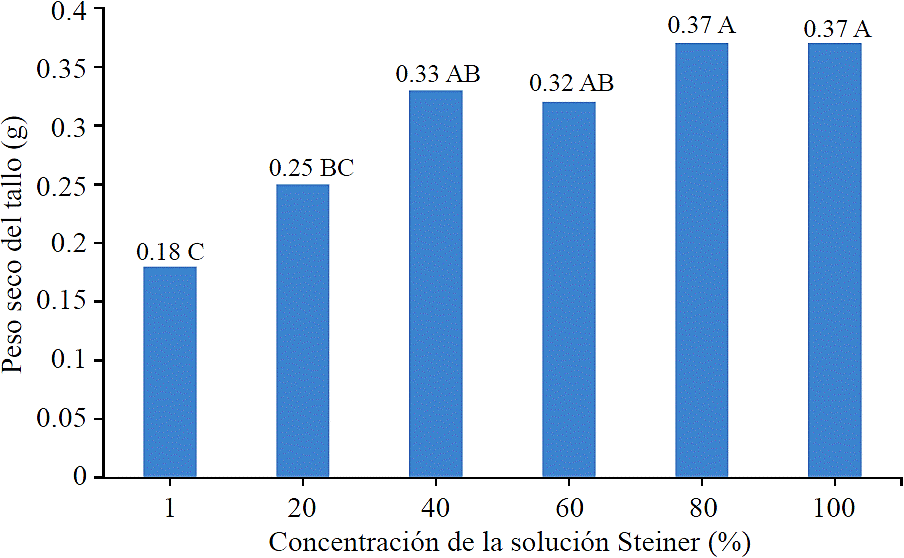
En la gráfica, valores con la misma letra no son significativamente diferentes (Tukey, 0.05).
Figura 2 Peso seco del tallo, después de cinco meses aplicando diferentes concentraciones de la solución nutritiva de Steiner.
Martínez-Ramírez et al. (2013), evaluaron el crecimiento de plantas de Agave angustifolia Haw y A. potatorum Zucc propagadas por métodos convencionales, al establecerlas en tres parcelas que diferían en tipos de suelos, y el total de plantas en cada parcela se separaron en cuatro grupos para someterlos a cuatro dosis de fertilización. Se reportó que las plantas fertilizadas con 30-20-15 kg de N-P-K ha-1 tuvieron 58.3% más biomasa seca que las plántulas no fertilizadas. También se encontró una correlación media positiva, altamente significativa (r= 0.59; Pr≤ 0.01) entre la dosis de fertirriego y el peso seco del tallo.
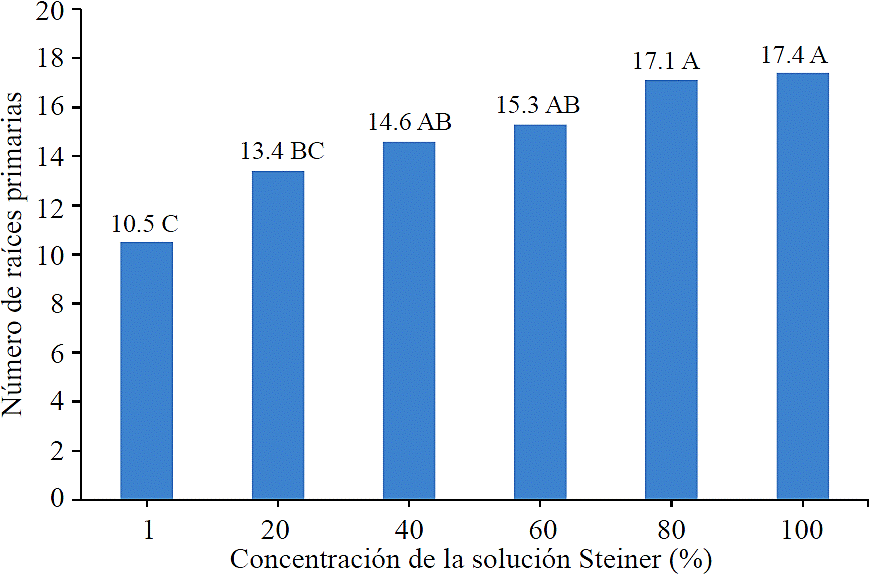
Los datos mostraron que las plantas formaron mayor cantidad de raíces en respuesta al abastecimiento creciente de nutrimentos, hasta 80%, ya que las plantas fertirrigadas con concentraciones de 1, 20, 40, 60 y 80% de solución nutritiva de Steiner (1984) tuvieron en promedio 10.5, 13.4, 14.6, 15.3 y 17.1 raíces primarias. En el caso de las plantas que se fertirrigaron a 100% de nutrimentos, éstas ya no formaron significativamente más raíces en comparación a las plantas fertirrigadas a 80% (Figura 3). El análisis de correlación mostró que la cantidad de raíces primarias que formaron las plantas tuvo una correlación media positiva, altamente significativa (r= 0.66; Pr≤ 0.01) con las dosis de fertirriego que recibieron. En el presente trabajo se determinó que la dosis de fertirriego apropiada para los 121 a 270 días de crecimiento ex vitro de las plantas de Agave potatorum Zucc, micropropagadas, fue 80% de nutrimentos de la formulación Steiner (1984). El manejo de una dosis de fertilización es importante, ya que en caso de plantas micropropagadas de Agave cocui Trelease, Díaz et al. (2011) se reporta que algunas plantas que recibieron dosis demasiado altas de nitrógeno disminuyeron su cantidad y longitud máxima de raíces, debido al efecto tóxico del fertilizante.
Conclusiones
Las plantas de Agave potatorum Zucc micropropagadasaclimatizadas, mostraron un desarrollo y crecimiento adicional en el número de hojas, peso seco foliar, área foliar, diámetro del tallo, peso seco del tallo, número de raíces primarias, volumen de raíz y peso seco de raíces, en respuesta a las dosis crecientes de solución nutritiva de Steiner (1984) durante los cinco meses que se fertirrigaron en vivero.
El tamaño que obtuvieron las plantas al término del experimento estuvo en relación positiva con la cantidad de nutrimentos en la solución nutritiva. El rango óptimo de fertirriego para las plantas en esta etapa de desarrollo está entre 80 y 100% de la solución universal de Steiner.











 texto en
texto en