Introducción
El empleo de reguladores del crecimiento en la agricultura se ha hecho con diversos fines; como promotores del crecimiento (giberelinas, citocininas y auxinas) e inhibidores o retardadores del crecimiento, el uso de estos últimos se hace entre otros propósitos para el amarre de frutos y control de la altura de los cultivos sin demerito en la producción Jankiewicz (2003). En papa se han evaluado in vitro, con fines de mantenimiento de germoplasma, como inductores de la tuberización y tolerancia a altas y bajas temperaturas, en invernadero el uso de ellos está orientado a limitar el crecimiento y desarrollo de la planta para facilitar las labores de cultivo e incrementar el número de tubérculos por planta y por metro cuadrado, es decir para favorecer el proceso de tuberización (Flores, 2009).
El proceso de tuberización está influenciado por fotoperiodo, temperatura, condiciones que regulan los niveles endógenos de los reguladores de crecimiento Mauk y Langille (1978), incremento de carbohidratos en el ápice del estolón, baja en la concentración de giberelinas Martínez et al. (2001) y un incremento de ácido absícico Xu et al. (1998). Las giberelinas actúan como inhibidor de la tuberización Krauss (1985), así, en condiciones de inducción de la tuberización el bajo aporte de nitrógeno altero el radio de hormonas ácido absicico: giberelinas, incrementó el ácido absicico y decreció la cantidad de giberelinas, lo que coincidió con el inicio de la tuberización Krauss y Marschner (1981). Los niveles endógenos de giberelinas en plantas de papa son altos en condiciones no inductivas (altas temperaturas y fotoperiodos largos) y decrecen bajo condiciones de inducción de la tuberización (Vreugdenhil y Sergeeva, 1999).
Existen varios inhibidores de crecimiento que se han empleado como agentes antagónicos de las giberelinas en condiciones no inductivas de la tuberización (altas temperaturas y fotoperiodos largos), como son: tetcyclasis, cycocel, paclobutrazol, uniconazol, alar, ancymidol y daminozida, algunos de los cuales incrementan la formación de tubérculos en condiciones de in vitro e invernadero (López et al., 1998; Rodríguez et al., 2006; Tekalign et al., 2005; Flores et al., 2011).
El paclobutrazol inhibe la biosíntesis de las giberelinas, mediante la oxidación de ent-kaureno (Dicks, 1980) y bloquea las reacciones de oxidación entre el kaureno y el ácido kaurenoico. El restablecimiento del crecimiento de la planta con aplicación de giberelinas comprueba que este efecto se debe al paclobutrazol (Balamani y Poovaiah, 1985). Se ha demostrado que pretratamientos de paclobutrazol en camote incrementa su sistema antioxidante (Kuan-Hung, 2006). En papa, en condiciones de in vitro concentraciones de paclobutrazol de 0.001 mg L-1 produjeron microtubérculos de mayor peso y diámetro que el testigo Kianmeher et al. (2012), así mismo, aplicaciones de cinetina de 2 .5 mg L-1 no tuvieron influencia significativa en la formación de tubérculos, sin embargo aplicaciones junto con paclobutrazol (0 .001 mg L-1) incrementaron significativamente la tuberización. Mientras que el paclobutrazol estimulo el inicio de la tuberización e inhibió el crecimiento (Simko, 1993).
Por otro lado, en invernadero disminuye la altura de la planta, la tasa de crecimiento del cultivo y reduce la partición de asimilados a hojas, tallos, raíces y estolones, incrementándola hacia los tubérculos (Flores et al., 2011) y (Balamani y Poovaiah, 1985) provoca también, el incremento de clorofila a y b, aumenta el diámetro de raíces y hace más gruesa la capa de células del mesófilo en empalizada y tejido esponjoso (Tsegaw et al., 2005); en condiciones de alta temperatura, mejora la productividad de tubérculos y reduce el crecimiento del tallo (Tekalign et al., 2004).
Aplicaciones de 150 y 450 mg L-1 de paclobutrazol incrementaron el número de minitubérculos en cultivos sin suelo (Lim et al., 2004), mientras que Bandara y Tanino (1995), obtuvieron en invernadero en la variedad Norland casi el doble de tubérculos con una sola aplicación de paclobutrazol de 450 mg L-1. Sin embargo, Flores (2011) mencionan que con 150 mg L-1 de paclobutrazol o 20 mg L-1 de uniconazol, se redujo la altura de las plantas sin afectar el número y biomasa de tubérculos. Sin embargo, también existen estudios donde puede existir un efecto negativo por la aplicación de paclobutrazol, se menciona que puede reducir la biomasa de la planta completa (Tekalign et al., 2005) e incluso el rendimiento de minitubérculos (Hughes y Keith, 2003).
Por otro lado, el ácido salicílico (AS) tiene efectos pleítropicos, está involucrado directamente en el crecimiento de las plantas, termogénesis, inducción floral y en la asimilación de iones (Hayat et al., 2007). Se ha mencionado como promotor del crecimiento al favorecer altura e incremento del diámetro del tallo en crisantemo y chile habanero (Guzmán et al., 2012; Villanueva et al., 2009), se ha demostrado que incrementa la biomasa y productividad de frutos en chile jalapeño (Sánchez et al., 2011), así mismo, diversos estudios demuestran su participación en la inducción de tolerancia al estrés por bajas temperaturas, choques de alta temperatura y salinidad en papa en condiciones de in vitro (Mora y López, 2006; Scoot et al., 1999; Sajid y Aftab, 2012) e inductor de tolerancia a algunas enfermedades como el tizón tardío de la papa, el síndrome de punta morada de la papa (Halim et al., 2007; López et al., 2013) y Rizoctonia solani (Hadi y Baladi, 2010), este último autor menciona que aplicaciones de 2 mM de AS incrementaron el número de tubérculos en plantas infectadas con el hongo. Debido a todas las propiedades mostradas el AS se considera una verdadera hormona vegetal involucrada en la defensa de las plantas y reacciones de inmunidad a estrés abiótico, contribuye a la regulación del crecimiento y desarrollo de las plantas (Rivas y Plasencia, 2011).
Hasta el momento no se conoce que el AS intervenga de manera antagónica con la giberelinas; sin embargo, varios genes están bajo la regulación transcripcional de este, entre ellos los genes que intervienen en la síntesis de ácido jasmónico y etileno (Galis y Matsuoka, 2007). López y Scott (1996), indujeron la tuberización en papa en cultivos in vitro mediante el empleo de 7.5 x 10-4 de ácido acetil salicílico (ASA). Además se ha logrado la detención del crecimiento con el uso de ASA y CCC en plantas de papa in vitro (López et al., 1998). Mientras en campo, aplicaciones de ASA incrementaron el rendimiento y mejoraron la calidad de los tubérculos para la industria (Nickell, 1991).
Materiales y métodos
Los experimentos se realizaron de junio a noviembre de 2012 en invernaderos del INIFAP en Zinacantepec, México a 19° 17’ 21” de latitud norte y 99° 42’ 49” de longitud oeste a 2 640 msnm. La temperatura media al interior del invernadero fue de 14.9 °C con máximas de 36 y mínimas de -1.5 °C respectivamente.
Se emplearon macetas de 1 L de volumen, con una mezcla de perlita grado hortícola de 1 a 4 mm de diámetro y turba 1:1 v/v. Primero se estableció el experimento con el clon 981824 y posteriormente dos experimentos con la variedad Cristal, se utilizaron plantas de in vitro libres de virus. El diseño experimental fue bloques completos al azar, con cuatro repeticiones y 24 macetas por repetición de las cuales sólo se tomaron diez plantas para la toma de datos: para el experimento con el clon 981824 sólo se tomaron: altura, peso fresco, número y diámetro de tubérculos y contenido de almidón en tubérculos. En los experimentos con la variedad Cristal se tomó además, peso seco de tubérculos, almidón en tubérculos, lecturas SPAD e índice de área foliar (IAF). La cantidad de almidón en los minitubérculos se determinó por el método descrito por Peña y Ortega (1991), el contenido de clorofila se evaluó por el método de Lichtenthaler y Wellburn (1983) y se correlaciono con las unidades SPAD obtenidas con el medidor de Konica Minolta Chlorophyll SPAD- 502 plus de acuerdo a (Rodríguez et al., 1998).
Las lecturas de SPAD fueron tomadas en la primera hoja totalmente expandida, haciendo tres lecturas por planta en tres momentos diferentes, 22 días después de la primera aplicación. Asimismo, las lecturas de IAF fueron realizadas al día siguiente de la toma de las lecturas de SPAD, y fueron hechas con el Ceptometro Accupar, modelo LP-80 PAR / LAI.
Las plantas fueron irrigadas mediante goteros de 8 L h-1 con distribuidor de cuatro salidas. Se programaron, dos riegos por día con un gasto de 66 ml por maceta en cada riego para un gasto máximo de 133 ml por maceta, con la solución de 160 N; 60 P; 250 K, 250 Ca; 75 Mg; 3 Fe; 0.5 Cu; 0.5 Mn y 0.5 B en mg L-1 y el pH fue ajustado a 6 + -0.1 y 2 S cm-1 de CE.
Los tratamientos con las diferentes concentraciones de ácido salicílico y paclobutrazol fueron aplicados dos veces por semana después de los 22 días del trasplante (DDT) hasta los 85 DDT por aspersión de 3.0 a 4.5 ml por planta de la solución, 75 a 110 ml por repetición, cuatro concentraciones de AS (10-8, 10-10, 10-12 y 10-14 M) y cuatro concentraciones de paclobutrazol (1, 0.75, 0.5, 0.25 mg L-1), el testigo fue aplicado únicamente con agua.
Resultados y discusión
En general respecto a la variable altura se presentaron diferencias significativas entre tratamientos en los tres experimentos, en el clon 981824 las plantas de mayor altura fueron las correspondientes al testigo, las de las concentraciones 10-8 y10-10 de AS, y las de menor altura correspondieron a los tratamientos de paclobutrazol, mientras en la variedad Cristal en el promedio de ambos experimentos se observa que las plantas de mayor altura fueron las de los tratamientos con AS, las del testigo y aquellas correspondientes a la menor concentración paclobutrazol (0.25 mg L-1) e iguales estadísticamente entre sí, presentándose las plantas de menor altura en los tratamientos de paclobutrazol de 1, 0.75 y 0.5 mg L-1 (Figura 1). En relación a AS, Galis y Matsuoka (2007) mencionan que no existen informes de que sea antagónico de giberelinas; asimismo, se ha mencionado que favorece altura e incremento del diámetro del tallo en crisantemo y chile habanero (Guzmán et al., 2012); Villanueva et al., 2009), lo que no concuerda con los resultados obtenidos en este trabajo, ya que los tratamientos con SA fueron en la variedad Cristal iguales al testigo y en el clon 981824 las plantas presentaron menor altura que este.
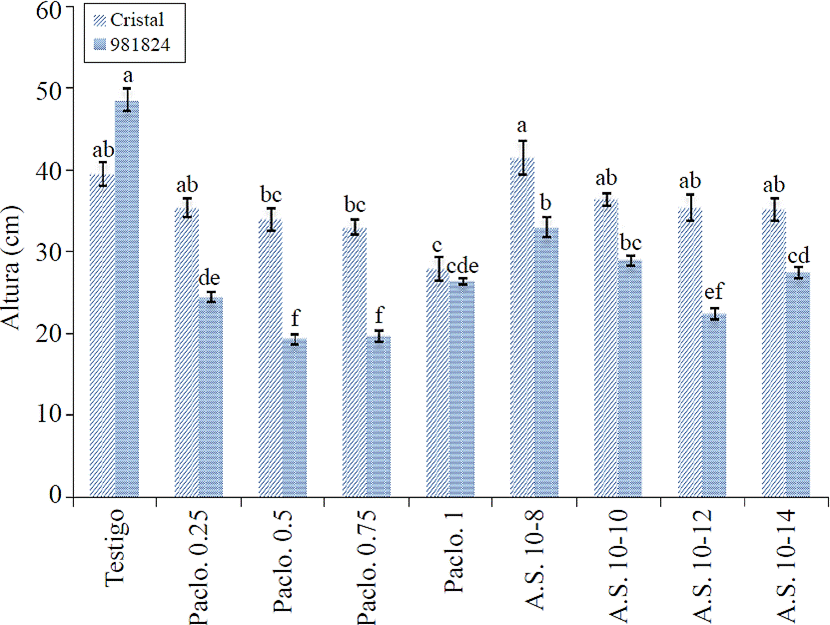
En invernadero. Var. Cristal y clon 981824. Tukey α= 0.05. Tratamientos con la misma letra no difieren estadísticamente.
Figura 1 Altura promedio de plantas y comparación de medias con aplicaciones periódicas de Paclobutrazol y AS.
Mientras el paclobutrazol se conoce como inhibidor de la síntesis de giberelinas, ya que se ha logrado el restablecimiento del crecimiento de la planta con aplicación de giberelinas, lo cual comprueba que el efecto de inhibición del crecimiento se debe al paclobutrazol, que inhibe su biosíntesis (Balamani y Poovaiah, 1985). Y Si bien existen diversos trabajos que concuerdan con lo aquí informado que es la detención de crecimiento (Flores et al., 2011; Balamani y Poovaiah, 1985) no existen reportes en relación a la aplicación continua de bajas concentraciones de este inhibidor.
Sin embargo, los resultados pudiesen indicar que la aplicación continua del mismo si ocasiona la posible acumulación de este inhibidor en la planta, lo que provoca la detención de crecimiento. Asimismo, una sola aplicación de paclobutrazol de 1 mg L-1 a los 15 días después del trasplante en papa, no produce ninguna detención del crecimiento.
Concentración de clorofila. El modelo de regresión lineal para determinar la relación entre clorofila y lecturas Spad presentó una R2 de 0.89, α= 0.01, por lo que existe relación significativa entre la concentración de clorofila y las lecturas de SPAD: clorofila total = 0,121882 + (2.86474) (SPAD), al sustituir en la formula los valores de SPAD, se tuvieron los siguientes resultados (Cuadro 1): en la variedad Cristal las plantas con los mayores valores de clorofila correspondieron a los tratamientos de 0.5, 0.75 de paclobutrazol y 10-8 de AS, a los 22 días después de la primera aplicación e iguales al testigo estadísticamente, mientras que para el segundo muestreo 55 DDA, solo la concentración de 0.5 mg L-1 presentó el valor más alto; sin embargo, fue igual al testigo, a los tratamientos con paclobutrazol restantes y a dos de las concentraciones de SA (10-12 y 10-14), y a los 80 DDT no hubo diferencias significativas entre tratamientos. Para esta variable los resultados no fueron concluyentes y aunque algunos autores mencionas que el paclobutrazol incrementa la cantidad de clorofila Tsegaw et al. (2005) en este trabajo no la altero. No así para SA que dos tratamientos (10-8 y 10-10), en la segunda lectura presentaron los menores valores para clorofila en ambos experimentos.
Cuadro 1 Contenido de Clorofila (en plantas de papa a los 22, 52 y 80 DDA en la variedad Cristal con ácido salicílico y paclobutrazol.
| Tratamiento | Clorofila (µg*ml-1) | |||||
| Tukey | MEDIA | Tukey | MEDIA | Tukey | MEDIA | |
| 22 DDA | 52 DDA | 80 DDA | ||||
| Testigo | ab | 151.22 | ab | 151.3 | a | 145.76 |
| Paclo. 0.25 | ab | 152.69 | ab | 154.33 | a | 151.79 |
| Paclo. 0.5 | a | 155.4 | a | 153 | a | 151.55 |
| Paclo. 0.75 | a | 154.33 | ab | 155.51 | a | 152.9 |
| Paclo. 1.00 | ab | 150.6 | ab | 152.59 | a | 152.9 |
| A. S. 10-8 | a | 154.61 | b | 146.58 | a | 149.82 |
| A. S. 10-10 | b | 144.99 | b | 146.44 | a | 145.77 |
| A. S. 10-12 | ab | 149.96 | ab | 153.25 | a | 149.4 |
| A. S. 10-14 | ab | 149.57 | ab | 154.43 | a | 151.39 |
| CV | 5.946 | 5.393 | 4.849 | |||
Tukey α= 0.05. tratamientos con la misma letra no diferente estadísticamente.
En relación al IAF se tomaron dos lecturas, la primera a los 75 DDA y la segunda antes de la cosecha, no se encontró diferencia significativa entre tratamientos; sin embargo, se presenta en ambas lecturas la tendencia de un menor IAF (Figura 2) en el tratamiento de 1 mg L-1 de paclobutrazol. (Figura 2) el mayor índice de área foliar se presentó en plantas del tratamiento de 0.75 mg L-1, sin diferencia estadística significativa; sin embargo, este índice presentó valores normales por encima de 3 unidades, lo que es suficiente para captar más 99% de radiación solar.
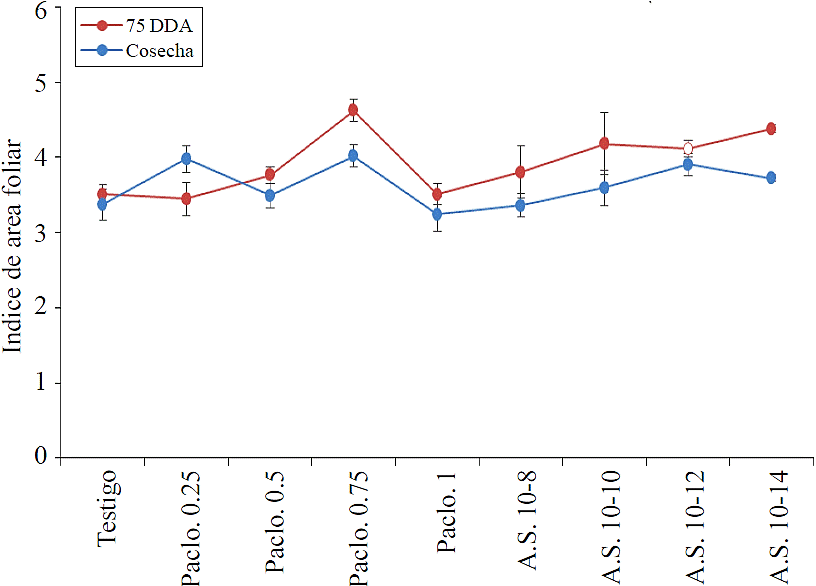
Paclo= paclobutrazol; AS= ácido salicílico.
Figura 2 Índice de área foliar en la variedad Cristal a los 75 días después de la primera aplicación de los tratamientos.
Estos resultados contrastan con lo mencionado por Flores et al. (2011), quienes detectaron una disminución del IAF con respecto al testigo de hasta 54% con el uso de 250 mg L-1 de paclobutrazol en una sola aplicación.
El peso fresco de los tubérculos si se vio afectado por los tratamientos en el clon 981824, no así en la variedad Cristal, la cual no mostró diferencia significativa entre tratamientos, mientras que en el clon 981824 el tratamiento testigo con 137.48 g fue estadísticamente igual a plantas de los tratamientos de Paclobutrazol 0.25 mg L-1 y ácido salicílico 10-8 y mayor, de 18 a 31.5%, al resto de los tratamientos con Paclobutrazol y SA, los cuales disminuyeron el peso fresco de tubérculos (Cuadro 2).
Cuadro 2 Efecto en el Peso fresco de tubérculos producidos en invernadero, variedad Cristal y clon 981824 por acción del paclobutrazol y ácido salicílico.
| Tratamiento | Exp. Cristal | Exp. 981824 | ||
| Tukey | Media | Tukey | Media | |
| P. Frs. | P. Frs. | |||
| Testigo | a | 104.16 | a | 137.48 |
| Paclo. 0.25 | a | 99.32 | ab | 118.25 |
| Paclo. 0.50 | a | 109.25 | bcd | 108.65 |
| Paclo. 0.75 | a | 113.54 | bcd | 104.61 |
| Paclo. 1.00 | a | 98.83 | d | 94.17 |
| A. S. 10-8 | a | 101.12 | ab | 120.88 |
| A. S. 10-10 | a | 102.59 | bc | 111.78 |
| A. S. 10-12 | a | 108.8 | cd | 101.3 |
| A. S. 10-14 | a | 107.6 | bcd | 105.33 |
| CV | 15.778 | 34.447 | ||
Tukey α= 0.05.
En general se puede observar en el clon 981824 que en algunos tratamientos se presentó reducción de peso fresco de tubérculo con Paclobutrazol. Los informes en la literatura difieren y tanto hay resultados que apoyan lo aquí encontrado, como informes donde la biomasa no se ve afectada o incluso es menor de acuerdo a la concentración empleada (Flores et al., 2011); Balamani y Poovaiah, 1985).
En cuanto al número de minitubérculos en ambos genotipos no se observaron diferencias entre tratamientos en tubérculos mayores de 15 mm de diámetro; sin embargo, si se consideran los tubérculos totales si existe diferencia significativa entre tratamientos en ambos genotipos; para la variedad Cristal el tratamiento con mayor número de minitubérculos fue el de paclobutrazol 0.5 mg L-1 con 12.9 tubérculos por planta, y fue igual estadísticamente a los tratamientos de 0.25 y 0.75 mg L-1 de Paclobutrazol y a los de las concentraciones de AS de 10-12 y 10-14, mientras el testigo presento 11.25 minitubérculos por planta, y el tratamiento con el menor número de ellos fue el de AS a 10 -10 M, mientras en el clon 981824 los resultados no fueron concluyentes, pues el tratamiento con mayor número de tubérculos fue con 0.25 mg L-1 y fue igual tanto al testigo, así como al resto de los tratamientos a excepción de AS 10 -8 M que presento sólo 16.9 tubérculos por planta (Cuadro 3). Existen afirmaciones contradictorias en relación respecto al Paclobutrazol, si favorece la tuberización, Tekalign et al. (2005), mencionan que puede provocar disminución de rendimiento, Flores et al. (2011) lo confirman al mencionar que algunas de las concentraciones en estudio de 200 a 250 mg L-1 disminuyen la biomasa de tubérculo, mientras que a concentraciones de 150 mg L-1 no hay diferencia significativa con el testigo sin Paclobutrazol en este sentido.
Cuadro 3 Efecto en el número de tubérculos producidos en invernadero, variedad Cristal y clon 981824 por efecto del paclobutrazol y ácido salicílico.
| Tratamiento | Exp. Cristal | Exp. 981824 | ||||||
| Tukey | Media | Tukey | Media | Tukey | Media | Tukey | Media | |
| TT | T>15 mm | TT | T>15 mm | |||||
| Testigo | bc | 11.2581 | a | 8.4086 | ab | 20.4 | a | 12.85 |
| Paclo. 0.25 | abc | 11.6316 | a | 9.0526 | a | 23.3 | a | 14.5 |
| Paclo. 0.50 | a | 12.9302 | a | 9.5698 | ab | 22.35 | a | 13.4 |
| Paclo. 0.75 | ab | 12.0625 | a | 9.2396 | ab | 21.3 | a | 12.45 |
| Paclo. 1.00 | bc | 10.9684 | a | 8.9789 | ab | 18.3 | a | 12.5 |
| A. S. 10-8 | bc | 10.4471 | a | 8.5294 | b | 16.9 | a | 12.25 |
| A. S. 10-10 | c | 10.2895 | a | 8.6184 | ab | 19 | a | 13.05 |
| A. S. 10-12 | abc | 11.383 | a | 9.234 | ab | 21.3 | a | 14.55 |
| A. S. 10-14 | abc | 11.6787 | a | 9.0217 | ab | 19.35 | a | 12.45 |
| CV | 31.299 | 30.819 | 29.182 | 24.558 | ||||
Tukey α= 0.05. TT= tubérculos totales; T>15 mm= tubérculos mayores de 15 mm de diámetro.
Asimismo, Tekalign et al. (2005), mencionan que puede favorecer la productividad de tubérculos en condiciones de alta temperatura. En tanto para AS, no existen referencias hasta el momento del efecto de concentraciones bajas como 10-12 sobre la producción de minitubérculos; sin embargo, Benavides et al. (2005) menciona que aplicaciones de AS de 10-4 y 10-6 incrementó el número de tubérculos por planta pero no la producción ni el peso promedio por tubérculo. En relación a la respuesta diferente en ambos genotipos, se pudo presentar debido a que la variedad cristal produce menos tubérculos y es intermedia, mientras que el clon 981824 es tardío y tiene un potencial de producción mayor. Lo anterior confirma que la variabilidad genética entre genotipos puede dar una respuesta diferente frente a diferentes condiciones de cultivo.
Contenido de almidón. Se observa en el clon 981824, en general, una tendencia a acumular en tubérculo mayor contenido de almidón en los tratamientos con respecto al testigo, como se puede apreciar en la (Figura 3). Todos los tratamientos con paclobutrazol presentaron valores superiores de almidón que el testigo, mientras que con AS de las cuatro concentraciones evaluadas tres de ellas fueron ligeramente superiores al testigo.

Figura 3 Concentración de almidón en tubérculo con ácido salicílico y paclobutrazol en papa, clon 981824.
Asimismo, en la variedad Cristal los resultados fueron similares al experimento con el clon 981824, ya que de acuerdo al análisis de varianza y prueba de diferenciación de medias de Tukey (Cuadro 4), existen diferencias entre tratamientos α= 0.0001 detectándose que dos de los tratamientos con paclobutrazol 1 y 0.75 mg L-1 presentaron las mayores concentraciones de almidón, con 241.92 y 231.24 mg g-1 de peso fresco, respectivamente, mientras que con las concentraciones de 0.5 y 0.25 mg L-1 el contenido de almidón en los tubérculos fue igual al detectado en tubérculos del tratamiento testigo, estos resultados concuerdan con lo mencionado por Balamani y Poovaiah (1985) quienes afirman que el paclobutrazol disminuye el aporte de asimilados hacia tallos, hojas, raíz y estolones, incrementándolo hacia los tubérculos y Tsegaw et al. (2005) mencionan que el paclobutrazol incrementa la síntesis de almidón en las células de la medula del tallo y células corticales de tallo y raíz. Los tratamientos de ácido salicílico de 10-8 y 10-12, también fueron superiores al testigo en el contenido de almidón en tubérculo, con 173.96 y 165.26 mg g-1 de peso fresco, respectivamente. Mientras los tratamientos con 10-10 y 10-14 fueron iguales estadísticamente al testigo. Estos resultados concuerdan con resultados obtenidos por Nickell (1991), quien con aplicaciones de ASA en condiciones de campo incrementó el rendimiento y mejoraron la calidad de los tubérculos para la industria.
Cuadro 4 Diferencia de medias del contenido de almidón en tubérculos de la variedad Cristal en respuesta a aplicaciones periódicas de paclobutrazol y ácido salicílico.
| Tukey | Media mg g-1 p. fresco | Tratamiento |
| a | 241.92 | PACL 0.75 |
| a | 231.24 | PACL 1.0 |
| b | 173.96 | S. A. 10-12 |
| c b | 165.26 | S. A. 10-8 |
| c b d | 153.64 | S. A. 10-10 |
| e d | 140.28 | Testigo |
| e d | 125.74 | PACL 0.5 |
| e | 116.65 | PACL 0.25 |
| e | 116.17 | S. A. 10-14 |
Tratamientos con la misma letra no son significativas. Tukey α= 0.05.
Conclusiones
Aplicaciones bajas y periódicas de paclobutrazol por aspersión en papa inhiben el crecimiento de la planta, incrementan el contenido de clorofila y favorecen la acumulación de almidón, con una tendencia a incrementar el número de tubérculos en las concentraciones bajas.
Aplicaciones bajas y periódicas de ácido salicílico tienden a favorecer la acumulación de almidón en el tubérculo sin afectar el crecimiento de la planta y producción de minitubérculos.











 texto en
texto en 


