Introducción
Agave americana L. var. Oaxacensis L. es una especie silvestre que se utiliza para elaborar mezcal, que es una actividad estratégica para la economía del estado de Oaxaca, México. Sus poblaciones son escasas, pequeñas y fragmentadas; se encuentran en lugares aislados y han sido disminuidas considerablemente, al grado de no aparecer oficialmente en las cifras de producción del Consejo Regulador del Mezcal (CRM) 2015.
Los productores la aprecian por el tamaño de su tallo de más de 100 kg y su contenido de azúcares, por lo que es una necesidad imperante generar un esquema de propagación que asegure a los productores contar con suficiente materia prima de esta especie en un lapso de tiempo menor que el que implica el esquema tradicional. Según Monja-Mio (2015), el cultivo in vitro representa un método efectivo para la producción masiva de plantas libres de patógenos y que al mismo tiempo permite la selección de los individuos más vigorosos, al respecto, Aureoles et al. (2008), y Domínguez et al. (2008), agregan que en algunos casos permite el rescate, la conservación y multiplicación de especies amenazadas o en peligro de extinción.
El cultivo in vitro es sólo un logro parcial en el esquema de propagación, ya que las plantas que se obtienen presentan características morfológicas y funcionales de acuerdo con las condiciones favorables que predominan, por lo que no están preparadas para enfrentar los cambios bruscos que implica su climatización ex vitro durante la que se debe lograr su sobrevivencia. Y posteriormente la adaptación en de los nuevos individuos en un vivero, para enfrentar con éxito su establecimiento en el campo. Varios autores (Martínez et al., 2005; Abreu et al., 2007; Monja-Mio, 2015) coinciden al señalar que dentro de las características que presentan están su baja capacidad fotosintética debido a los bajos contenidos de pigmentos ya que los cloroplastos presentan granas desorganizadas; la ausencia de cutículas cerosas, estomas poco funcionales debido a la alteración en la forma de las células oclusivas, con distribución diferente a la normal, ineficiencia de los tejidos de sustento debido a la reducida presencia de clorénquima y esclerénquima, absorción y transporte de agua ineficiente debido a una conexión vascular incompleta o deficiente entre la raíz y el brote, que difieren de aquellas plantas que se obtienen mediante métodos convencionales.
Por lo anterior, la aclimatación de las plantas es la etapa decisiva debido al estrés al que son sometidas las plantas, de ella depende el éxito o fracaso de todo el proceso (Ortiz, 2000; Olmos et al., 2004). Durante la aclimatación hay condiciones de menor humedad relativa, mayor variación de temperatura, alta irradiación, y menor disponibilidad de nutrimentos, por lo que se debe considerar: 1) su establecimiento dentro de un invernadero; 2) usar sustratos con buena retención de humedad, buen drenaje y aireación; 2) mantener la temperatura en el rango de 15 a 28 °C, 3) cambiar de manera gradual de alta (90%) a menor (40- 60%) humedad relativa en el transcurso de 30 a 50 días; 4) incrementar la radiación solar de 50% al inicio a radiación solar plena; y 5) abastecimiento adecuado de nutrimentos. Las condiciones anteriores promueven que las plantas desarrollen órganos con características físicas y funcionales que les permitan sobrevivir en el campo (Enríquez et al., 2005; Martínez et al., 2005). Por lo anterior, el objetivo del presente estudio fue evaluar el efecto del sustrato y la dosis de fertilización en la adaptación y desarrollo de plantas micropropagadas de Agave americana var. Oaxacensis L.
Materiales y métodos
El estudio se realizó en el laboratorio de cultivo de tejidos vegetales, el invernadero de aclimatación y el invernadero de adaptación del Instituto Tecnológico del Valle de Oaxaca, situado en Xoxocotlán, Oaxaca, México. Se siguió el esquema de propagación in vitro descrita por Murashige (1974), modificado por Deberg y Maene (1981). Para la multiplicación de propágulos se usaron tejidos de tallo que se establecieron en frascos de 145 cm3 con 25 mL de un medio de cultivo preparado con las sales minerales de Murashige y Skoog (1962), 0.4 mg L-1 de tiamina, 100 mg L-1 de myo- inositol, 30 g L-1 de sacarosa, 1 mg L-1 de benciladenina. El pH del medio se ajustó a 5.8 antes de agregar agar. Los cultivos se incubaron durante siete semanas bajo luz fluorescente blanca a 2000 lux de intensidad, con fotoperiodo de 16 horas y temperatura entre 6 y 30 °C.
Transcurrido este período en cada explante se habían formado grupos de 5 a 12 brotes adventicios, aquellos brotes que tenían de 4 a 5 cm de altura se separaron individualmente para establecer tres en cada frasco de 145 cm3 de volumen total, que tenían 20 cm3 de medio de cultivo para inducir la formación de raíces adventicias. La composición del medio de cultivo fue a la que se usó en la etapa anterior pero sin benciladenina y agregando 0.5 mg L-1 de ácido indolbutírico (AIB). Los cultivos se incubaron durante cuatro semanas en condiciones similares que la etapa anterior. Se obtuvieron in vitro 400 plantas de Agave americana var. oaxacensis de las que se seleccionaron 260 que se transfirieron exvitro, se lavaron con agua corriente para eliminar los restos de agar y fueron sumergidas durante cinco minutos en una solución de fungicida al 5% para evitar la proliferación de hongos en el invernadero. El experimento se estableció de acuerdo con un diseño completamente al azar con arreglo factorial 4 x 5 (sustratos por dosis de fertilización), por lo que se tuvieron 20 tratamientos con 10 repeticiones. La unidad experimental fue una planta. Los análisis de varianza correspondientes se realizaron después de las primeras cinco semanas, a los 210 y a los 245 días, además de la comparación de medias (Tukey, p= 0.05).
Para aclimatar las plántulas, se trasplantaron a macetas de 6 x 6 x 5.5 cm (198 cm3) que contenían uno de los cuatro sustratos: arena (1), arena: vermiculita (1:1), arena: turba (1:1) y arena: vermiculita: turba (1:1:1). Las plántulas se colocaron durante 49 días en un invernadero que tenía condiciones de humedad relativa alta (80-90%), que se mantuvieron diariamente por medio de un sistema de riego intermitente por nebulización, de 10 s cada 12 min. de las 11:00 a las 14:00 h realizándose las atenciones culturales recomendadas para el cultivo (Murguía, 1993); radiación solar disminuida 50%. El total de plantas en cada sustrato se separaron en cinco grupos para aplicarles diariamente una condición de riego: 1) agua (testigo); 2) solución nutritiva (SN) 25%; 3) SN a 50%; 4) SN a 75 %; y 5) SN a 100% de fertilización líquida con solución Steiner (1984), aplicando 15 mL planta-1 a nivel sustrato.
Durante cinco semanas y después de 210 y 245 días en condiciones ex vitro se registraron las variables: altura de la hoja más larga (cm), número de hojas, diámetro de corona (cm) y contenido de clorofila (μg cm-2). Después de 49 días de aclimatación en el primer invernadero se trasladaron al invernadero de adaptación, que es de tipo túnel con cubierta de polietileno en donde se expusieron durante 196 días a radiación solar plena, ventilación y humedad relativa menor (40-60%); las plantas ya no recibieron riego por nebulización pero sí los riegos a nivel sustrato espaciados cada dos días. Cuando transcurrieron se registró la altura de la hoja más larga, número de hojas, diámetro de corona y contenido de clorofila para obtener los incrementos de estas características durante los últimos 35 días.
Resultados y discusión
Crecimiento inicial durante la aclimatación
Cuando terminó la etapa del cultivo in vitro de las plantas de Agave americana éstas, tenían en promedio 4.6 hojas, 10.1 cm de altura en la hoja más larga, 8.5 cm de diámetro de corona, y contenían 20.1 μg cm-2 de clorofila en lámina foliar. Después de cinco semanas las plantas presentaban diferencias estadísticamente significativas producidas por los factores principales. Tanto el sustrato como la dosis de fertilización y la interacción de ambos incidieron significativamente (p≤ 0.01) sobre el incremento en la altura de la hoja más larga (AHML), el número de hojas (NH) y el diámetro de la corona (DC). Mientras el contenido de clorofila (CL) sólo mostró el efecto significativo (p≤ 0.01) de la dosis de fertilización (Cuadro 1).
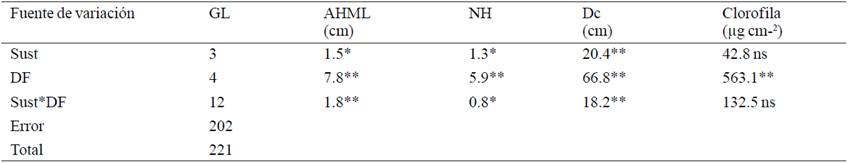
Cuadro 1 Cuadrados medios y significancia del incremento de variables al término de las primeras cinco semanas de aclimatación de plantas micropropagadas de Agave americana var. Oaxacensis L.
Lo anterior puede deberse al proceso natural de aclimatación, ya que las plantas son obligadas a responder en un ambiente estresante, aunque estén bajo cierta protección, en el cual la disponibilidad de nutrimentos tiene más restricciones que en el ambiente in vitro, por lo que responde de mejor manera a la dosis de fertilización, aprovechando los minerales que se proporcionan diluidos y en las formas químicas aprovechables por ellas al estar diluidos en el agua de riego. Tomando en cuenta que tiene poca capacidad para modificar su morfología, la única manera de aumentar su capacidad de fotosíntesis es aumentando su área de captación de luz, por lo que el contenido de clorofila se mantiene sin cambios. Al respecto Salazar et al. (2009), mencionan que lograron la adaptación de Agave cocui Trelease y que las plantas presentaron morfología normal después de una semana.
En cuanto al efecto del sustrato, se observó que las plantas establecidas en el sustrato arena-turba y sin fertilización mostraron mayores incrementos en la altura de la hoja más larga, y en el número de hojas (Cuadro 2). Lo anterior, hace suponer que el contenido de materia orgánica en el sustrato favorece la nutrición de las plantas ya que estabiliza el pH, incrementa la retención de agua, el drenaje, la capacidad de intercambio catiónico y la disponibilidad de nutrimentos, lo que se refleja en el crecimiento de órganos dedicados a la fotosíntesis para asegurar su sobre vivencia, por otra parte es importante considerar que posiblemente la fotosíntesis neta sea cero o incluso pueda presentar valores negativos, debido al descontrol que sufren las vitro plantas al no estar preparadas para enfrentar condiciones fuera del laboratorio. Sin embargo, los nutrimentos disponibles no son suficientes para detonar además, la acumulación de sustancias de reserva y la acumulación de materia seca.
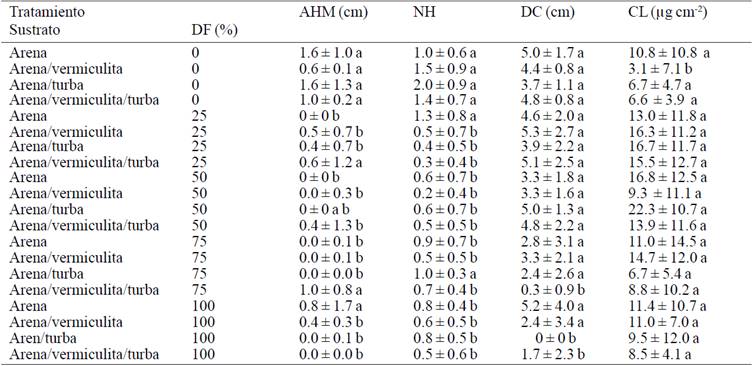
AHM= altura de la hoja mayor; NH= número de hojas; DC= diámetro de corona; CL= clorofila. Media aritmética + desviación estándar de diez observaciones. Medias con letras iguales no son estadísticamente diferentes (Tukey, 0.05).
Cuadro 2 Medias de los incrementos por tratamientos de las primeras cinco semanas de aclimatación de Agave americana var. Oaxacensis L.
Cabe resaltar que el valor más alto para el diámetro de la corona, fue observado cuando las plantas se establecieron en un sustrato arena:- vermiculita y además recibieron riego con una solución al 25% de la solución de Steiner, la acumulación de materia seca puede deberse a que la vermiculita contiene potasio (K), magnesio (Mg) y calcio (Ca) aunque dichas plantas disminuyeron relativamente el incremento en altura y el número de hojas, ya que el valor más alto para la última variable mencionada se registró en el sustrato arena- vermiculita más 25% de solución nutritiva. Estos resultados coinciden con Enríquez et al. (2005), quienes mencionan que plantas micropropagadas de Dendranthema grandiglora no requirieron la aplicación de alguna solución mineral para mostrar crecimiento, llama la atención que los resultados antes mencionados parecen estar influenciados por la combinación de arena y turba en alguna proporción en el sustrato. Este comportamiento parece lógico si se considera que las plantas evaluadas están sometidas a cierto grado de estrés provocado por el cambio brusco en las condiciones ambientales, ya que aunque aparentemente éstas cambian de manera gradual al establecer las plantas fuera del laboratorio, sufren un descontrol total, debido a que no cuentan con mecanismos que les permitan regular funciones básicas como el intercambio de gases, que también repercute en su estado hídrico.
Se observó que el número de hojas, altura de la hoja mayor, diámetro de corona y contenido de clorofila tuvieron un incremento constante durante las primeras cinco semanas, posteriormente las plantas empezaron a perder las hojas de mayor edad durante el periodo comprendido entre los 35 y 70 días de aclimatación. Estos resultados coinciden con los reportados por Abreu et al. (2007), quienes mencionan que plantas de Agave fourcroydes micropropagadas tuvieron una respuesta positiva en cuanto a crecimiento y desarrollo a partir de los 30 días de aclimatización. Por otra parte Monja-Mio et al. (2015), mencionan que las plantas de Agave angustifolia cultivadas in vitro, experimentan cambios severos en la morfología y superficie de la hoja durante la aclimatización, que los más notorios son el desarrollo del aparato estomático, la deposición de ceras epiticulares, la formación de protuberancias y de cristales de óxido de calcio en la epidermis de la hoja, lo que logran después de tres meses. Lo anterior, coincide parcialmente con los resultados de este estudio, ya que a pesar del esfuerzo que realizaron las plantas para aclimatizarse, mostraron crecimiento en AHM y NH, así como la acumulación de materia seca al incrementar el DC durante las primeras cinco semanas. Por otra parte, algunos autores como Pospisilová et al. (1999); Obledo et al. (2004); Abreu et al. (2007); Enríquez (2008) y Monja-Mio et al. (2015) coinciden en señalar que las plantas pierden hojas durante el proceso de aclimatación debido al estrés que padecen cuando son transferidas de las condiciones in vitro a las condiciones de invernadero o de campo, ya que estas plantas no poseen las características anatómicas y fisiológicas para funcionar de forma eficiente, lo que impide que muestren incrementos notables en crecimiento y desarrollo, por lo que sus esfuerzos se canalizan a los procesos mínimos que les permitan la sobrevivencia durante esta etapa sumamente crítica. Respecto a la etapa de aclimatización, Morales et al. (2009), señalan que es un periodo de tiempo durante el cual las plantas resultan más susceptibles al estrés ambiental. Preece y Sutter (1991), coinciden en que deben adaptarse para tener un crecimiento y desarrollo continuo, a nuevas condiciones ambientales como menor humedad relativa, con más luz y sustratos sépticos.
En muchas especies de vegetales, las hojas formadas in vitro son incapaces de seguirse desarrollando en condiciones de invernadero y son reemplazadas por hojas nuevas (Pospisilová et al., 1999). Enríquez (2008) menciona que las plantas de Agave angustifolia sustituyeron las hojas que habían formado en laboratorio por hojas nuevas en la etapa de aclimatación. Este fenómeno que ocurre en las plantas generadas in vitro, son explicadas por Taiz y Zeiger (2002), como una respuesta específica que las plantas presentan para deshacerse de las partes no esenciales; es decir, tomando en cuenta que las hojas fueron formadas in vitro, bajo condiciones controladas en donde no es necesario desarrollar ninguna estrategia de adaptación, por lo que no son aptas para responder a los cambios que implica su aclimatación, por lo que funcionalmente es preferible translocar los componentes útiles y formar nuevas hojas con características morfológicas y funcionales que sustituyen a las anteriores.
Este tipo de plantas requieren de un proceso de adaptación al nuevo medio al cual se enfrentan, período de tiempo durante el que resultan más susceptibles al estrés ambiental para tener un continuo crecimiento y desarrollo (Morales et al., 2009). Abreu et al. (2007), menciona que las plantas cultivadas in vitro, alteran su morfología, anatomía y fisiología como resultado del ambiente in vitro, por lo que durante la aclimatización presentan incapacidad para controlar varios procesos, entre los que destaca la pérdida de agua, por lo que su tasa de fotosíntesis es reducida, por lo que una respuesta específica de las plantas es deshacerse de las partes no esenciales y recuperar los nutrimentos presentes en esas partes, de las que se deshace para órganos esenciales para ellas.
Crecimiento al final de la etapa de adaptación
Las plantas con edad de 210 a 245 días mostraron que el factor dosis de fertilización no tuvo efectos significativos en el crecimiento de la altura de la hoja más larga (AHML), sin embargo influyó en el incremento en el diámetro de corona, número de hojas y contenido de clorofila (p≥0.05). Las plantas que se establecieron en el sustrato arena-turba y se fertirrigaron a 50% de concentración de nutrimentos de la solución Steiner mostraron mayores incrementos en altura de la hoja más larga y el número de hojas que las plantas que se establecieron en otros sustratos y que se les aplicaron otras dosis de fertilizantes, en lo que respecta al número de hojas, tuvieron mayor incremento con concentraciones al 75% de solución. Por otro lado, las plantas establecidas en el sustrato vermiculita y que se irrigaron con solo agua mostraron mayores incrementos en diámetro de corona. Estos resultados coinciden con los reportados por Enríquez et al. (2005), que mencionan que durante la aclimatación de plantas de Dendranthema grandiglora micropropagadas y que se establecieron en un sustrato con alto contenido de materia orgánica no requirieron que se le aplicara solución mineral para mostrar crecimiento, mientras que las plantas fertirrigadas a 50% tuvieron mayores incrementos de clorofila en las hojas (Cuadro 3). Esto significa que, mientras más nutrimentos tenga la hoja, tendrá mayor concentración, pero sin exceso de nutrientes por parte del sustrato como lo mencionan Enríquez et al. (2005).
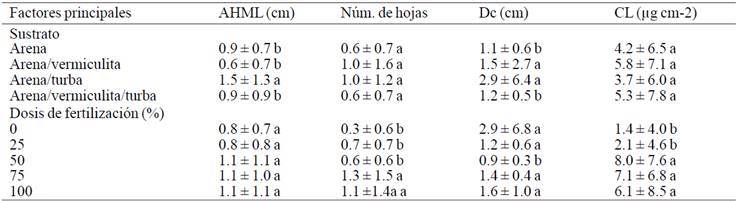
AHML= altura de la hoja más larga. Medias con letras iguales no son estadísticamente diferentes (Tukey, 0.05).
Cuadro 3 Incremento en las características de plantas durante los 210 a 245 días de aclimatación en función de niveles de factores principales.
Las plantas establecidas en el sustrato turba mostraron mayores incrementos en altura de la hoja más larga y diámetro de corona, esto se debe a que la turba posee características que se acercan al de un sustrato ideal: capacidad de aireación, 10 a 20%; retención de agua, 55 a 70%; granulometría de 0.25 a 2.25 mm; densidad aparente <0.4 g cm-3; agua fácilmente disponible de 48% y espacio poroso total de 93% (Urresatarazu, 2000, Iskander, 2002). Mientras que las plantas establecidas en el sustrato vermiculita, mostraron que el número de hojas irrigadas con 75% de solución Steiner y el contenido de clorofila irrigadas con 50% tuvieron mayores incrementos, por lo tanto ni el sustrato tenía una alta concentración de nutrientes ni la dosis de solución fue muy alta. Lo que puede ser atribuido a las características de la vermiculita, ya que tiene una alta capacidad de intercambio catiónico que facilita la movilidad y absorción de los iones al mantenerlos en formas químicas disponibles.
En el lapso de 210 a 245 días posteriores al trasplante, las plantas ya no mostraron la senescencia de las hojas como ocurrió durante el lapso entre los 40 a los 60 días, debido a que a esta edad ya poseían hojas nuevas que habían desarrollado en el ambiente ex vitro (Martínez et al., 2005). Por lo tanto, también incrementó el diámetro de corona, la altura de la hoja mayor y por consiguiente el contenido de clorofila fue más constante. González et al. (2007), trabajaron con Agave fourcroydes y reportan que a los 42 días que duró la aclimatación, las hojas ya eran consideradas funcionales, con estomas normales y ceras en su cubierta. Estos resultados coinciden con los encontrados en este estudio, ya que la aclimatación de Agave americana tuvo una duración de 49 días, por lo tanto, en los días posteriores, las plantas ya eran consideradas funcionales.
Todos los resultados indican que los tratamientos probados incrementaron la altura de la hoja mayor, el número de hojas, diámetro de corona y contenido de clorofila, no siendo el mismo tratamiento para cada una de ellas con mayor incremento. De acuerdo con los resultados de este estudio y a las consideraciones de otros autores, es evidente que las necesidades de las plantas son diferentes, dependiendo del ambiente en el cual se encuentran, por lo que un cambio de ambiente tendrá como consecuencia, adaptaciones en diferente escala dependiendo de la velocidad y la magnitud del cambio. Lo cual se observa con cualquier especie cuando se establece su cultivo in vitro, y al contrario cuando se debe aclimatizar nuevamente a las condiciones ex vitro, sin embargo los procesos evolutivos les dan esa capacidad, a través de una “memoria” a largo plazo, que la especie conserva y le permite desarrollar las características más adecuadas para sobrevivir de acuerdo con en el ambiente en el que se encuentre, y este proceso puede revertirlo y adecuarlo cuantas veces sea necesario.
Además, los tratamientos que se probaron (Cuadro 4) mostraron que en las últimas cinco semanas que fueron de 210 a 245 días después del trasplante a ex vitro, el tratamiento que mostró el mayor incremento tomando en cuenta todas las variables fue la combinación de arena-vermiculita-turba con 50% de dosis de fertilización.
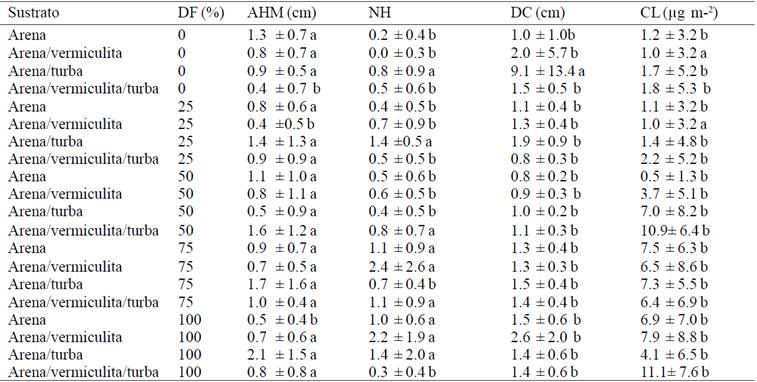
AHM= altura de la hoja mayor; NH= número de hojas; DC= diámetro de corona; CLOR= clorofila. La media se acompaña de la desviación estándar. Medias con letras iguales no son estadísticamente diferentes (Tukey, 0.05).
Cuadro 4 Medias de los incrementos por tratamiento de las últimas cinco semanas de aclimatación de Agave americana var. Oaxacensis L.
Comparando ambos períodos, se observó que en las primeras cinco semanas las plantas establecidas en el sustrato arena tuvieron mayor incremento irrigadas con agua a diferencia de las plantas que se irrigaron con alguna dosis; mientras que en las últimas cinco semanas (entre 210 y 245 días), las plantas que se establecieron en el sustrato turba irrigadas con 50% de solución mineral tuvieron mayor incremento. Esto puede deberse a que las plantas, durante las primeras semanas no necesitaron de un riego tan suplementado, y que con solo agua es más que suficiente para sobrevivir al medio ex vitro, ya que en ese lapso realizan sus funciones a expensas de las reservas adquiridas en condiciones in vitro. Es importante resaltar, que una vez lograda la adaptación y capacidad para desarrollar procesos fotosintéticos, la exposición a mayor luz como en el vivero es un factor favorable para incrementar las tasas de crecimiento y desarrollo de las plantas, por lo mismo la etapa después de la aclimatación las plantas ya necesitaron de un riego más suplementado, debido a que ya no tenían reservas en toda la planta.
Conclusiones
La etapa de aclimatación se puede concluir a las siete semanas cuando las plantas de Agave americana han estabilizado sus procesos de crecimiento y desarrollo.
Las plantas micropropagadas presentan sustitución de hojas entre los 35 y 70 días de aclimatación.
Las plantas establecidas en el sustrato arena-turba mostraron mayores incrementos de crecimiento sin necesidad de aplicar alguna dosis de solución.
La presencia de materia orgánica en el sustrato favorece el proceso de aclimatización de plantas de Agave americana var. Oaxacensis L.











 texto em
texto em 


