Introducción
La marchitez causada por Phytophthora capsici (PC) es la principal enfermedad que ataca al cultivo de chile (Capsicum annuum L.). El nivel de daño de esta enfermedad en México es muy elevado, el rendimiento puede bajar entre 25 y 80% (García-Rodríguez et al., 2010). Para el control de esta enfermedad se han desarrollado diferentes estrategias basadas en la aplicación de productos químicos, que sin embargo no logran resultados satisfactorios sobre el fitopatógeno además de que estos generan resistencia (Pérez-Moreno et al., 2003). En los últimos años ha surgido un mayor interés por la búsqueda de alternativas de control que sean ecológicas y sostenibles. La más común es el control biológico, el cual consiste en la aplicación de enemigos naturales, principalmente microorganismos antagonistas contra agentes fitopatógenos. Entre los más estudiados están: Trichoderma harzianum (Ezziyyani et al., 2004), Bacillus subtilis (Jong-Hui y Sang-Dal, 2010), y algunas cepas de hongos micorrízicos arbusculares (Hu-zhe et al., 2005).
Los hongos micorrízicos arbusculares (HMA) ofrecen un efecto como bioprotectores contra enfermedades de plantas (Harrier y Watson, 2004) mediante la mejora en el estado nutricional, lo que permite a la planta tener mayor tolerancia a diferentes factores de estrés biótico y abiótico. Además, estos hongos son capaces de competir con fitopatógenos por espacio y nutrientes dentro de la raíz y la micorrizósfera (Trotta et al., 1996). También, la micorrización puede cambiar los patrones de exudación de las raíces permitiendo el establecimiento de otros microorganismos antagónicos a fitopatógenos como es el caso de bacterias promotoras del crecimiento vegetal. De este modo se genera una barrera de bioprotección para la planta, además la red de hifas extrarradicales de los HMA sirven como una compensación estructural funcional en raíces de plantas enfermas, reduciendo de este modo la severidad de la enfermedad (Azcón-Aguilar y Barea, 1996). Los HMA también pueden inducir resistencia sistémica (RSI) en las plantas al encender su sistema de alerta al momento de colonizar la raíz y activar rutas metabólicas donde están involucradas fitohormonas como el ácido jasmónico y el etileno que conllevan a la síntesis de sustancias tóxicas para los fitopatógenos, como fitoalexinas y proteínas relacionadas con la patogénesis (Madriz, 2002).
Pozo et al. (2002) demostraron que, la micorrización en plantas de tomate con Rhizophagus intraradices y Glomus mosseae redujo los síntomas de la enfermedad causada por PC mediante la inducción de resistencia local y sistémica. Aunado a la RSI, la simbiosis micorrízica estimula una respuesta sensitiva de preacondicionamiento en la planta ante la presencia de un agente fitopatógeno, lo que la hace reaccionar rápidamente aumentando sus niveles de defensa y dificultando su establecimiento. Este mecanismo es conocido como potenciador o “priming” (Jung et al., 2012). Hu-zhe et al. (2005) mostraron que la pre-inoculación de R. intraradices en plantas de pimiento (Capsicum annuum) infectadas con PC incrementó la actividad de enzimas relacionadas con la lignificación, lo que se reflejó en una reducción de la mortalidad de la raíz. Con base en lo anterior el objetivo de este trabajo fue, evaluar el efecto de diferentes consorcios de HMA en la promoción del crecimiento y bioprotección de plantas de chile serrano y poblano (Capsicum annuum) contra Phytophthora capsici en condiciones de invernadero.
Materiales y métodos
El presente trabajo se desarrolló conjuntamente entre el Instituto de Investigaciones Agropecuarias y Forestales (IIAF), de la Universidad Michoacana de San Nicolás de Hidalgo (UMSNH) y, el laboratorio de Biotecnología Vegetal del Centro de Investigación y Asistencia en Tecnología y Diseño del Estado de Jalisco (CIATEJ). El experimento de invernadero, se estableció en el IIAF (19° 42’ longitud norte, 1 012° 11’ latitud oeste, 1 941 msnm) en el municipio de Tarímbaro, Michoacán, México entre los meses de mayo a agosto de 2014.
Material microbiológico
Cepa de Phytophthora capsici (PC): se empleó la cepa CH11 proporcionada por el Laboratorio de Patología Vegetal del IIAF-UMSNH. Esta cepa fue aislada de plantas enfermas por marchitez de un cultivo de chile en el estado de Michoacán, México. La capacidad infectiva de la cepa CH11 se reactivó previamente en plantas de chile serrano, colocando discos de micelio en el sistema radical de las plantas provocando la infección y desarrollo de lesiones necróticas, de donde se reaisló y purificó en medio de cultivo agar papa dextrosa (PDA).
Inóculos de HMA: se utilizaron siete consorcios micorrízicos provenientes de suelos con plantaciones de Agave cupreata del Estado de Michoacán, a los cuales se les dio una nomenclatura de acuerdo al sitio del cual fueron extraídos: El Huizachal (EH), Las Campesinas (LC), Rancho Carlos Rojas (RCR), Paso Ancho (PA), El limón (EL), Cerro del Metate (CM), Barranca de las Nueces (BN). Los inóculos previamente fueron propagados durante 12 meses en macetas trampa en invernadero. Los consorcios estaban constituidos por diferentes especies de HMA, encontrándose un total de 40 especies en 13 géneros, 9 familias y 3 órdenes (Rincón-Enríquez et al., 2012; Trinidad-Cruz, 2014).
Material vegetal
Variedades de chile: las variedades de chile utilizadas en este trabajo fueron: chile serrano (cultivar Tampiqueña) y chile poblano (cultivar San Luis). Las semillas se sembraron en charolas de aluminio con 100 cavidades que contenían arena de rio esterilizada (120 °C durante tres h, tres días consecutivos). Las plantas se trasplantaron cuando tenían cuatro hojas verdaderas, aproximadamente a los 35 días después de la siembra.
Establecimiento del experimento
Sustrato e inoculación de HMA: el sustrato que contenían las macetas consistió de una mezcla de suelo franco- arcilloso con arena en proporción 1:1 v/v esterilizado (120 °C durante tres h tres días consecutivos). Las plantas se trasplantaron a macetas con 500 g- de sustrato, en ese momento se inocularon en el sistema radical con 80 esporas de HMA contenidas en una cantidad determinada de arena como material de soporte. Para la extracción, determinación y estandarización del número de esporas de cada inóculo se utilizó la técnica de tamizado húmedo y decantación de Gerdemann y Nicholson (1963), en combinación con la técnica de flotación en azúcar en gradiente de sacarosa (Walker et al., 1982). Para el conteo se utilizó un microscopio estereoscópico (VELAB).
Inoculación de PC: A los 75 días después de la inoculación con los HMA (DDI), momento en el cual las plantas presentaban una colonización micorrízica mayor al 50%, se inocularon con una suspensión de zoosporas de Phytophthora capsici ajustada a una concentración de 1 x 104 zoosporas mL-1 (Ristaino, 1990), aplicando 1 mL por planta en 500 g-1 de sustrato (20 zoosporas g-1 de sustrato).
Variables de respuesta
Variables de crecimiento: para determinar el efecto de la micorrización sobre el crecimiento de las plantas de chile a los 56 DDI, se midió la altura de planta (AP) partiendo desde la base del tallo hasta el ápice de la última hoja (regla graduada), el diámetro del tallo (DT) a ras del suelo (vernier digital), y el número de hojas (NH). A los 95 DDI se dio por terminado el experimento y se procedió a registrar la biomasa fresca total (raíz, tallo, hojas y fruto) con una balanza analítica (Mettler Toledo AT200).
Variables de micorrización: a los 56 DDI se obtuvieron muestras de sustrato y raíces de cada tratamiento, para cuantificar la producción de esporas de HMA y la colonización micorrízica de la raíz. La evaluación del número de esporas, se realizó mediante la técnica de tamizado húmedo y decantación (Gerdemann y Nicholson, 1963) en combinación con la técnica de flotación en azúcar en gradiente de sacarosa (Walker et al., 1982). Para el conteo se utilizó un microscopio estereoscópico (VELAB). La colonización micorrízica se determinó mediante la técnica descrita por Phillips y Hayman (1970) utilizando azul de tripano y para determinar el porcentaje de colonización se utilizó el método descrito por McGonigle et al. (1990).
Severidad de la enfermedad: a los 20 días de la inoculación de PC (95 DDI), se dio por terminado el experimento y se determinó el nivel de daño en la planta mediante el registro de la sintomatología de la enfermedad de acuerdo a la escala de virulencia de la marchitez en plantas de chile descrita por Quinto-Álvarez (2014). Esta escala contempla valores de cero a seis: 0= planta sana; 1 = Planta con hojas parcialmente colapsadas; 2= planta con hojas colapsadas y con algunas desprendidas, tallo ligeramente inclinado; 3= planta con hojas colapsadas y cloróticas, con algunas desprendidas tallo ligeramente inclinado; 4= plantas con hojas colapsadas, la mayor parte de ellas desprendidas, tallos desplomados y con necrosis en la base; 5= plantas con hojas totalmente colapsadas, casi todas desprendidas, tallos desplomados y con presencia de necrosis desde la base hasta la parte media del tallo; 6= plantas con hojas totalmente colapsadas, la mayor parte desprendidas, tallos desplomados y con presencia de necrosis en más de 50% del tallo.
Diseño experimental y análisis estadístico
Se realizaron dos experimentos (uno por cada variedad de chile) bajo un diseño experimental de bloques completos al azar con cuatro repeticiones. En cada experimento se evaluaron nueve tratamientos correspondientes a siete consorcios de HMA nativos de rizósfera de Agave, un control positivo que consistió de un inóculo de HMA comercial elaborado a base de Rhizophagus intraradices y un control negativo sin micorrización (S/HMA). Las unidades experimentales (UE) consistieron de una maceta con una planta de chile con su respectivo tratamiento. A los datos obtenidos de las variables de crecimiento y micorrización, se les aplicó un análisis de varianza y para determinar diferencias estadísticas entre tratamientos se realizó una prueba de comparación de medias de Tukey (p≤ 0.05). Para la variable biomasa fresca aérea, los datos fueron transformados con la función exponencial para cumplir con la normalidad y homocedasticidad de varianzas. Para la escala de virulencia de la enfermedad, se realizó un análisis no paramétrico con la prueba de Kruskal-Wallis y un intervalo de confianza para la mediana con la prueba Dunn (p≤ 0.05). Se calcularon coeficientes de correlación de Pearson (p≤ 0.05) entre colonización micorrízica con número de esporas de HMA y biomasa fresca total con el nivel de virulencia de la enfermedad. Los análisis estadísticos se hicieron con el programa StatGraphics Centurion (Statgraphics, 2005).
Resultados y discusión
Los HMA como promotores del crecimiento vegetal en chile
El análisis de varianza mostró diferencias significativas (p≤ 0.05) para todas las variables de crecimiento en chile serrano (Cuadro 1). En AP (p= 0.0206) el inóculo CM mostró los mayores valores con 23.0 cm; en DT (p= 0.012) con 4.05 mm y NH (p= 0.0003) con 33.5 hojas. En todas éstas variables CM resultó ser estadísticamente diferente del control sin HMA donde se registraron los menores valores. Para chile poblano, no se encontraron diferencias significativas en DT (p= 0.71) y NH (p= 0.63), solo para AP, donde el inóculo LC obtuvo 18.03 cm. Estos resultados concuerdan con los reportados por Alonso-Contreras et al. (2013), donde distintos consorcios micorrízicos aislados de la rizósfera de manzano (Malus domestica B.) tuvieron un efecto positivo al promover el diámetro del tallo y área foliar en plantas de C. annuum.
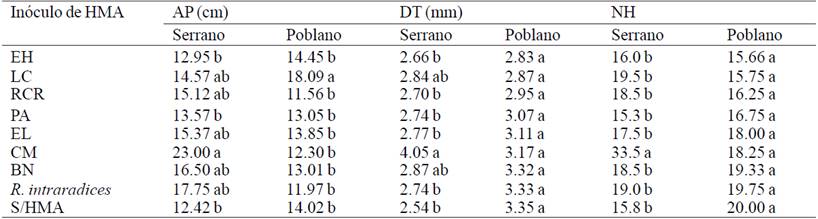
Altura de planta (AP); diámetro del tallo (DT); número de hojas (NH). El Huizachal (EH); as Campesinas (LC); Rancho Carlos Rojas (RCR); Paso Ancho (PA); El Limón (EL); Cerro del Metate (CM); Barranca de las Nueces (BN); sin HMA (S/HMA). Letras distintas en columnas indican diferencias significativas según Tukey (p≤ 0.05).
Cuadro 1 Crecimiento de chile por efecto de distintos inóculos de hongos micorrízicos arbusculares (HMA) bajo condiciones de invernadero a los 56 días del trasplante.
Díaz-Franco et al. (2013), en un experimento en pimiento (C. annuum) bajo condiciones de invernadero encontraron que la micorrización con Rhizophagus intraradices promovió el crecimiento al incrementar el peso de frutos en un 30% respecto a plantas no micorrizadas. En otro estudio, al evaluar inóculos micorrízicos en plantas de tomate (Lycopersicum esculentum M.) se reportó un incremento significativo en altura y biomasa seca respecto a plantas no micorrizadas (Fernández et al., 2006).
Lo anterior refleja que los HMA son un recurso biológico de importancia en la fertilización orgánica-biológica de plantas de interés económico, que inclusive podrían ser una alternativa a otros tipos de manejo como la fertilización química (Armenta-Bojórquez et al., 2010).
Para las variables de micorrización (Cuadro 2) se encontraron diferencias estadísticas en la colonización micorrízica (p= 0.00) y densidad de esporas (p= 0.00) en ambas variedades de chile a los 56 días después de la inoculación (DDI) con los HMA. No se observó colonización micorrízica en el control negativo, los inóculos que registraron mayor micorrización de las raíces en chile serrano fueron BN y PA con 84.93% y 83.43%, Rhizophagus intraradices mostró solo un 33.6% de colonización, el resto de inóculos fueron estadísticamente iguales, el inóculo CM que promovió mayor crecimiento en chile serrano sólo registró un 44.96% de colonización micorrízica, por lo tanto no es un inóculo muy infectivo pero sí efectivo en la promoción de crecimiento vegetal. Los conceptos de infectividad, definida como la capacidad para colonizar la raíz y efectividad, capacidad para promover el crecimiento vegetal, no están relacionados y se sabe que existen inóculos de HMA que colonizan la raíz en menor porcentaje (15-40%) y tienen un excelente efecto en la nutrición y crecimiento vegetal (Tapia-Goné et al., 2010).
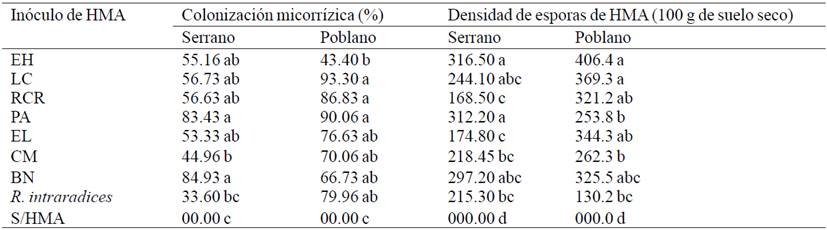
El Huizachal (EH); Las Campesinas (LC); Rancho Carlos Rojas (RCR); Paso Ancho (PA); El Limón (EL); Cerro del Metate (CM); Barranca de las Nueces (BN) Sin HMA (S/HMA). Letras distintas en columnas indican diferencias significativas según Tukey (p≤ 0.05).
Cuadro 2 Micorrización y densidad de esporas de hongos micorrízicos arbusculares (HMA) en plantas de chile bajo condiciones de invernadero a los 56 días después del trasplante.
El alto porcentaje de colonización micorrízica encontrado en el presente estudio es similar a lo mostrado por Lucas-Santoyo (2011) quien reportó una colonización de hasta 92.92% en plantas de chile guajillo (C. annuum L.) inoculadas con diferentes consorcios micorrízicos a los 150 días después del trasplante; igualmente Tanwar et al. (2013) reportan un alto porcentaje de colonización en la raíz (93.98%) en pimiento, sin embargo ésta fue aún mayor en presencia de Pseudomonas fluorescens (97.62%) lo que se reflejó en un incremento del crecimiento. Los elevados porcentajes de colonización encontrados en el presente estudio sugieren que estas variedades de chile son altamente micotróficas y no autorregulan el grado de colonización en sus raíces.
Respecto a la densidad de esporas de HMA el análisis de varianza mostró diferencias estadísticas significativas (p≤ 0.05). En chile serrano todos los tratamientos donde se inocularon HMA registraron valores estadísticamente similares entre ellos sin embargo fueron superiores al control negativo. En chile poblano el control con R. intraradices mostró la menor densidad de esporas (130 en 100 g de suelo seco), la mayor densidad de esporas se registró en el inóculo EH con 406.4 en 100 g de suelo seco que fue estadísticamente igual a LC, PA y BN. Se encontraron coeficientes de correlación de Pearson significativos entre la colonización micorrízica y el número de esporas en chile poblano (r= 0.5469) y serrano (r= 0.7475), esto concuerda con lo reportado en la literatura, donde se indica que altas densidades de esporas propician una mayor colonización micorrízica (Vázquez et al., 2010). Sin embargo, ambas variables no siempre son necesariamente dependientes y están en función de la especie o variedad vegetal, así como de las especies de HMA utilizadas (Mendoza et al., 2002).
La densidad de esporas es una variable que indica la abundancia de propágulos de HMA que podría competir contra fitopatógenos, por espacio y nutrientes otorgando directamente bioprotección para la planta (Azcón-Aguilar y Barea, 1996). En este caso, CM fue el mejor inóculo en la disminución de la severidad de la enfermedad causada por PC (Figuras 1 y 2) aunque no produjo la mayor densidad de esporas. Esto podría sugerir que, las plantas más enfermas al estar en una situación de mayor estrés biótico, podrían haber inducido una mayor esporulación del HMA. Este efecto está relacionado con los mecanismos de supervivencia de los HMA, los cuales pueden ser capaces de incrementar la cantidad esporas al estar amenazados los suministros de carbono por la planta. Algunos autores sugieren que algunas especies de Glomus son estrategas “r”; es decir, aumentan su reproducción con un mayor número de esporas ante la presencia de un factor limitante a su supervivencia (Ijdo et al., 2010).
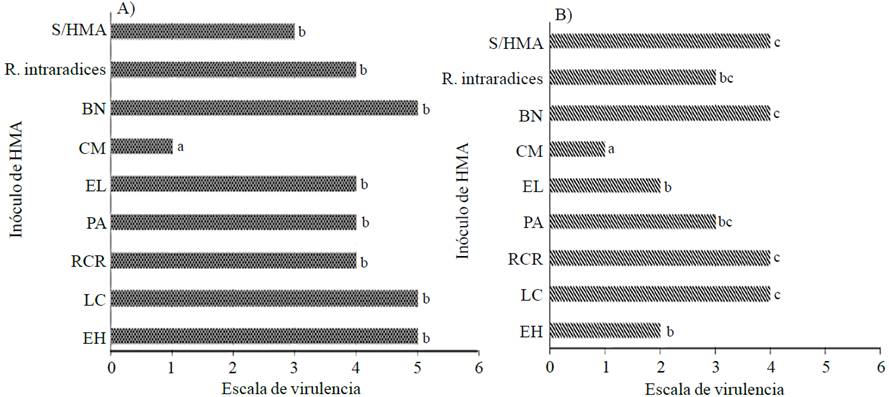
Figura 1 Severidad de la marchitez causada por PC en plantas de chile serrano (A) y poblano (B) inoculadas con HMA bajo condiciones de invernadero a los 95 días después del trasplante. El Huizachal (EH); Las Campesinas (LC); Rancho Carlos Rojas (RCR); Paso Ancho (PA); El Limón (EL); Cerro del Metate (CM); Barranca de las Nueces (BN); sin HMA (S/HMA). Letras distintas indican diferencias estadísticamente significativas de acuerdo a la prueba de Dunn (p≤0.05).

Figura 2 Aspecto general del grado de severidad de la marchitez causada por Phytophthora capsici en plantas de chile serrano (1) y poblano (2) a los 95 DDI bajo condiciones de invernadero. Cerro del Metate (nivel 1: a y d); sin HMA (nivel 3: b; nivel 4= f); El Huizachal (nivel 5= c); Paso Ancho (nivel 3= e).
Esto coincide con lo reportado por Schalamuk et al. (2014), donde en plantas de trigo (Triticum sp.) que se encontraban severamente afectadas por septoriosis causada por Mycosphaerella graminícola, la densidad de esporas fue selectivamente mayor que en plantas con menor daño de la enfermedad.
Efecto bioprotector de los HMA contra Phytophthora capsici L. (PC) en plantas de chile
Después de la inoculación de PC, todas las plantas presentaron síntomas de la enfermedad, sin embargo el grado de severidad dependió del consorcio micorrízico inoculado. El análisis estadístico no paramétrico Kruskal-Wallis mostró diferencias significativas en chile serrano (estadístico= 15.6042, valor- p= 0.0484086) y poblano (estadístico= 15.6959, valor- p= 0.0469459) para la escala de virulencia. En ambas variedades de chile todos los inóculos de HMA a excepción de CM no ejercieron efecto bioprotector contra la marchitez, encontrándose las plantas con igual nivel de enfermedad que el control negativo (Figura 1).
De acuerdo a la escala de virulencia, las plantas inoculadas con CM se encontraron con un índice de severidad de uno, lo cual indica plantas con hojas parcialmente colapsadas con el tallo erguido (Figura 2). Esto muestra que el consorcio micorrízico CM, es capaz de bioproteger las plantas de chile contra Phytophthora capsici dada la reducción de la severidad de la marchitez. Esto concuerda con lo reportado por Ozgonen y Erkilic (2007) quienes al inocular esporas de Glomus etunicatum, Gl. fasciculatum y Gigaspora margarita en plantas de chile, encontraron una disminución de la enfermedad provocada por PC de hasta un 91.7% en condiciones de invernadero y 57.2% en condiciones de campo. Por otro lado, las plantas inoculadas con CM presentaron la mayor biomasa fresca radical, lo cual pudo conferirles una mayor área de exploración para nutrientes y agua, que pudo favorecer su estado nutricional, desarrollo y protección contra Phytophthora capsici. Esto concuerda con lo reportado por Gómez-Dorantes et al. (2008), quienes encontraron un mayor tamaño de la raíz en plantas de jitomate inoculadas con HMA, las cuales mostraron menor daño por Phytophthora capsici en comparación con plantas no micorrizadas las cuales mostraron una significativa pérdida de biomasa radical (p≤ 0.05).
La síntesis de fitoalexinas está documentada como una respuesta de la planta al ataque de fitopatógenos donde se encuentran implicados el ácido jasmónico y el etileno que propician resistencia sistémica que puede ser inducida por HMA (Carreón-Abud et al., 2008). Por su parte Gómez-Dorantes et al. (2008) atribuyeron la reducción de la susceptibilidad a PC en jitomate a la mejora del estado nutricional de las plantas y a la competencia por compuestos de carbono dentro de la raíz. Considerando estos resultados es posible que el efecto bioprotector encontrado en este estudio por parte de los HMA, reflejado en una menor severidad de la enfermedad, se deba entre otros aspectos a la inducción de señalización bioquímica para dar respuestas de defensa propiciadas por la actividad de fitohormonas como los ácidos salicílico y jasmónico (Kapoor, 2008).
Este efecto bioprotector ha sido reportado en plantas de tomate donde la inoculación con G. mosseae indujo respuesta sistémica contra Phytophthora parasitica en un sistema de raíz dividida, donde la resistencia fue asociada a la acumulación de compuestos fenólicos, engrosamiento de la pared celular y proteínas relacionadas con la patogénesis (PR-1) (Cordier et al., 1998). La respuesta sistémica en tomate frente a P. parasitica también fue reportada por Pozo et al. (1999) donde se encontraron isoformas de enzimas hidrolíticas posiblemente relacionadas con esta respuesta. La protección contra PC mediante la síntesis de proteínas PR con actividad peroxidasa se ha reportado en plantas de chile inoculadas con Trichoderma harzianum, donde la colonización por el antagonista induce resistencia sistémica que puede desencadenar el mecanismo de defensa hipersensible (Ezziyyani et al., 2005).
Respecto a la biomasa fresca aérea y radical de plantas infectadas con PC a los 95 días después del trasplante se encontraron diferencias significativas (p≤ 0.05) entre tratamientos (Cuadro 3). En chile serrano el inóculo CM promovió la mayor biomasa fresca aérea con 15.4 g siendo estadísticamente superior al control negativo (S/HMA) que registró 8.26 g. Para chile poblano la tendencia fue igual, las plantas inoculadas con CM mostraron la biomasa fresca aérea de 7.95 g y diferente estadísticamente a tratamientos sin HMA (2.83 g). En la biomasa fresca radical los diferentes consorcios de HMA incluyendo a CM, no lograron promover el crecimiento radical puesto que en ambas variedades de chile fueron estadísticamente iguales al control negativo sin HMA.
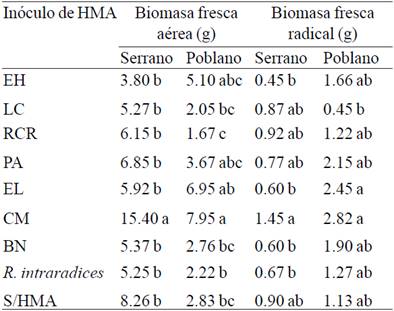
El Huizachal (EH); Las Campesinas (LC); Rancho Carlos Rojas (RCR); Paso Ancho (PA); El Limón (EL); Cerro del Metate (CM); Barranca de las Nueces (BN); sin HMA (S/HMA). Letras distintas en columnas indican diferencias significativas según Tukey (p≤ 0.05).
Cuadro 3 Biomasa fresca aérea y radical en plantas de chile serrano y poblano inoculadas con diferentes hongos micorrízicos arbusculares (HMA) e infectadas con Phytophthora capsici a los 95 días después del trasplante en condiciones de invernadero.
Sin embargo, el incremento de la biomasa fresca aérea por parte del consorcio CM en las plantas de chile serrano y poblano se reflejó en el menor nivel de severidad de la enfermedad que presentaron las plantas de este tratamiento (Figura 2), lo cual se corroboró al hacer un análisis de correlación entre biomasa fresca total y el nivel de severidad de la marchitez en las plantas de ambas variedades donde se encontró una correlación negativa significativa en ambos casos (-0.47 y -0.37). Finalmente, es importante el estudio de la efectividad biológica en la promoción del crecimiento y biocontrol de fitopatógenos por parte de consorcios de HMA aislados de suelos con A. cupreata, debido a que permite conocer las especies asociadas y su potencial aplicación biotecnológica en ésta y otras especies vegetales de importancia económica como el chile.
Conclusiones
La micorrización en plantas de chile serrano y poblano favoreció el incremento en el crecimiento vegetal reflejado en una mayor altura de planta, diámetro del tallo, número de hojas y biomasa fresca aérea. Además la micorrización mostró un efecto bioprotector frente a Phytophthora capsici al reducir la severidad de la marchitez en comparación con plantas no micorrizadas. En ambas variedades de chile, el consorcio micorrízico CM disminuyó la severidad de Phytophthora capsici L. causante de la marchitez al ser inoculado al momento del trasplante. Lo cual, evidencia el potencial de este consorcio en el control del fitopatógeno; sin embargo, es necesario realizar nuevos experimentos en invernadero para validar los resultados obtenidos para después poder utilizar el consorcio en condiciones de campo y validar el efecto bioprotector.











 texto en
texto en 


