Introducción
Actualmente es importante continuar investigando sobre estrategias y técnicas sustentables para la producción de almácigos de hortalizas que permitan incrementar su calidad, vigor y adaptabilidad, es decir, plántulas con raíces bien desarrolladas y de rápida adaptación a las condiciones de estrés causadas por el trasplante, pero al mismo tiempo lograr reducir el uso excesivo de agroquímicos.
Una biotecnología en continuo desarrollo involucra el uso de microorganismos identificados como bacterias promotoras del crecimiento vegetal (BPCV) o PGPR por sus siglas en inglés (Vessey, 2003), entre las cuales el género Azospirillum es de los más estudiados (Hernández et al., 2001) y se clasifican como microorganismos diazotróficos, asociados de forma endofítica o rizosférica a cereales y pastos de diferentes regiones del mundo. Se tienen descritas cinco especies (De-Bashan et al., 2007) y se han utilizado diferentes cepas como biofertilizantes comerciales en varios países, incluido México, debido a su capacidad para estimular el crecimiento de las plantas y aumentar el rendimiento de los cultivos en variados ambientes y condiciones edáficas (Di Barbaro et al., 2005), lo cual es reportado en numerosos estudios sobre su ecología, fisiología y genética (Tilak et al., 2005), por lo tanto, constituyen una alternativa nutricional para los cultivos, favoreciendo el equilibrio de los agroecosistemas (Reganold et al., 1990) al restaurar las propiedades físicas, químicas y biológicas del suelo (Newman y Reynolds, 2005), contribuyendo a la producción sostenible de alimentos (Abiven y Recous, 2007).
Por otra parte, también se ha investigado en diferentes cultivos el efecto de la miel de abeja sobre algunas variables del crecimiento y desarrollo, así por ejemplo, en tomate, se ha reportado un aumento del vigor de las plantas, reflejado en el incremento de altura, diámetro de tallo, área foliar y estimulación de la formación del xilema secundario en menor tiempo (Villegas-Torres et al., 2001), en el cultivo de mango redujo la incidencia y severidad de la malformación floral conocida como “escoba de bruja” (Donald et al., 2002) y en plantas ornamentales como Lilium (Betancourt-Olvera et al., 2005) y Tulipán (Rodríguez-Mendoza et al., 2011) favoreció la altura, diámetro de tallo, vida de anaquel y resistencia al acame, los cuales son parámetros importantes que determinan la calidad de la flor para corte.
Con base en lo anterior, el objetivo de la investigación fue evaluar la aspersión foliar de miel de abeja y la inoculación de Azospirillum (7A y AMRp10) en el crecimiento de plántulas de brócoli (Brassica oleracea var. Itálica) cv. Legacy, cebolla (Allium cepa L.) cv. Victoria, lechuga (Lactuca sativa L.) cv. Salinas y tomate (Solanum lycopersicum L.) cv. Río Grande.
Materiales y métodos
El estudio se realizó en un invernadero con dimensiones de 7.0 m de ancho por 18.0 m de largo tipo túnel de estructura metálica y cubierta de polietileno, ubicado en el Colegio de Postgraduados, Campus Montecillo, en Texcoco Estado de México. El material vegetal utilizado fue: brócoli (Brassica oloracea var. Itálica), cebolla (Allium cepa L.), lechuga (Lactuca sativa L.) y tomate (Solanum lycopersicum L.). Para el crecimiento de las plántulas se utilizaron charolas germinadoras de 200 cavidades y como sustrato una mezcla de peat moss y perlita a una relación en volumen de 3:2. En cada uno de los cultivos establecidos se evaluaron cuatro tratamientos: a) Inoculación con Azospirillum 7A (A.7A); b) Inoculación con Azospirillum AMRp10 (A.AMRp10); c) Aspersión foliar con miel de abeja 2% (AFMA); y d) tratamiento testigo, sin inoculación de una cepa y sin AFMA.
Las cepas bacterianas de Azospirillum, 7A (aislada del cultivo de maíz del estado de Puebla) y AMRp10 (aislada del rizoplano de maíz criollo, del Estado de Tlaxcala) fueron proporcionadas por el cepario del Centro de Investigaciones en Ciencias Microbiológicas de la Benemérita Universidad Autónoma de Puebla (BUAP). La suspensión bacteriana utilizada se preparó a partir de una colonia aislada en medio de cultivo líquido NFB sin agar (Day y Dobereiner, 1976), conteniendo 107 células mL-1 de inóculo empleado y determinado a partir de la escala de McFarland (McFarland, 1907). La inoculación se realizó después de emergidas las plántulas, agregando 0.1 mL de la suspensión bacteriana a la base del tallo.
La aspersión foliar con miel de abeja para el tratamiento al que se hace referencia se realizó con una miel comercial (Carlota®), cada siete días a partir de la emergencia de las plántulas, la miel diluida en agua se aplicó a una concentración 2% en relación peso: volumen (Rodríguez-Mendoza et al., 2011). Los almácigos fueron regados dos veces por día de la siguiente manera: después de la siembra, el riego fue con agua destilada de pH ajustado a 5.5 con ácido sulfúrico (H2SO4 ) 1N e hidróxido de sodio (NaOH) 1N; posterior a la emergencia de las plántulas y durante un período de 15 días, se irrigaron con la solución nutritiva propuesta por Steiner (Steiner, 1980) diluida 50%; finalmente y hasta concluir la etapa de almácigo, el riego se realizó con la solución Steiner a su concentración original.
Variables evaluadas
A los 30 días después de la siembra (DDS), en las plántulas brócoli, lechuga y jitomate se determinaron: el contenido de clorofila con el medidor portátil SPAD-502® de Minolta, considerando el promedio de tres lecturas por planta, de hojas situadas en la parte superior a una misma altura y posición (Rodríguez-Mendoza et al., 1998); la altura de plántula fue medida desde la parte basal hasta el meristemo apical; el área foliar se obtuvo con un integrador marca Li-Cor Modelo Li- 3000A® (Ruíz-Espinoza et al., 2007); el diámetro de tallo en las plántulas de brócoli y jitomate se midió con un vernier; el peso seco de plántula se determinó después de haber lavado las muestras vegetales con agua destilada y secadas en una estufa con circulación de aire forzado a 70 °C durante 72 h (Alcántar- González and Sandoval-Villa, 1999). La evaluación de las plántulas de cebolla se realizó a los 45 DDS, considerando las variables antes mencionadas y además se midió el diámetro de bulbo utilizando un vernier electrónico digital.
Análisis estadístico
La unidad experimental estuvo conformada por 50 plántulas, de las cuales 15 plántulas de cada repetición (cuatro en total), fueron consideradas para la medición de las variables de respuesta. Los tratamientos fueron distribuidos bajo un diseño completamente al azar. Para los análisis de varianza, comparación de medias (LSD, p= 0.05) y correlación entre las variables se utilizaron los procedimientos ANOVA y CORR del paquete computacional estadístico SAS (Statistical Analysis System) versión 8.0 (SAS, 1999).
Resultados y discusión
Crecimiento de las plántulas de brócoli (Brassica oleracea var. Itálica)
En las plántulas de brócoli, la aspersión foliar de miel de abeja (AFMA) tuvo un efecto significativo (p≤0.05) sobre la altura, área foliar y peso seco (Cuadro 1), variables que fueron correlacionadas positivamente (Figura 1a y 1b). La altura se incrementó 13% en comparación con el testigo y 16% con respecto a los tratamientos inoculados con Azospirillum. El área foliar aumentó 38% con respecto al Testigo y 54% en referencia a A.7A y A.AMRp10. En lo que respecta al peso seco de las plántulas, éste se incrementó 30% en referencia al testigo y 37% con respecto a A.7A y A.AMRp10.
Cuadro 1. Crecimiento de plántulas de brócoli (Brassica oleracea var. Itálica) a 30 días después de la siembra, asperjadas con miel de abeja 2% (AFMA) e inoculadas con las cepas de Azospirillum 7A (A.7A) y Azospirillum AMRp10 (A.AMRp10).
| Tratamiento | Altura (cm) | Diámetro de tallo (cm) | Unidades (SPAD) | Área foliar (cm 2 ) | Peso seco (g) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Testigo | 12.97 | b* | 0.27 | ab | 49.97 | ab | 24.73 | b | 0.27 | b |
| AFMA | 14.65 | a | 0.28 | ab | 47.34 | b | 34.2 | a | 0.35 | a |
| A.7A | 12.82 | b | 0.3 | a | 50.73 | a | 21.76 | b | 0.25 | b |
| A.AMRp10 | 12.33 | b | 0.27 | b | 48.29 | ab | 22.73 | b | 0.26 | b |
| CV (%) | 5.46 | 7.03 | 4.33 | 10.41 | 13.68 | |||||
| DMS | 1.11 | 0.03 | 3.28 | 4.14 | 0.06 | |||||
*Promedios con la misma letra por columna no son significativamente diferentes (LSD, p≤ 0.05). CV= Coeficiente de variación. DMS= Diferencia mínima significativa.
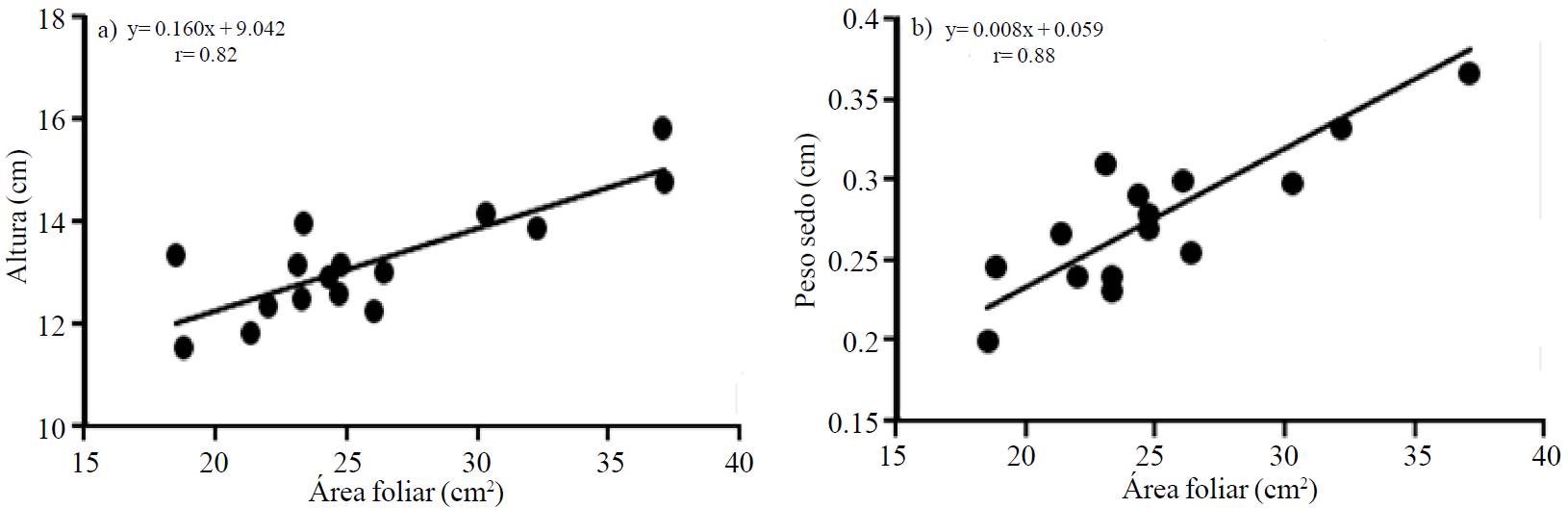
Figura 1. Correlación a 30 días después de la siembra con el promedio de los tratamientos evaluados entre: a) y= altura (cm) y x= área foliar (cm2) y b) y= peso seco (g) y x= área foliar (cm2), de plántulas de brócoli (Brassica oleracea var. Itálica).
Por otra parte, A.7A provocó un incremento de 7% en las unidades SPAD con respecto a la AFMA y también el diámetro de tallo aumentó 11% con respecto a la otra cepa evaluada (A.AMRp10). De manera general no hubo un efecto significativo sobre el crecimiento de las plántulas de brócoli, lo cual está acorde a lo reportado por Boddey et al. (1986), quienes obtuvieron resultados poco satisfactorios en cultivos evaluados con cepas homólogas de Azospirillum. Al respecto, Smith y Goodman (1999) indican que el genotipo de los organismos involucrados juega un papel importante en la conformación de la asociación entre microorganismos y plantas, determinando el resultado biológico de dicha asociación.
Crecimiento de las plántulas de cebolla (Allium cepa L.)
En las plántulas de cebolla la única variable con respuesta a los tratamientos evaluados fueron las unidades SPAD y el máximo valor se obtuvo con el testigo, que superó en 54% a A.7A y A.AMRp10 (Cuadro 2). Esta respuesta fue debida a la forma tubular de la hoja que dificulta la transmitancia de la luz (Westerveld et al., 2003), además, en esta etapa de desarrollo las hojas son muy angostas y la celda del medidor SPAD que tiene dimensiones de 2 x 3 mm (Schepers et al., 1998), probablemente no la cubrió en su totalidad, provocando medidas muy variables que se reflejaron con el coeficiente de variación más alto de los cultivos evaluados.
Cuadro 2. Crecimiento de plántulas de cebolla (Allium cepa L.) a 45 días después de la siembra, asperjadas con miel de abeja 2% (AFMA) e inoculadas con las cepas de Azospirillum 7A (A.7A) y Azospirillum AMRp10 (A.AMRp10).
| Tratamiento | Altura (cm) | Diámetro de tallo (cm) | Diámetro de bulbo (cm) | Unidades (SPAD) | Área foliar (cm 2 ) | Peso seco (g) | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Testigo | 19.88 | a* | 0.29 | a | 0.44 | a | 31.74 | a | 7.15 | a | 0.07 | a |
| AFMA | 21.92 | a | 0.3 | a | 0.44 | a | 24.79 | ab | 16.46 | a | 0.08 | a |
| A.7A | 22.63 | a | 0.31 | a | 0.46 | a | 23.08 | b | 9.28 | a | 0.11 | a |
| A.AMRp10 | 20.98 | a | 0.28 | a | 0.42 | a | 18.12 | b | 7.84 | a | 0.11 | a |
| CV (%) | 11.33 | 6.93 | 11.44 | 20.55 | 13.95 | 40.44 | ||||||
| DMS | 3.73 | 0.04 | 0.07 | 7.73 | 2.2 | 0.05 | ||||||
*Promedios con la misma letra por columna no son significativamente diferentes (LSD, p≤ 0.05). CV= Coeficiente de variación. DMS= diferencia mínima significativa.
En este experimento las plántulas de cebolla promediaron 21.35 cm de altura, 0.30 cm de diámetro de tallo, 0.44 cm de diámetro de bulbo, 10.18 cm2 de área foliar y 0.09 g de peso seco. Pulido et al. (2003), en almácigos del cv. Red Creole inoculados con Azospirillum brasilense, obtuvieron una altura de plántula de 6 a 18 cm y longitud de raíz de 8 a 10 cm, por otra parte, Veiga de Vincenzo y Tessarioli Neto (2003) reportan la altura de plántulas de cebolla de 18.2 cm a los 32 DDS en ambiente controlado y con suministro de N, indicando que la altura ideal para el trasplante es de 15 cm y el diámetro de bulbo de 0.37 cm, valores inferiores a los obtenidos en este experimento (21.35 cm y 0.44 cm, respectivamente); estos mismos autores también reportaron 0.13 g/planta de peso seco, valor ligeramente mayor al obtenido en este estudio (0.09 g/planta). Para este cultivo y de manera similar que en las plántulas de brócoli, los tratamientos inoculados con Azospirillum no tuvieron un efecto diferenciado sobre las variables del crecimiento.
Al respecto, Alexandre y Zhulin (2001) señalan que el éxito de la colonización de Azospirillum en las plantas, depende del proceso conocido como quimiotaxis, el cual consiste en la fuerte atracción entre las BPCV y las raíces de las plantas, a través de sus propios exudados radiculares como el malato, succinato y la fructosa. Díaz-Zorita y Fernández Canigia (2008), señalan que hay varios estudios mostrando los beneficios de la inoculación con Azospirillum sobre el crecimiento y producción de diferentes cultivos, pero su uso extensivo está limitado por la supuesta inconsistencia de los resultados obtenidos y la variabilidad de los mismos se han atribuido a la interacción con factores de manejo (fertilización, protección y estructura de cultivo) y de ambiente (tipo de suelo).
Crecimiento de las plántulas de lechuga (Lactuca sativa L.)
La altura y el área foliar de las plántulas de lechuga fueron afectadas positiva y significativamente (p≤ 0.05) por AFMA y con respecto a A.7A y A.AMRp10, superándolos en 18 y 78%, respectivamente (Cuadro 3). Chutichudet y Chutichudet (2009) para el cv. Grand Rapids reportan la altura de plántulas a los 32 DDS de 7.97 a 10.84 cm, valores similares al promedio registrado en este estudio (8.83 cm) por su parte Kleiber et al. (2013), reportaron que el efecto de organismos benéficos en las plántulas del cv. Clotilde se reflejó en 28.55 cm2 de área foliar a los 40 DDS, valor inferior a lo obtenido con el tratamiento AFMA de nuestro experimento (39.55 cm2). Según Betancourt- Olvera et al. (2005), la miel actúa como promotor del crecimiento vegetal por que contiene una elevada cantidad de carbohidratos, presencia de hormonas, vitaminas, minerales, aminoácidos, proteínas y otros constituyentes orgánicos.
Cuadro 3. Crecimiento de plántulas de lechuga (Lactuca sativa L.) a 30 días después de la siembra, asperjadas con miel de abeja 2% (AFMA) e inoculadas con las cepas de Azospirillum 7A (A.7A) y Azospirillum AMRp10 (A.AMRp10).
| Tratamiento | Altura (cm) | Unidades (SPAD) | Área foliar (cm 2 ) | Peso seco (g) | ||||
|---|---|---|---|---|---|---|---|---|
| Testigo | 8.98 | ab* | 32.47 | a | 29.85 | ab | 0.22 | a |
| AFMA | 9.51 | a | 32.05 | a | 39.55 | a | 0.15 | ab |
| A.7A | 8.74 | ab | 30.11 | a | 24.39 | b | 0.14 | ab |
| A.AMRp10 | 8.07 | b | 31.42 | a | 20.00 | b | 0.11 | b |
| CV (%) | 9.72 | 6.62 | 25.85 | 31.68 | ||||
| DMS | 1.32 | 3.21 | 11.33 | 0.07 | ||||
*Promedios con la misma letra por columna no son significativamente diferentes (LSD, p≤ 0.05). CV= Coeficiente de variación. DMS= diferencia mínima significativa.
Por otra parte, al igual que en los cultivos de brócoli y cebolla, los tratamientos inoculados con Azospirillum no tuvieron un efecto claro y significativo sobre las variables del crecimiento evaluadas, de hecho, el peso seco de la plántula obtenida con el Testigo fue significativamente mayor (50%) al obtenido con A.AMRp10. Esta respuesta frecuentemente se asocia a la ineficiencia de las bacterias para colonizar consistentemente la rizósfera de las plantas (Hatzinger y Alexander, 1994), lo cual debe ser una característica de las BPCV y condición indispensable para la selección de los inóculos microbianos utilizados como biofertilizantes (Lugtenberg et al., 2001). La colonización de la rizósfera por las bacterias es un proceso complejo originado por la combinación de diversos mecanismos que afectan aspectos de la nutrición mineral, el metabolismo del carbono y el desarrollo radicular de las plantas (Díaz-Vargas et al., 2001); entre estos mecanismos se encuentra la producción de compuestos promotores del crecimiento vegetal, los cuales inducen un incremento en el número y longitud de los pelos radicales (Bacilio-Jimenez et al., 2001). En las unidades SPAD no se tuvo efecto de los tratamientos y el promedio general fue 34.88, el cual es superior a lo reportado por Santos et al. (2010) para almácigos de lechuga a los 41 DDS utilizando diferentes sustratos orgánicos (16.3 a 21.5 unidades SPAD).
Crecimiento de las plántulas de tomate (Solanum Lycopersicum L.)
En las plántulas de tomate la altura y el área foliar fueron afectadas significativamente (p≤0.05) por los tratamientos (Cuadro 4). La altura se incrementó en 23% con AFMA y en referencia a A.AMRp10. Villegas-Rodríguez et al. (2001) reportaron para plántulas de tomate, cultivadas en hidroponía y con aspersión foliar de miel de abeja 2%, incrementos en su altura de más de 100% con relación a plantas irrigadas únicamente con la solución de Steiner al 50%. La altura de plántula obtenida en nuestro estudio con AFMA (22.23 cm) está acorde a Markovic et al. (1997) quienes señalan que para asegurar el éxito del trasplante en campo la plántula debe tener de 20 a 30 cm de altura.
Cuadro 4. Crecimiento de plántulas de tomate (Solanum lycopersicum L.) a 30 días después de la siembra, asperjadas con miel de abeja 2% (AFMA) e inoculadas con las cepas de Azospirillum 7A (A.7A) y Azospirillum AMRp10 (A.AMRp10).
| Tratamiento | Altura (cm) | Diámetro de tallo (cm) | Unidades (SPAD) | Área foliar (cm 2 ) | Peso seco (g) | |||||
|---|---|---|---|---|---|---|---|---|---|---|
| Testigo | 20.09 | ab* | 0.31 | a | 35.35 | a | 41.58 | ab | 0.39 | a |
| AFMA | 22.23 | a | 0.31 | a | 32.76 | a | 40.35 | ab | 0.47 | a |
| A.7ª | 20.37 | ab | 0.3 | a | 36.52 | a | 47.16 | a | 0.43 | a |
| A.AMRp10 | 18.11 | b | 0.29 | a | 34.89 | a | 30.93 | b | 0.37 | a |
| CV (%) | 11.02 | 5.24 | 7.1 | 18.95 | 20.54 | |||||
| DMS | 3.42 | 0.02 | 3.81 | 11.68 | 0.13 | |||||
*Promedios con la misma letra por columna no son significativamente diferentes (LSD, p≤ 0.05). CV= Coeficiente de variación. DMS= diferencia mínima significativa.
Por otra parte, Terry et al. (2001) no observaron efecto significativo de la inoculación con Azospirillum brasilense SP-7 sobre la altura de plántulas de tomate, reportando un promedio 20 cm, además, indican que en la etapa inicial del crecimiento de las plantas no existe un reconocimiento efectivo entre los microorganismos y las plantas inoculadas para expresar alguna señal de respuesta. La altura de los tratamientos inoculadas con las cepas de Azospirillum empleadas en este trabajo (19.24 cm en promedio) es superior a la reportada por Hernández y Chailloux (2004) para plántulas inoculadas con Azospirillum lipoferum y Azospirillum brasilense y también a la reportada por Sánchez-López et al. (2012) en un estudio realizado con el cv. Sofía e inoculadas con BPCV de los géneros Enterobacter sp., Pseudomonas sp. y Bacillus sp.
El área foliar se incrementó 52% con A.7A y con respecto a A.AMRp10. Se ha reportado que cuando una cepa de Azospirillum induce el crecimiento de las plantas, como en este caso, se debe principalmente a la formación del ácido indol acético (AIA) que se produce por su inoculación (Tien et al., 1979); este metabolito favorece la división celular y diferenciación de tejidos, consecuentemente provoca el incremento de biomasa (Spaepen et al., 2007) y en este estudio el área foliar se correlacionó significativamente con el peso seco (r= 0.71, Figura 2a). De hecho, Ribaudo et al. (2006) encontraron mayor contenido de AIA y etileno en tejidos de plantas de tomate inoculadas con Azospirillum brasilense FT326 en comparación con las no inoculadas.
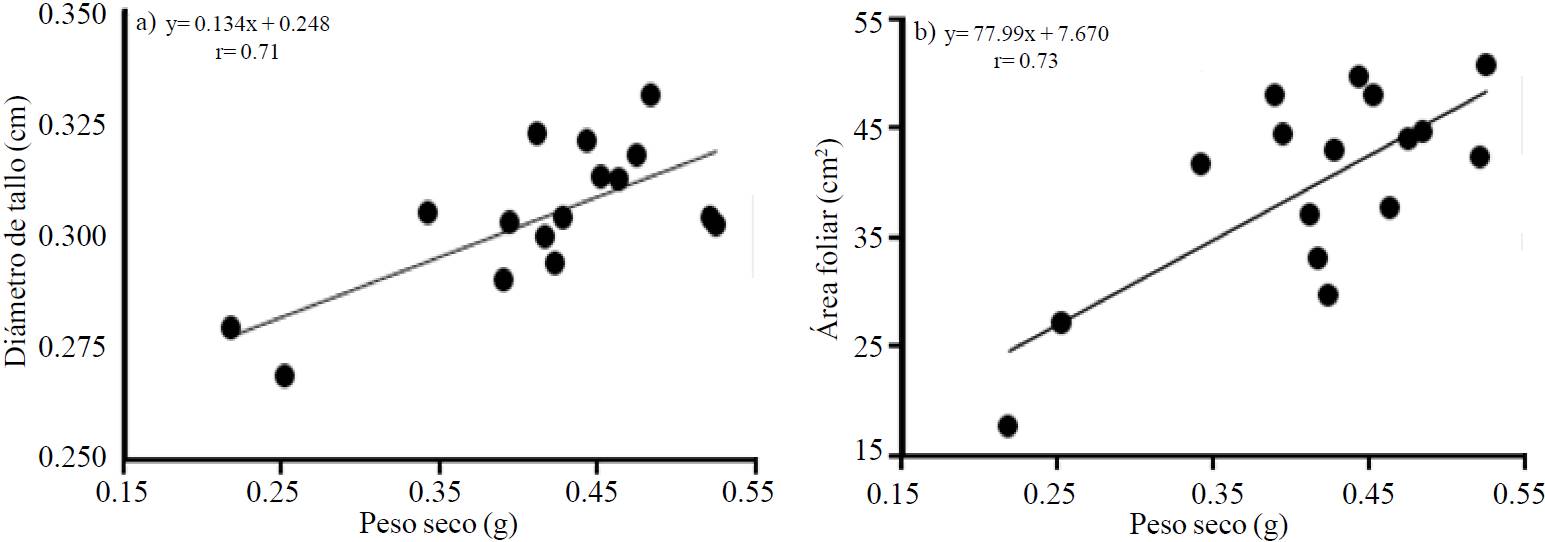
Figura 2. Correlación a 30 días después de la siembra con el promedio de los tratamientos evaluados entre: a) y= diámetro de tallo (cm) y x=peso seco (g) y b) y= área foliar (cm2) y x= peso seco (g), de plántulas de tomate (Solanum lycopersicum).
El diámetro de tallo, unidades SPAD y peso seco de las plántulas de tomate no variaron significativamente entre tratamientos (p> 0.05). El diámetro de tallo promedio fue 0.31 cm, lo cual está acorde a rangos reportados por Hernández y Chailloux (2004) y Terry et al. (2000) para plántulas de tomate inoculadas con BPCV del género Azospirillum, al respecto, Preciado-Rangel et al. (2002) indican que el diámetro de tallo es un indicador del vigor de las plántulas, porque ref leja directamente la acumulación de fotosintatos, los cuales posteriormente pueden traslocarse a los sitios de demanda. El promedio de unidades SPAD fue 34.88, valor muy inferior al señalado por Rodríguez-Mendoza et al. (1998) quienes reportaron 56.11 unidades SPAD a los 45 días después del trasplante, pero fue debido a fertilizaciones realizadas foliarmente y al suelo con fuentes nitrogenadas.
El peso seco promedio de las plántulas fue 0.42 g/planta y hubo una correlación significativa con el diámetro de tallo (Figura 2b). Aun cuando en este estudio el incremento de biomasa no resultó afectado por los tratamientos, se tienen investigaciones donde la inoculación con cepas de Azospirillum resultó benéfica a las plántulas de tomate, por ejemplo, Carletti et al. (1994) reportan incrementos de 76% en el peso seco del tallo con A. lipoferum, también Hadas y Okon (1987) encontraron incrementos significativos en la longitud y peso seco de raíz, peso seco de la parte aérea y área foliar total. Al respecto, Parra y Cuevas (2001) indican que el mecanismo por el cual Azospirillum influye en el desarrollo y productividad de las plantas no es claro y entre las explicaciones señalan su capacidad para fijar N atmosférico en el suelo a través del incremento en la actividad de la enzima nitrato reductasa que estimula la asimilación de nitratos por las plantas inoculadas.
Conclusiones
Aun cuando los incrementos no fueron generalizados en la altura, área foliar, peso seco, unidades SPAD y diámetro de tallo de las plántulas de brócoli (Brassica oleracea var. Itálica), lechuga (Lactuca sativa L.) y tomate (Solanum lycopersicum L.), la aspersión foliar de miel de abeja 2% y la inoculación con la cepa 7A de Azospirillum son buenas opciones para la producción sustentable de plántulas de hortalizas, aprovechando los mecanismos de acción que tienen como promotores del crecimiento vegetal, por lo tanto es promisorio y factible su empleo.











 texto en
texto en 


