Introducción
El agave es una planta xerófita utilizada para la elaboración de bebidas alcohólicas no convencionales como el pulque o el mezcal. Para producir 1 L de mezcal, se requieren 15 kg de Agave salmiana, generándose como productos de desecho 6 kg de bagazo (López-Álvarez et al., 2012). Adicional a esto, se considera que el material de desecho que se deja en el campo durante la cosecha de la piña o cabeza de maguey, es de aproximadamente 10.5 kg por planta, y está compuesto principalmente por pencas, rizoma y espinas laterales. Chávez-Guerrero (2010) reportó que en 2007 se obtuvieron cerca de 1 692 toneladas de bagazo (en base seca) únicamente de la producción de mezcal en el estado de Tamaulipas, sin considerarse el material orgánico que se queda en el campo.
Este material lignocelulósico puede ser aprovechado a través de tratamientos superficiales de las fibras como la maceración, aunado al uso de tratamientos ácidos-alcalinos lo cual permite la separación de fibras de hemicelulosas y ligninas, que además mejora las fibras en cuanto a su estabilidad térmica y fuerza tensil; factores necesarios para la elaboración de compositos. Estos tratamientos también permiten eliminar impurezas como las ceras, pectinas y sales minerales incrementando su área superficial (Saucedo et al., 2010; Ben Sghaier et al., 2012; Rosli et al., 2013).
La reducción de tamaño de partícula en las fibras, genera mayor superficie de contacto con sustancias químicas como ácidos y álcalis, que junto con presión logran modificar más las fibras. El objetivo del presente trabajo fue el de obtener fibras modificadas con alto contenido de celulosa a partir de fibras nativas de A. salmiana, y caracterizarlas mediante técnicas termogravimétricas, espectroscópicas, y microscópicas, para utilizarlo en la industria de alimentos como fibra o como material para la obtención de empaques biodesintegrables.
Materiales y métodos
Materiales
Se utilizaron pencas de A. salmiana de una edad aproximada de 8 a 10 años, obtenidas de plantaciones del estado de Tlaxcala, México. Estas fueron lavadas, pesadas, extirpadas de cutícula, prensadas, secadas a 70 °C por 12 h, liofilizadas durante 12 h con la finalidad de poder procesarlas y finalmente molidas hasta obtener un polvo con tamaño de partículas de 120 micras. Estas muestras se denominaron fibras de agave sin tratamiento (FAST).
Preparación de las fibras de agave
Las pencas en polvo se sometieron a dos diferentes tratamientos. En el tratamiento 1, se utilizó una modificación al proceso de hidrólisis ácido-alcalino propuesto por Saucedo et al. (2010) buscando separar los componentes no fibrosos. Para esto, se llevó a cabo una primera hidrólisis ácida en la penca en polvo, utilizando una solución de HCl al 2% a 60 °C durante 2 h, en una proporción de 1:100 (p/v) dentro de un matraz de bola equipado con un condensador de reflujo y una parrilla eléctrica a temperatura constante. Luego, se neutralizó a un pH de 7.0 con una solución alcalina (NaOH al 20%), se centrifugó (8 049 x g por 10 min), se lavó con agua destilada hirviendo y se centrifugó nuevamente en las mismas condiciones.
El residuo sólido separado, se colocó en un matraz de bola y se le agregó oxalato de amonio al 2% en una proporción 1:30 (p/v), ajustándose el pH a 3.5. Se mantuvo en agitación a 50 °C por 4 h, para posteriormente mantenerse por 1 h a 85 °C. Esto se llevó a cabo con la finalidad de incrementar la formación de oxalato de calcio, el cual se eliminó posteriormente con una solución ácida. Una vez terminado el proceso, se centrifugó (8 049 x g por 10 min) y se le agregaron 200 ml de alcohol etílico al 95% dejándose reposar a 5 °C por 12 h para precipitar la pectina.
Una vez separado el residuo insoluble, se centrifugó (8 049 x g por 10 min) y al sólido obtenido se le aplicó una segunda hidrólisis ácida (H2SO4 al 4%) en una proporción de 1:30 (p/v) con agitación y temperatura controlada de 130 °C por 1.5 h con la finalidad de eliminar la mayor cantidad de azúcares reductores. Se centrifugó (8 049 x g por 10 min) y el sólido obtenido se colocó dentro de un matraz bola. Para romper los enlaces con lignina se le realizó una hidrólisis alcalina con NaOH al 5% por 1.5 h a 70 °C (proporción 1:30 p/v). Se realizaron dos lavados de las muestras con agua destilada en una proporción 1:30 (p/v), el primero de ellos a 70 °C y el segundo a 90 °C, ambos durante 1.5 h. Estas muestras se denominaron fibras modificadas sin presión (FACT sin presión).
Para el tratamiento 2, se llevó a cabo la técnica reportada por Hernández et al. (2009).AlasfibrasdeAgaveenpolvoseles agregó en una proporción de 4:60 (p/v) una solución de HCl al 1.2% colocándose en autoclave a 121 °C por 4 h y presión de 1.1 kg/cm2. Se ajustó el pH a 5.0 con NaOH y se centrifugó (3.08 x g 10 min a 5 °C). Al sólido obtenido se le agregó agua destilada en una proporción de 30:1 (p/v) y se centrifugó (8 049 x g por 10 min a 5 °C). Al sobrenadante se le agregó una solución de NaOH al 2% (p/v) y se llevó al autoclave a 121°C/1.1 kg/cm2/4 h. Se centrifugó (10 397 x g /10 min/5 °C), se decantó y se utilizó el precipitado agregando 250 ml de agua bidestilada para nuevamente someterlo a autoclave a las mismas condiciones. Se centrifugó y el residuo se liofilizó. Estas muestras se denominaron fibras modificadas con presión (FACT con presión).
Composición química
Alas fibras de A. Salmiana, se le realizó el análisis químico determinando el contenido cenizas 31.013 AOAC (1985), azúcares reductores totales (Ting, 1956), contenido de lignina por el método de Klasson y contenido de celulosa-lignina según el método de EN ISO 13906:2008 (CEN/TC327, 2009). El contenido de celulosa se llevó a cabo por diferencia de valor de celulosa-lignina determinada por el método en ISO 13906:2008 (CEN/ TC327, 2009).
Análisis termogravimétrico (TGA) y espectroscopia infrarroja (IR-FT)
Las muestras de fibras de agave sin tratamiento (FAST) y las fibras modificadas (FACT) se analizaron en un equipo de Termogravimetría (Equinox, Brukker, Finlandia) acoplado a un termoanalizador (STA 409 PC Luxx, Netzsch, Alemania) y un módulo de espectrómetro infrarrojo con transformada de Fourier con la finalidad de caracterizar las fibras por sus grupos funcionales. Las condiciones fueron: flujo de nitrógeno de 4 cm3 min-1, temperatura de 50 a 380 °C, velocidad de flujo de 10 °C min-1, longitud de onda de 4 000-500 cm-1 con una resolución de 4 cm-1.
Calorimetría diferencial de barrido (CDB)
Las muestras de FAST y FACT se analizaron en un calorímetro (DSC 2010, TA Instruments Inc, E.U.A.) en un rango de temperatura de 80 a 620 °C, con incrementos de 10 °C min-1. Cada determinación se realizó por separado bajo atmosferas de nitrógeno con un flujo de 20 cm3 min-1. Se utilizó esta técnica para determinar las fases de transición de los componentes de las fibras.
Difracción de rayos X (DRX)
Las muestras de FACT y FAST se analizaron utilizando un difractometro (Bucker D8 advance Vantec, Alemania) usando Cu Kα (1.5418 Ǻ) radioactivo, un filtro de Ni y un contador de centelleo como detector a 35 kV y 30 mA en rotación de 3 a 37° a una escala de 2θ según la técnica descrita por Singha y Rana (2010). Las muestras se pulverizaron y se homogeneizaron antes de ser sujetas a exposición de rayos X. Estas fueron distribuidas en las cavidades del soporte. El índice de cristalinidad (C.I.) se determinó utilizando los conteos de difracción a un ángulo 2θ cercanos a 15 y 22°, el cual se calculó con base en la siguiente fórmula:
Donde: Ic e Ia son las intensidades cristalinas y amorfas a una escala 2θ cercanas a 15 y 22°.
Caracterización morfológica por microscopía electrónica de barrido ambiental (MEB)
La morfología de las muestras FAST y FACT sin tratamiento y con tratamiento fueron analizadas utilizando un microscopio electrónico de barrido ambiental (XL30, Philips, Inglaterra) con filamento de tugsteno, a una presión de 0.94 torr, temperatura entre 2-20 °C y resolución de 3.5 nm. La composición química de las FAST y de la FACT fueron determinadas a través de un detector espectro de rayos X de energía dispersiva (Edax, EUA) acoplado al microscopio electrónico ambiental, utilizando el software “Microanalysis System Software” versión 3.31XL.
Resultados y discusión
Composición química
La composición química de las FAST y FACT bajo sus dos tratamientos, se observa en el Cuadro 1. Las FAST están compuestas principalmente por celulosa en 48.94 ± 5.27%, así como de lignina en 8.48 ± 1.78%, respectivamente. Mientras que las FACT bajo el tratamiento ácido-álcali con presión obtuvieron 33.23 ± 6.28% de celulosa y las FACT bajo el tratamiento ácido-álcali sin presión su valor fue de 79.95 ± 16.9%. El primer tratamiento FACT tuvo 61.82 ± 5.85% de lignina y el segundo tratamiento FACT 8.12 ± 0.38%, en este caso podríamos decir que el NaOH fue eficiente al disminuir la presencia de lignina debilitando sus enlaces, así como también las ceras y pectinas. El tratamiento FACT ácido-álcali con presión fue el más drástico ya que hubo una pérdida de celulosa de 67.89% concentrándose la proporción de lignina.
Cuadro 1. Composición química de fibras de A. salmiana sin tratamiento y tratamientos ácido-álcali con presión y sin presión.
| Lignina (%) | Celulosa (%) | Otros a | Cenizas | |
|---|---|---|---|---|
| A. salmiana FAST | 8.48±1.78 | 48.94±5.27 | 40.26 | 2.32±0.92 |
| A. salmiana FACT ácido-álcali con presión | 61.82±5.85 | 33.23±6.28 | 1.53 | 5.27±1.71 |
| A. salmiana FACT ácido-álcali sin presión | 8.12±0.38 | 79.95±16.9 | 4.75 | 7.18±0.18 |
aObtenido por diferencia. FAST= fibras de A. Salmiana sin tratamiento. FACT= fibras de A. Salmiana con tratamiento.
El H2SO4 por su parte actúa en la hidrólisis de la hemicelulosa, oxalato de calcio y los fructoligosacáridos según lo reportado por Summerscales et al. (2010). La diferencia presentada con el FACT bajo tratamiento acido-álcali con presión, se debe al efecto dual de la acción del ácido-álcali y la presión, lo cual generó una hidrólisis de la celulosa. El contenido de azúcares reductores en las FAST y FACT ácido-álcali con presión y sin presión, fue muy bajo observándose concentraciones de 0.10±0.005% para FAST, 0.000% para las FACT ácido-álcali con presión; 0.02±0.004% para FACT ácido-álcali sin presión.
Espectroscopia infrarroja (IR-FT) y análisis termogravimétrico (TGA)
Espectroscopía infrarroja
Los espectros de IR-FT se llevaron a cabo para caracterizar la estructura química al identificar los grupos funcionales presentes en cada muestra. Estos se muestran en la Figura 1. La banda de 1164 cm-1, se puede atribuir a la ubicación de valencia asimétrica C-O-C observándose que en las FACT ácido-álcali con y sin presión se presentó una menor señal con respecto a las fibras sin tratamiento. El FACT ácido- álcali sin presión y el FACT ácido-álcali con presión tuvo 0.06% y 0.4% menos que el FAST. La banda de 3 460-3 412 cm-1 la cual se atribuye a la vibración de alargamiento del enlace de hidrógeno del grupo funcional O-H, disminuyó en intensidad en FACT ácido-álcali con y sin presión con respecto a las FAST del A. salmiana. La señal de 1 640 cm-1 está relacionada con la absorción de agua aumentando su intensidad ligeramente en el FACT ácido-álcali sin presión, mientras que en FACT ácido-álcali con presión esta intensidad disminuyó fuertemente. Esto concuerda con Johar et al. (2012). Estos autores reportan que el aumento de la intensidad se basa en el alargamiento de los enlaces de hidrógeno y la flexión del OH que están unidos a la estructura de celulosa aumentando la absorción de agua. De igual forma, Lojewska et al. (2005), observó el estiramiento del OH de agua a 1 640 cm-1, ya que aún con secado, el agua adsorbida en las moléculas de celulosa es muy difícil de extraer debido a la interacción celulosa-agua.

Figura 1. Espectros de IR-FT de fibras de A. salmiana con sus tratamientos: (1) FAST; (2) FACT ácido-álcali sin presión; y (3) FACT ácido-álcali con presión.
La disminución de intensidad indica que hay una menor proporción de celulosa lo cual concuerda con los resultados del Cuadro 1. A 2 900 cm-1, las FACT disminuyeron la vibración de alargamiento en comparación a las FAST, debido a la presencia del -CH2 en las muestras. Por otro lado las intensidades de 0.4 las banda de vibración -H y la vibración de C-O (1 060-1 050 y 890 cm-1) disminuyeron principalmente en el FACT ácido-álcali con presión y en menor grado en FACT ácido- álcali sin presión, lo que podría deberse a la hidrólisis de la celulosa (Johar et al., 2012). Estos resultados concuerdan con los presentados en el Cuadro 1 en donde el tratamiento que tuvo un mayor efecto en la cantidad de celulosa obtenida fue el tratamiento FACT ácido-alcali con presión. La señal de 3 420 cm-1 se encuentra en el intervalo de 3 440-3 400 cm-1 correspondiente a los grupos de C-H y O-H descritos como el alargamiento de los enlaces de hidrógeno y a la f lexión de los grupos hidroxilos (OH) unidos a la estructura de la celulosa. Johar et al. (2012), indica que en esta banda la celulosa no es removida durante el tratamiento químico.
La banda de 1 735 cm-1, corresponde a la vibración de alargamiento de los grupos C= O del residuo de grupos acetil y ésteres urónicos de la pectina, hemicelulosa o de los enlaces ésteres de los grupos carboxilo en los ácidos ferúlicos y p-cumaricos de la lignina y hemicelulosa (Sain y Panthapulakkal 2006). En las FACT ácido-álcali con y sin presión disminuyeron su intensidad, siendo mayor en el tratamiento ácido-álcali con presión. Esto concuerda con los resultados obtenidos en el Cuadro 1, donde el contenido de “otros” componentes (los cuales son residuos de hemicelulosas y/o pectinas), disminuye más con el efecto de la presión. Johar et al. (2012) también observó esta banda encontrando una disminución en este grupo funcional debido a la ruptura del enlace acetil entre la lignina y la hemicelulosa durante el pulpeo con NaOH.
De las bandas entre 1 200-900 cm-1, se observa una fuerte disminución en el espectro correspondiente al grupo C-OH y al C-O de la celulosa en las FACT ácido-álcali con presión del A. salmiana, el cual denota una mercerización de la celulosa debido a la abrupta caída de transmitancia. Debido a su composición, la acción del ácido-álcali y la temperatura- presión, permite el llevar a cabo escisiones de las cadenas de celulosa. Esto concuerda con Gassan y Bledzki (2001), quien reporta que a temperaturas de 170 a 210 °C en hornos de convección por tiempos de 120 min hay degradación térmica en la celulosa del lino.
Análisis termogravimético
El análisis termogravimétrico se llevó a cabo para caracterizar las fibras obtenidas en función de la temperatura; así como, también para evaluar los tratamientos aplicados. La Figura 2 muestra los termogramas referente a las FACT ácido-álcali con y sin presión comparándolas con las FAST. La curva de pérdida de las FAST y las FACT con presión y sin presión mostraron tres etapas de pérdida de pesos relacionados a: (i) evaporación de humedad; ii) azúcares reductores; y (iii) degradación de hemicelulosa.
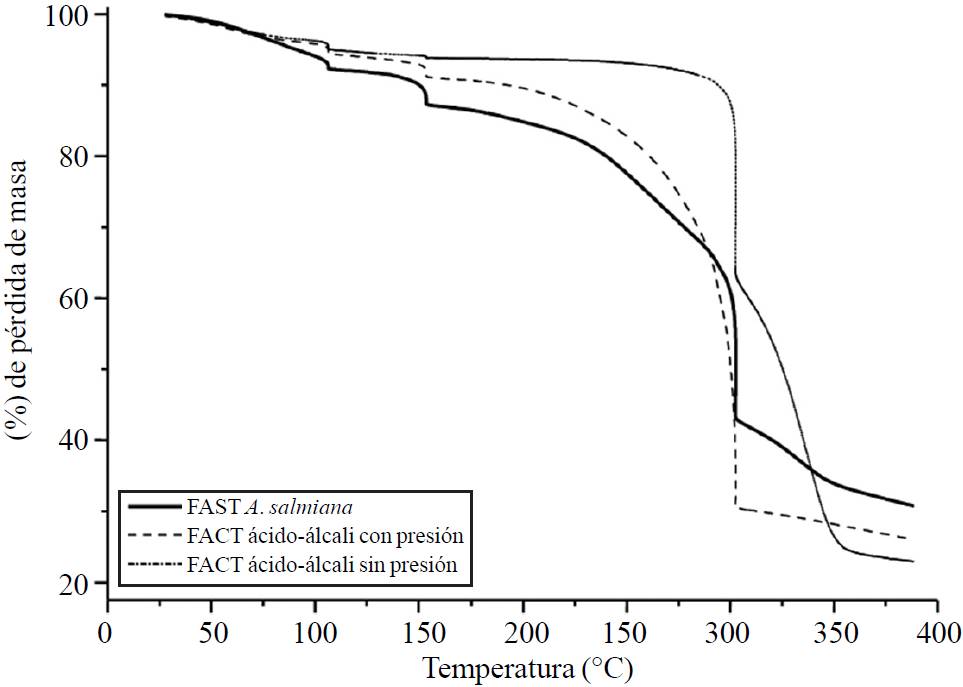
Figura 2. Termogramas de fibras de A. salmiana con sus tratamientos FAST, FACT ácido-álcali con presión, FACT ácido-álcali sin presión.
Las FAST mostraron estar en las etapas antes mencionadas, quedando en 104.41, 152.22 °C, 302.09 °C. La temperatura de estabilización en las FAST de A. salmiana fue de 152.22°C con una pérdida de peso de 11.6%. Esto concuerda con Espinosa-Andrews y Urias-Silvas (2012), quienes indican que los fructanos tienen una temperatura de descomposición debajo de 200 °C y hasta 230 °C dependiendo de las cadenas ramificadas de fructanos de agave. Sin embargo, estas tres etapas de pérdida de masa son diferentes a lo reportado por Kestur (2013), ya que hace mención que en el bagazo de A. tequilana tiene porcentajes de pérdida de masa de 10.8%, 63.8% en temperaturas de 80 °C y 360 °C.
En cuanto a las FACT con ácido-álcali sin presión de A. salmiana, muestran una estabilidad térmica de 152.27 °C con una pérdida de masa de 6%. Posterior a esta temperatura, se observa un descenso probablemente debido a la degradación de hemicelulosa. Después de 350 °C se lleva a cabo la degradación de celulosa. Las FACT ácido-álcali con presión del A. salmiana, muestra un descenso hasta 104.32 °C, probablemente debido a la humedad existente en la fibra y una estabilidad térmica hasta 301.94 °C con una pérdida de masa de 25.99%.
Arriba de esta temperatura se observa también un descenso de pérdida de masa, debido a la degradación de la hemicelulosa (350 °C). El comportamiento observado en el FACT ácido-álcali con presión permitió tener menor pérdida debido a su alto contenido de lignina, y bajo contenido de celulosa. De manera opuesta, en los FACT ácido-álcali sin presión, se observó que debido al contenido menor de lignina pero mayor contenido de celulosa, primero se degradó térmicamente la celulosa por lo que obtuvo mayor pérdida de peso.
Calorimetría diferencial de barrido (DSC)
En cuanto a los resultados DSC, ambos tratamientos mostraron ser coherentes a los resultados de termogravimetria. En la Figura 3 se muestran los resultados de las curvas de DSC. Los FAST de A. salmiana, muestra una endoterma a 110.73 °C y una meseta 139.32 °C. Además de una pequeña endoterma a 213.82 °C correspondientes a reacciones derivadas de degradación térmica. Estas endotermas se deben tanto a humedad como azúcares reductores, como también a hemicelulosas que aún están unidas a complejo celulosa- lignina. Diferencia principal, es que en las endotermas de las fibras tratadas, es menor la entalpia si se compara con la de la fibra nativa, probablemente debido a la eliminación cadenas de azúcares más grandes por la hidrólisis ácido álcali.
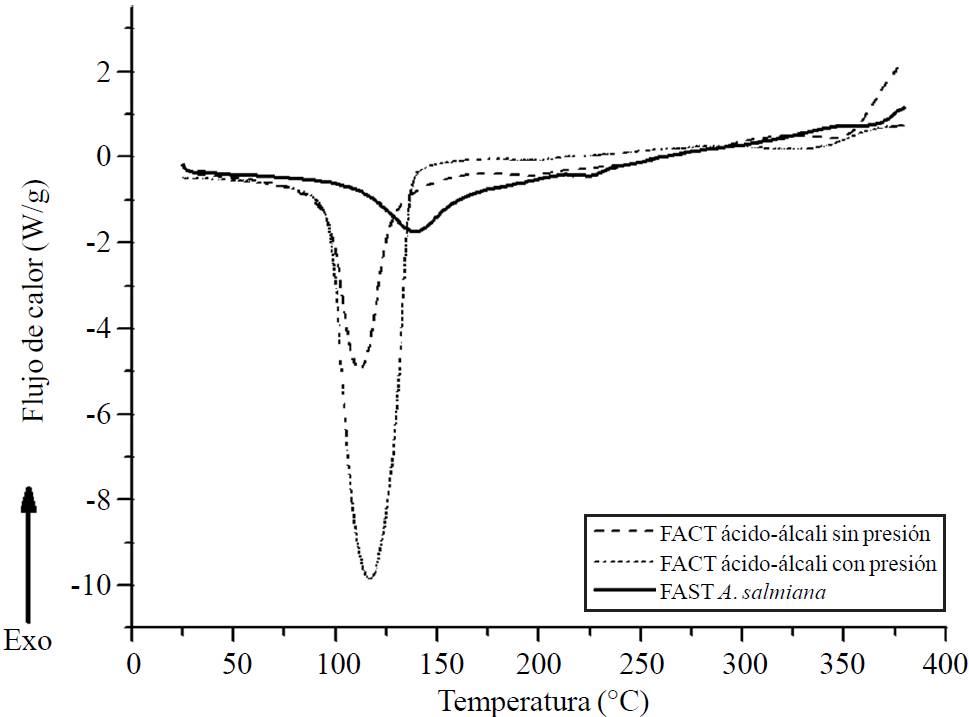
Figura 3. Curvas de DSC de fibras de A. salmiana con sus tratamientos FAST, FACT ácido-álcali con presión, FACT ácido-álcali sin presión.
Los FACT ácido-álcali con presión muestran una endoterma a 96.93 °C con una meseta máxima de 116.99 °C y un incremento leve en la degradación de los demás componentes. Esto se debe a reacciones de sustancias derivadas de la degradación de compuestos extractables. Mana et al. (2010), menciona que a temperaturas inferiores a 200 °C se descomponen térmicamente azúcares entre otros compuestos volátiles unidos a las fibras. Kestur et al. (2013), reporta que los azúcares unidos a lignina pueden ser muy volátiles. Balam et al. (2006), menciona que la degradación térmica de la celulosa ocurre en dos etapas: en la primera se observa una reducción del tamaño de cadena debido a ruptura de enlaces con la generación de radicales libres, grupos carboxilos y carbonilos así como la formación de carbón mientras que en la segunda incluye la depolimerización de la celulosa por ruptura de las unidades glucosídicas y la formación de levoglucosano. Arriba de 410 °C se atribuye la segunda etapa de degradación de la celulosa y lignina.
Mientras que en el FACT acido base sin presión, se observan dos endotermas, una a 120.71 °C y otra a 207 °C con un ΔH= 187.0 J/g y 19.63 J/g. Estas endotermas se deben tanto a humedad como azúcares reductores, como también a hemicelulosas que aún están unidas a complejo celulosa-lignina. Diferencia principal, es que las endotermas de las fibras tratadas, mostraron una menor entalpia que la de la fibra nativa probablemente debido a la eliminación de cadenas de polisacáridos por la hidrólisis ácido álcali. En cuanto a los componentes de hemicelulosa, celulosa y lignina, Espinosa y Urias (2012), hacen mención de que a temperaturas debajo de 130 °C hay pérdida de humedad específicamente en fructanos.
Cambios microestructurales de fibras de A. salmiana determinados por microscopía electrónica de barrido ambiental (MEBA).
La Figura 4 muestra iImágenes de MEBA de las fibras de agaves FAST y FACT ácido-álcali sin presión y con presión. La Fig. 4(1) muestra el arreglo de un gran número de microfibrillas unidas con material amorfo y capas de cera característicos de los agaves sin tratamiento. Bessadok et al, (2008) reportó que en las fibras de A. salmiana las microfibrillas están reunidas en un ramillete y constituyen traqueidas en espiral, conductoras de savia. Después del tratamiento químico, los traqueidas se encuentran parcialmente libres del conjunto [Figura 4(2) y 4(3)]. En FACT con tratamiento ácido-álcali sin presión se observa una mayor proporción de materiales cementantes (sustancias pécticas) que en el tratamiento con presión. Bessadok et al. (2008) menciona que los traqueidas están compuestos de lignina y de materiales hidrofóbicos ya que transportan agua en la planta. El tamaño de las microfibrillas para las FAST de A. salmiana fue de 20.4 μm en estructura helicoidal, mientras que en las FACT con el tratamiento ácido álcali sin presión, el tamaño de fibra fue de 2.84 μm también estructura helicoidal y en el tratamiento con presión de 7.14 μm.
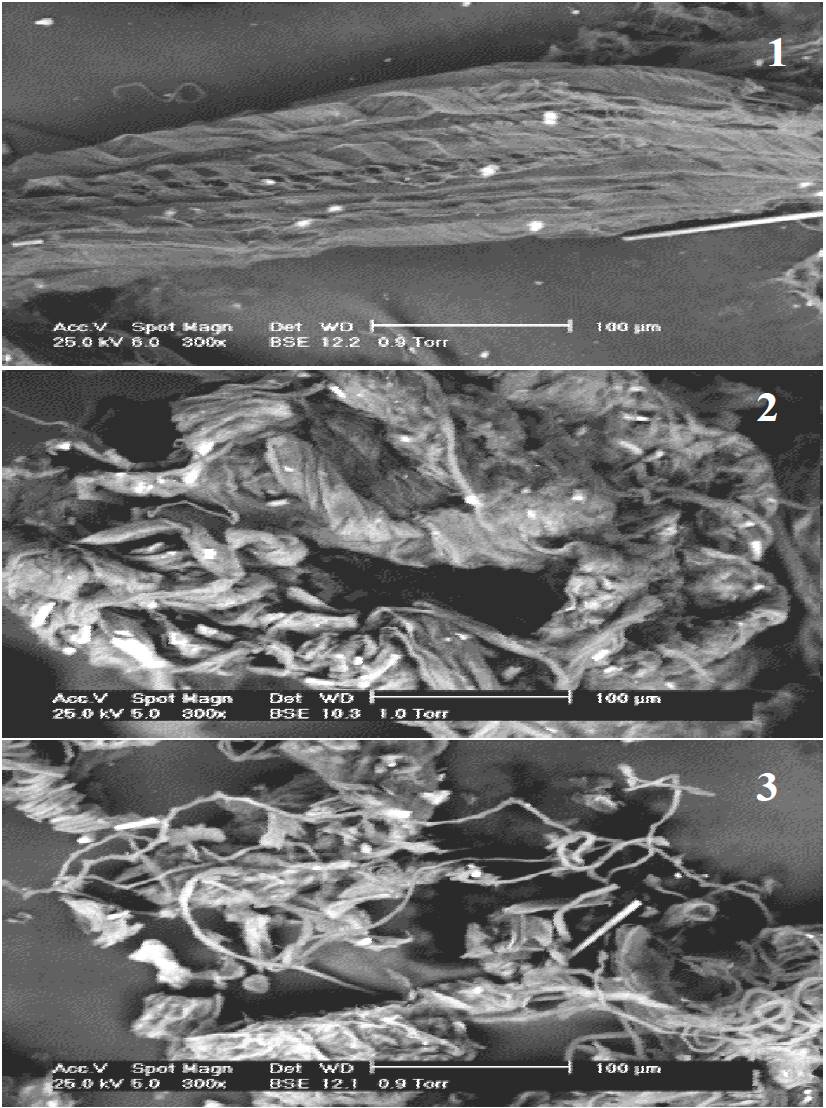
Figura 4. Imágenes de MEBA de fibras de A. salmiana con sus tratamientos: (1) FAST; (2) FACT ácido-álcali sin presión; y (3) FACT ácido-álcali con presión. FAST= fibras de agave sin tratamiento. FACT= fibras de agave con tratamiento.
Al aplicar el tratamiento ácido-álcali sin presión y con presión los productos de degradación se vuelven más pronunciados con mayores espacios entre ellos [Figura 4(2) y 4(3) ], lo cual confirma el grado de polimerización y cristalinidad del agave sin tratamiento con respecto al tratado con ácido-álcali.
Espectroscopia de emisión directa (EDS) y rayos X
Utilizando la espectroscopía de emisión directa (EDS) se determinó la concentración de elementos en la FACT no tratada y tratada con ácido-álcali. La figura 5(a), 5(b) y 5(c) muestra los resultados de las muestras mencionadas. Se aprecia la presencia de C y O, presentes en todo material orgánico y en este caso formando parte de celulosa, ceras y pectinas. Las FACT de A. salmiana tratadas con ácido-álcali sin presión [Fig. (1b)], muestran menor proporción de calcio el cual está en forma de oxalato de calcio. En las FACT de A. salmiana con tratamiento ácido-álcali con presión, se observa una disminución considerable de este elemento. Esta disminución en el contenido de calcio es relevante ya que la presencia de sales de calcio evita la asociación de las fibras de celulosa con otras sustancias, por lo que tenemos una materia prima apta para reaccionar con otros materiales o compuestos y obtener empaques biodesintegrables.
Estudios de cristalinidad
Se obtuvieron patrones de difracción de las fibras de agave y de las tratadas químicamente con y sin presión. Todos los patrones de difracción mostraron picos alrededor de 2Θ= 15, 22, 24 y 30°, indicando la estructura de celulosa tipo I (Oudiani et al., 2011). Hubo diferencia entre los picos y esto se debió a cambios de intensidades que representan las diferencias de cristalinidad de las fibras. Estos índices se pueden observar en el Cuadro 2. Las diferencias observadas en estos índices se relacionan con la proporción de celulosa en la fibra mostrada en el Cuadro 1. Oudiani et al. (2011), reporta que difractogramas con picos en 2Θ = 14° y 2Θ = 16° corresponden a material amorfo como lignina, hemicelulosa, pectina y celulosa amorfa y en porcentajes menores al 10% de NaOH, los picos no pronunciados se consideran celulosa de baja cristalinidad, esto es contienen menor proporción de celulosa amorfa. Tomando en consideración estos resultados el FACT ácido-álcali presenta una mayor proporción de celulosa amorfa. Por otro lado el FACT ácido-álcali sin presión presenta una mayor amplitud de pico, lo que indica una mayor cristalinidad (Cuadro 2).
Cuadro 2. Índice de cristalinidad de fibras de A. salmiana sin tratamiento y con tratamientos ácido-álcali con presión y ácido-álcali sin presión.
| Pico 1 | 2 θ | Pico 2 | 2 θ | Pico 3 | 2 θ | Índice de cristalinidad | |
|---|---|---|---|---|---|---|---|
| FAST | 1860 | 15 | 3103 | 22.08 | 2795 | 24.48 | 40.06 |
| FACT ácido-álcali con presión | 1349 | 14.96 | 2656 | 22.36 | --- | --- | 49.21 |
| FACT ácido-álcali sin presión | 1388 | 14.84 | 2780 | 22.6 | ---- | --- | 50.07 |
FAST= Fibras A. salmiana sin tratamiento. FACT= Fibras de A. salmiana con tratamiento.
Conclusión
Se observó que existe una hidrólisis en la celulosa, debido al efecto de presión y temperatura en ambos tratamientos, observándose de una manera más notoria en el FACT ácido-álcali con presión. El contenido de celulosa y lignina fue mayor en el FACT ácido-álcali sin presión con una mayor cristalinidad, lo cual influye en el grado de pureza de las fibras, dando como resultado diferencias en el contenido de celulosa y lignina. Esto es importante ya que dependiendo de la composición de estos materiales será la posible utilización que se les a las fibras así obtenidas. Los resultados de termogravimetría mostraron eliminación de cadenas de polisacáridos por la hidrólisis ácido álcali. El tratamiento ácido-álcali con y sin presión mostró por MEBA apertura de las estructuras helicoidales las cuales permitieron hidrolizarse de diferentes maneras.











 texto em
texto em 



