Introducción
Los biofertilizantes a base de extractos de algas marinas, son materiales bioactivos naturales solubles en agua, son fertilizantes orgánicos naturales que promueve la germinación de semillas, incrementan el desarrollo y rendimiento de cultivos (Norrie y Keathley, 2005). Los extractos de algas marinas pueden ser utilizados como suplementos nutricionales, bioestimulantes o fertilizantes en la agricultura y horticultura, como biofertilizantes se pueden utilizar en extracto líquido o granular (polvo), el cual se puede aplicar vía foliar o al suelo (Hernández et al., 2014). El uso de algas marinas como biofertilizantes en la agricultura ha aumentado en los últimos años (Dhargalkar y Pereira 2005). Las algas marinas contienen una amplia gama de sustancias bioactivas tales como vitaminas, minerales, reguladores del crecimiento, compuestos orgánicos, y agentes humectantes, coloides mucilaginosas (agar, ácido algínico, y manitol) que ayudan en la retención de la humedad y los nutrientes en las capas superiores del suelo (Subba et al., 2007).
Estudios previos muestran que la aplicación de extractos de algas marinas estimulan la actividad de los microorganismos del suelo, que induce una mayor disponibilidad de nutrientes para la planta facilitando su absorción, reducen la compactación, aumentan la aireación y capacidad de retención de agua del suelo (Selvaraj et al., 2004; Khan et al., 2009). Las algas marinas también tienen un efecto positivo sobre la actividad biológica (respiración y movilización del nitrógeno) del suelo ya que promueve la diversidad microbiana, creando así una medio ambiente adecuado para el crecimiento de la raíz (Sarwar et al., 2008). Al incinerar las algas marinas, dejan un residuo de cenizas cinco o seis veces mayor que él que dejan las plantas; consecuentemente, tienen más metabolitos y, por lo tanto, más enzimas, por lo que al usar algas marinas y/o sus derivados en la agricultura, se aporta un complejo enzimático extra al suelo y a la planta (Gopinath et al., 2008).
Estudios también han mostrado que el contenido de clorofila y la capacidad fotosintética son más altos en plantas tratadas con extracto de algas marinas con aplicaciones foliares y al suelo (Spinelli et al., 2009; Thirumaran et al., 2009; Sunarpi et al., 2010; Bai et al., 2011; Kumari et al., 2011; Hernández et al., 2014). Sivasankari et al. (2006) reportaron que el contenido de clorofila y la asimilación de bióxido de carbono del cultivo de chicharo silvestre (Vigna sinensis) aumentó con la aplicación de extractos de las algas marinas Sargassum wightii y Caulerpa chemnitzia. Sabir et al. (2014) observaron incrementos en rendimiento y calidad de frutos de un cultivo de vid por aplicación de extracto de la alga marina Ascophyllum nodosum.
El objetivo de este estudio fue evaluar el efecto de la aplicación del biofertilizante Algaenzims® a base de extracto de la alga marina Sargassum spp. en el contenido de clorofila, intercambio neto de bióxido de carbono y su relación con el rendimiento y calidad del fruto de una plantación de vid cv. Shiraz.
Materiales y métodos
Ubicación del sitio de estudio
El estudio se realizó en la Vinícola San Lorenzo ubicado en Parras de la Fuente, Coahuila, México. El trabajo se estableció en dos secciones de un viñedo cv Shiraz de aproximadamente 5.2 ha cada una, (204 m en la dirección E-O, por 256 m dirección N-S). El viñedo es de ocho años de edad y las plantas tienen una altura de aproximadamente 2 m en su máximo desarrollo foliar. El viñedo está en un marco de plantación de 1.5 m entre plantas y 2.5 m entre hileras, con una densidad de 2 620 plantas ha-1.
Manejo agronómico de la plantación
La plantación se riega con un sistema de riego por goteo (0.75 m entre emisores), aplicando un gasto de 2.1 LPH. El tiempo de riego a través del ciclo del cultivo es de 2 h diarias. Cada superficie recibió el mismo manejo del cultivo (poda, riego, fertilización y control fitosanitario) de acuerdo con las normas establecidas por la Vinícola San Lorenzo.
Tratamientos aplicados
El 14 de marzo de 2014, a una de las plantaciones se le aplicó al suelo 1 L ha-1 del extracto de la alga marina, Sargassum spp. (con base al biofertilizante Algaenzims®). Posteriormente a la misma sección, el 29 de abril del mismo año se aplicó vía foliar la misma dosis del producto mencionado.
Contenido de clorofila
Las diferencias en contenido de clorofila entre las plantas con y sin aplicación del extracto de alga marina se evaluaron con un diseño completamente al azar con tres tratamientos: sin aplicación del biofertilizante, con aplicación solo al suelo y con aplicación al suelo y foliar y 10 repeticiones, siendo la unidad experimental el promedio de seis lecturas de clorofila por hoja de 10 hojas por planta de un grupo de tres plantas, de tal forma que cada repetición correspondió a la media de 180 lecturas. El contenido de clorofila de las hojas se obtuvo con un medidor portátil (SPAD 502 Plus, Spectrum, Technologies, Inc.). Las hojas muestreadas fueron de la parte media de cada brote en condiciones de sombra evitando la exposición del SPAD a la radiación solar directa. La comparación de medias se realizó con la prueba de Tukey (α≤ 0.05).
Intercambio neto de bióxido de carbono
El intercambio neto de bióxido de carbono (NEE) entre el dosel de la plantación de vid y la atmosfera se obtuvo con la siguiente relación (Marterns et al., 2004):
Donde: FCO2 es el flujo de bióxido de carbono entre el dosel de la plantación y la atmósfera (medido con el método de la covarianza eddy), ΔρCO2 es el cambio en la densidad de CO2 medido a la altura Δz, Δt es el intervalo de tiempo (30 min), Δz es la altura sobre la superficie del suelo a la que se realizan las mediciones de flujo (3 m). El FCO2 se obtuvo con mediciones de covarianza de remolinos (Ham y Heilman, 2003), con la relación:
Donde: w es la velocidad vertical del viento, ρCO2 es la densidad de bióxido de carbono. Las variables con símbolo de prima significan desviaciones respecto a la media y la barra horizontal sobre dos variables denota la covarianza entre las variables para un determinado segmento de tiempo (30 min). Para esto se instaló en cada sección del viñedo un sistema eddy con los sensores correspondientes (Figura 1). La velocidad vertical del viento se midió con un anemómetro sónico tridimensional (CSI-CSAT3, Campbell, Scientific, Inc., Logan, Utah, EE.UU.); para obtener ρCO2 se usó un analizador infrarrojo de bióxido de carbono y vapor de agua de sendero abierto (Open Path CO2/H2O analyzer, LI-7500. LI-COR, Lincon, Nebraska, EE.UU).

Figura 1 Sensores de un sistema Eddy sobre una plantación de vid (cv. Shiraz) para medir el intercambio neto de bióxido de carbono (NEE) entre el dosel del viñedo y la atmosfera.
Los sensores se montaron en un poste a 3 m de altura (1.2 m sobre el dosel del viñedo), que se colocó en la parte media del extremo Oeste de cada sección del viñedo. El anemómetro sónico tridimensional se orientó hacia el Este, para lograr que el viento tuviera por lo menos 200 m de contacto con la superficie vegetal en la dirección Este-Oeste y 125 m en la dirección norte-sur, antes del contacto con los sensores. Los vientos provenientes del Oeste que impactaban en la parte posterior del anemómetro sónico tridimensional no se consideraron en las determinaciones de los flujos. La velocidad vertical del viento y la densidad del CO2 se midieron a una frecuencia de 10 Hz con un datalogger CR1000 (Campbell, Scientific, Inc., Logan, Utah, EE.UU). Las covarianzas correspondientes se calcularon cada 30 min. Las diferencias estadísticas en el intercambio neto de CO2 en las dos secciones (con y sin la aplicación del extracto de la alga mariana) se evaluaron con la prueba no paramétrica de Wicoxon para poblaciones pareadas (α< 0.05).
Rendimiento y calidad de frutos
El efecto de la aplicación del extracto de la alga marina en el rendimiento de fruto se evaluó con un diseño estadístico completamente al azar con tres tratamientos (sin aplicación del extracto, con aplicación solo al suelo y con aplicación al suelo y foliar) y cinco repeticiones siendo la unidad experimental el promedio de veinte plantas.
La calidad de frutos se determinó midiendo los grados Brix (con un refractómetro), pH (con un potenciómetro) y la acidez (método volumétrico). Para estos parámetros también se usó un diseño estadístico completamente al azar con los tres tratamientos mencionados y cinco repeticiones, la unidad experimental correspondió al jugo de 40 frutos obtenido de las plantas de cada tratamiento. La comparación de medias se realizó con la prueba de Tukey (α≤ 0.05).
Resultados y discusión
Contenido de clorofila en las hojas
En todas las fechas de muestreo la aplicación del extracto de la alga marina al suelo y vía foliar resultó en un contenido de clorofila igual o mayor al de la aplicación solo al suelo y sin aplicación (Tukey, α≤ 0.05) (Cuadro 1). Este efecto probablemente se debió a que el extracto de alga marina contiene sustancias como betainas y micro elementos como el hierro, que se requieren en la síntesis de clorofila en las hojas. Nótese que el contenido de clorofila de las hojas de los tres tratamientos se incrementó de la fecha de muestreo 15 de mayo a la del 11 de julio, esto se debió al incremento de los pigmentos de clorofila de las hojas por la maduración de las mismas. De esta fecha al 25 de julio, se tuvo poca variación del contenido de clorofila y del 15 de agosto al 3 de octubre el contenido de clorofila tuvo una tendencia decreciente, debido a la perdida de pigmentos por la progresión de la senescencia de las hojas (Ahmed y Shalaby, 2012; Nagy y Pintér, 2015).
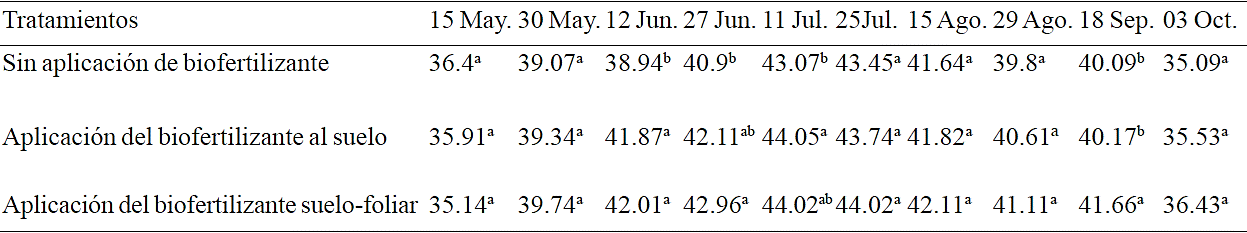
Medias con letra diferente dentro de la misma columna son estadísticamente diferentes (Tukey. α≤ 0.05).
Cuadro 1 Contenido de clorofila en una plantación de vid (cv. Shiraz), con y sin aplicación del extracto de alga marina Sargassum spp. Vinícola San Lorenzo, Parras, Coahuila. 2014.
El promedio del contenido de clorofila del periodo evaluado (mayo-octubre) en la sección con aplicación del biofertilizante al suelo y foliar fue de 40.92 mientras que en la sección sin aplicación fue 39.85. Esto correspondió a un incremento de 2.68% .Estudios previos han reportado incrementos del contenido de clorofila por efecto de la aplicación de extractos de algas marinas. Por ejemplo, Spinelli et al. (2010) mostraron que la aplicación del extracto de la alga marina Ascophillum nodosum a una concentración del 2% a un cultivo de fresa (Fragaria moschata) incremento 11% el contenido de clorofila en las hojas, y 27% la tasa de fotosíntesis. Otros estudio han reportan que con la aplicación foliar de extractos de las algas marinas Ascophyllum nodosum, Laminaria spp. y Sargassum spp. a una dosis de 1 y 2% respectivamente, incrementó el contenido de clorofila en las hojas de un cultivo de ajo (Allium sativum L.) lo que pudo deberse a la presencia de betaínas sustancia presente en el fertilizante líquido de algas marinas la cual aumenta el contenido de clorofila en las hojas (Shehata et al., 2011). Similarmente, Spinelli et al. (2009) observaron un incremento de 12% en el contenido de clorofila en hojas de manzano (Malus Domestica) con la aplicación de un biofertilizante derivado del extracto de la alga marina Ascophillum nodosum a una concentración de 3%, el hierro es un elemento esencial para la biosíntesis de la clorofila que estuvo presente en el extracto aplicado.
Intercambio neto de bióxido de carbono
La aplicación del extracto de alga marina no tuvo efecto en la tasa de intercambio neto de CO2 (NEE) entre el dosel del viñedo y la atmósfera (Cuadro 2) (Wilcoxon, α≤ 0.05). La tasa promedio diaria mensual de intercambio neto de CO2 de abril a septiembre fue mayor en la sección del viñedo sin la aplicación del extracto del alga marina. El promedio diario mensual de los meses mencionados fue 274.57 y 205.09 mmol m-2 en la sección sin y con aplicación del extracto, que representó una diferencia de 38.87%. Esto pudo deberse a la diferencia del tipo de suelo en las secciones del viñedo, ya que la plantación sin aplicación se ubica en un suelo con mayor capacidad de retención de agua, por lo que las plantas tuvieron una mayor disponibilidad de agua, esto tuvo un mayor impacto en la tasa de fotosíntesis que el efecto de la aplicación del extracto del alga marina.

Medias con letra diferente dentro de la misma columna son estadísticamente diferentes (Tukey. α≤ 0.05).
Cuadro 2 Promedios diarios (de cada mes) de intercambio neto de CO2 (mmol m-2) de una plantación de vid (cv. Shiraz), 2014, sin y con aplicación del extracto de la alga marina Sargassum spp. Vinícola San Lorenzo, Parras, Coahuila.
Estudios previos han mostrado la fuerte relación entre la disponibilidad de agua en el suelo y la tasa de fotosíntesis. Al respecto, Castañeda et al. (2006) observaron una reducción de hasta 72% de la tasa de fotosíntesis de un cultivo de frijol (Phaseolus vulgaris) debido al estrés prolongado del déficit hídrico. Otro estudio reportó que la tasa de fotosíntesis de un cultivo de maíz (Zea mays) decreció de 35 hasta 5.5 µmol CO2 m-2 s-1 debido a la suspensión del riego (Zarco et al., 2005). De igual forma, Hayat et al. (2008) observaron una reducción de 75% de la tasa de fotosíntesis en un cultivo de tomate (Lycopersicon esculentum) expuesto a estrés hídrico.
Nótese que la tasa de asimilación de CO2 promedio diaria mensual aumentó de abril a mayo (debido al desarrollo vegetativo de las plantas) en junio y julio se tuvo un decremento de asimilación que se debió a la poda de ramas (realizada la primera semana de junio); la tasa de asimilación decreció en agosto y septiembre por la senescencia de las plantas (Cuadro 2). La máxima tasa de asimilación de CO2 fue 417.41 mmol m-2 d-1 observada en la sección del viñedo sin aplicación del extracto de alga marina en el mes de mayo (Cuadro 2). Debido a que en las plantaciones de vid, las hileras de plantas cubren solo una pequeña parte de la superficie total, la asimilación de CO2 por la vegetación (mmol m-2 d-1) es menor que la que se observa en cultivos de cobertura total. Por ejemplo, Vote et al. (2015) reportaron una tasa de asimilación de 1 775 en un cultivo de maíz (Zea mays) y 725 en arroz (Oryza sativa). Para caña de azúcar (Saccharum officinarum L.) la tasa de asimilación a mediados del otoño fue 571.08 (Zermeño-González et al., 2012).
Rendimiento y calidad del fruto
La aplicación del extracto de alga marina no tuvo efecto en el rendimiento de frutos (Tukey, α≤ 0.05) (Cuadro 3), ya que en la sección del viñedo sin el extracto se tuvo el mayor rendimiento. Los valores de rendimiento promedio por planta en las secciones con y sin aplicación del extracto fueron 9.09 kg y 10.32 kg respectivamente, lo que resultó en una diferencia de 13.5 %. Esto se debió a que como se mencionó anteriormente, el impacto de una mayor retención de agua del suelo en la plantación sin la aplicación del extracto tuvo un mayor efecto en el contenido de clorofila de las hojas y por consiguiente en el rendimiento de frutos. Sin embargo, para condiciones de humedad homogénea del suelo, estudios previos han reportado incremento en rendimiento por la aplicación de extractos de algas marinas en diferentes cultivos (Fornes et al., 2005; Zodape et al., 2011; Pramanick et al., 2014). Con relación a la calidad del fruto, la aplicación del extracto no afecto los grados °Brix del jugo de los frutos; sin embargo, el mayor grado de acidez se obtuvo con la aplicación del extracto solo al suelo y el menor pH con la aplicación al suelo y vía foliar (Tukey, α≤ 0.05) (Cuadro 3).
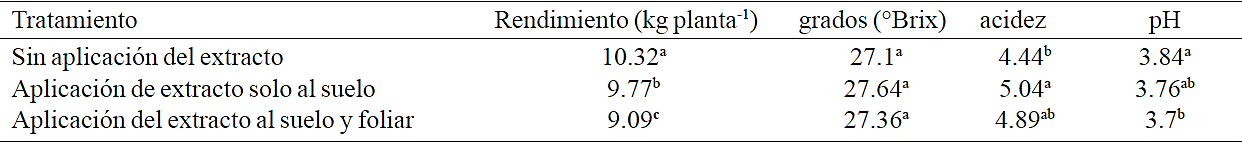
Medias con letra diferente dentro de cada columna son estadísticamente diferentes (Tukey. α≤ 0.05).
Cuadro 3 Rendimiento y calidad de frutos de una plantación de vid (cv. Shiraz), sin y con aplicación del extracto de la alga marina Sargassum spp. Vinícola San Lorenzo, Parras, Coahuila.
Los valores recomendados para la elaboración de vino tinto con el cv. Cabernet Sauvignon son un pH de 3.28 y una acidez total de 4.92, mientras que para el cv. Chardonnay se recomienda un pH de 3.31 y una acidez de 4.04 (Ortega et al., 2002). Para el cv. Shiraz se recomienda un pH de 3.78 y una acidez de 5.5 (Gil et al., 2013). Los valores de acidez de pH que se observaron en este estudio están dentro del rango recomendado, mientras que los valores de acidez son ligeramente menores.
Conclusiones
La aplicación del extracto de alga marina Sargassum spp., al suelo y vía foliar a una plantación de vid cv. Shiraz incrementó el contenido de clorofila de las hojas de las plantas. El mayor contenido de clorofila, no afecto el intercambio neto de bióxido de carbono entre el dosel del viñedo y la atmósfera, ni el rendimiento de frutos. La aplicación del extracto solo al suelo aumento la acidez, mientras que la aplicación al suelo y vía foliar disminuyo el pH. Ninguna de las aplicaciones afectó los grados Brix del jugo de los frutos.











 texto en
texto en 


