Introducción
Las aguas producidas generadas por la industria petrolera podrían aprovecharse como medio de cultivo para microalgas, lo que permitiría utilizar un recurso que representa altos costos para su tratamiento y disposición durante la extracción de hidrocarburos. Además de los beneficios que se podrían obtener de la biomasa producida, las microalgas podrían disminuir la carga tóxica de algunos compuestos presentes en estas aguas (Bacellar-Mendes et al., 2013) que representan riesgos de contaminación en la región en donde se extraen. La capacidad de bioremediación de las microalgas ha sido demostrada en otros efluentes removiendo nitrógeno y fosforo de aguas residuales municipales (Shi et al., 2007) y algunos metales pesados de las descargas de la industria minera (Das et al., 2009).
Algunas microalgas son utilizadas para la obtención de biodiesel (Duong et al., 2012) ya que estos organismos presentan de 4 a 50% de lípidos en sus células, además de una alta tasa de crecimiento, que es de dos a 10 veces mayor que la de las plantas terrestres. Esta diferencia es explicada por el hecho de que todas las células son fotosintéticas, pudiendo doblar la población en 6 a 12 h. La producción de microalgas puede darse durante todo el año cuando las condiciones de temperatura, iluminación, disponibilidad de agua y nutrientes son adecuadas, no compiten con la producción de alimentos y son cultivables en aguas residuales aprovechando los nutrientes disueltos en estas (Subramanian et al., 2013).
Los requerimientos de agua para la producción de microalgas son considerables. Yang et al. (2011), calcularon que para producir 1 kg de biodiesel se requieren 3 726 kg de agua; sin embargo, si se utiliza agua de mar o aguas residuales como medio de cultivo para la producción de la biomasa, estos requerimientos se reducen hasta en un 90% y se disminuye la necesidad de algunos nutrientes. Esta alternativa de utilizar aguas residuales para la producción de microalgas con el fin de producir biodiesel ha sido estudiada por varios investigadores (DOE, 2010); sin embargo, aún hay poca información para el aprovechamiento de aguas producidas como medio de cultivo para las microalgas.
Con el uso de aguas producidas obtenidas después de un tratamiento Arriada y Abreu (2014) lograron el cultivo de la microalga Nannochloropsis oculata, mientras que Sullivan et al. (2011) lograron cultivar Nannochloropsis salina sin necesidad de tratamiento del agua, utilizando solamente mezcla de fuentes de agua para obtener ciertos niveles de salinidad. Por su parte Hamawand et al. (2014) evaluaron la posibilidad de usar el agua extraída con el gas asociado al carbón (Coal Seam Gas) para el cultivo de microalgas, concluyendo que es factible aplicando un tratamiento químico previo del agua usando ácido acético.
Las aguas producidas contienen sales disueltas, como cloruros de calcio y sodio, carbonatos de sodio, cloruros de potasio, sulfatos de calcio o de bario, entre otros; puede incluso contener iones de metales. Las aguas producidas originalmente son aguas congénitas ubicadas en los estratos profundos de las formaciones geológicas (Martel-Valles et al., 2013). Cuando son extraídas durante el proceso de producción de gas o petróleo se les añaden diversas sustancias como surfactantes, geles e inhibidores para facilitar la extracción y es entonces que su composición es modificada y se les llama agua producida (Veil et al., 2004). Su composición es muy variable aun entre sitios de extracción inclusive cercanos y la mayoría de las aguas producidas tienen una salinidad mayor que el agua de mar (Martel-Valles et al., 2013), por lo que se busca su aprovechamiento para el desarrollo de microalgas halotolerantes.
En este estudio se evaluó la tolerancia, el crecimiento y la posibilidad de obtener biomasa aprovechable de tres cepas de microalgas marinas (Isochrysis galvana, Dunaliella tertiolecta y Nannochloropsis sp.) usando aguas producidas obtenidas de la Cuenca de Sabinas en el noreste de México, como una alternativa para la utilización de este potencial recurso hídrico.
Materiales y métodos
Para el presente estudio se utilizaron muestras de agua producida provenientes de las estaciones de pozos Monclova 1 y Buena Suerte ubicados en la Cuenca de Sabinas, las cuales recibían aportes de agua de hasta 25 pozos aledaños a cada estación y fueron caracterizados previamente por Martell-Valles et al. (2013).
Las microalgas evaluadas fueron Dunaliella tertiolecta, Isochrysis galbana y Nannochloropsis sp obtenidas del Instituto de Investigaciones Oceanológicas de la Universidad Autónoma de Baja California, Ensenada, B. C. Los trabajos experimentales se desarrollaron en las instalaciones de Biorganix Mexicana S. A. de C. V. en el municipio de Ramos Arizpe, Coahuila, México.
El material utilizado fue previamente esterilizado en autoclave, el agua salada fue filtrada con filtro millipore de 0.22 µm y las siembras se realizaron en una campana de flujo laminar previamente esterilizada y en presencia de flama. Los experimentos se realizaron en matraces erlenmeyer de 250 ml con 90 ml de medio de cultivo para los testigos y tratamientos. El agua salada se preparó con sales de mar artificiales (Instant Ocean) disolviendo 35 g de sales por litro de agua destilada, se utilizó el medio nutritivo F/2 de Guillard (Guillard y Ryther, 1962) en todos los tratamientos.
Las unidades experimentales fueron mantenidas en una cámara de crecimiento a 20 ±1 °C con un fotoperiodo de 12:12 h luz:obscuridad iluminada con diodos emisores de luz (led) y lámparas de halógeno con una emisión de 7.7 y 14.3 µ mol m-2 s-1 respectivamente y solo se extrajeron para la toma de muestras para los conteos poblacionales, medición de pH y conductividad eléctrica (CE), regresándolas después de ello a su ubicación original. En estas condiciones se mantuvieron los cultivos primarios, los cuales se renovaron cada 8 días tomando 15 ml de inoculo y sembrándolo en 135 ml de agua de mar artificial con medio F/2 manteniéndolos en fase de crecimiento exponencial. De estos cultivos se tomaron 10 ml de inóculo para la siembra de los tratamientos. La densidad de siembra fue dependiente del tamaño de la cepa, teniendo las mayores densidades con Nannochloropsis sp seguido de Isochrysis galbana y las menores con Dunaliella tertiolecta. (5.53 x 105, 2.74 x105 y 0.56 x 105 células ml -1 respectivamente). Todos los tratamientos se hicieron por triplicado.
Los conteos poblacionales se realizaron cada 2 a 3 días haciendo 3 conteos en cámara Neubauer por unidad experimental con un microscopio de contraste de fases. Las cepas móviles fueron previamente fijadas con una solución de formol al 4% para su conteo (FAO, 1996). Las mediciones de pH y CE se realizaron con un potenciómetro y un conductivimetro marca Horiba Laqua twin modelos B713 y B771 respectivamente. La radiación PAR fue medida con un sensor de radiación fotométrica Li-cor quantum modelo Q40808 y un dataloguer LI-1400.
Para el cálculo de la tasa específica de crecimiento se utilizó la ecuación descrita por García et al. (2007), el diseño experimental utilizado fue de bloques completos al azar para minimizar las diferencias que se pudieran tener en el crecimiento ocasionadas por las condiciones lumínicas dentro de la cámara de crecimiento. Para la comparación de medias se utilizó la prueba de Duncan. Los datos fueron analizados con el programa “R” (R Development Core Team, 2013).
Para la evaluación de la capacidad de las microalgas para tolerar y desarrollarse en aguas producidas el trabajo se dividió en dos experimentos (Cuadro 1), los tratamientos se resembraron transcurridos de 7 a 10 días utilizando la siembra inicial como pretratamiento para disminuir la posible carga tóxica aportada por el agua producida (Das et al., 2009; Bacellar-Mendes et al., 2011). Se trabajó con diluciones del agua producida y las concentraciones utilizadas se seleccionaron en base a pruebas preliminares. La tasa de crecimiento en la segunda etapa experimental se calculó en 4 periodos de tiempo, 0 a 9, 9 a 18, 18 a 29 y 29 a 36 días después de iniciado el experimento.
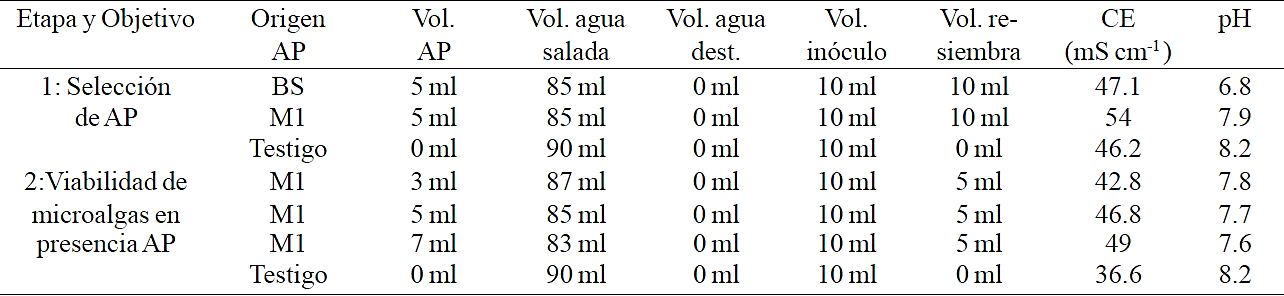
AP= agua producida, CE y pH registrados en los testigos y tratamientos antes de inocular las microalgas; BS= agua producida de la estación Buena Suerte; M1= agua producida de la estación Monclova 1.
Cuadro 1 Preparación de los tratamientos de las dos etapas experimentales. El pH y la CE corresponden al registrado en los tratamientos antes de la siembra.
Resultados y discusión
Experimento 1: selección del agua producida
En los tratamiento con agua de Buena Suerte al 5% se registró un cambio en el pH de 6.8 a ligeramente arriba de 8 después de dos días de la exposición (Cuadro 2), la CE de los tratamientos mostró una ligera disminución de poco más de 2 mS cm-1 hacia el final. Todas las cepas flocularon formando un precipitado en el fondo del matraz (Figura 1), sin lograr crecimientos de las microalgas al reinocular el medio y sin identificar al agente floculante. La floculación de las microalgas pudo deberse a la presencia de iones de metales, los cuales tienen la capacidad de neutralizar la superficie celular cargada negativamente, algunos de los iones que tienen este efecto en las microalgas se derivan del sulfato de aluminio y del cloruro férrico (Udhaya et al., 2014), el pH del medio de cultivo afecta no solo la carga de la superficie celular de las microalgas, sino también la acción de los floculantes químicos. La disminución en la CE en este caso pudo deberse a la precipitación de algunos iones junto con la floculación de las microalgas. El aumento en el pH puede explicarse por el aporte de OH- por parte de las células de microalgas vivas y muertas, tal como ha sido reportado que ocurre en medios naturales (Li et al., 2008).
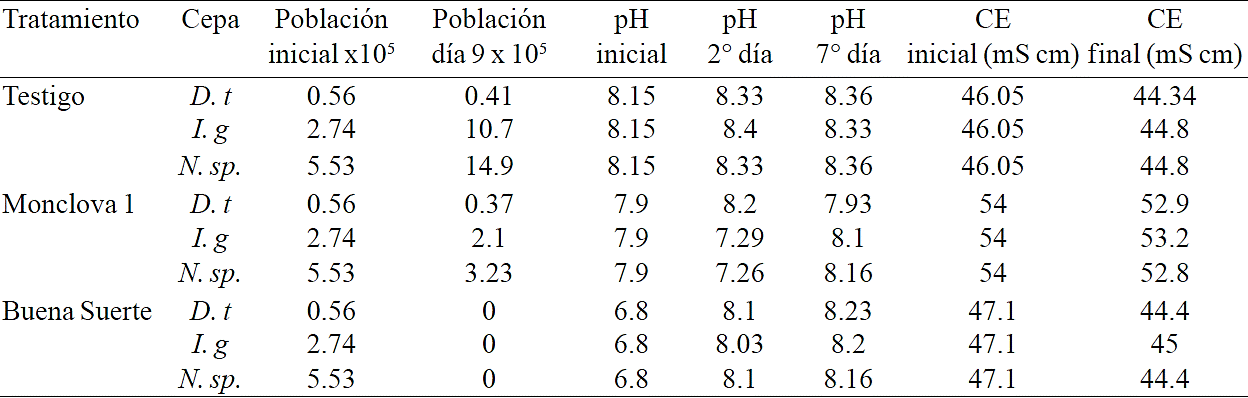
D.t= D. tertiolecta; I.g= I. galbana y N. sp.= Nannochloropsis sp.
Cuadro 2 Variación del pH y CE durante la exposición al 5% de aguas producidas en el experimento 1.

Figura 1 Floculación de D. tertiolecta, I.galbana y Nannochloropsis sp. en el tratamiento con 5% de agua producida de Buena Suerte en el experimento 1.
Al resembrar los tratamientos con agua producida de la estación Buena Suerte a los siete días no se registraron nuevos cambios en la CE y el pH; sin embargo, no se obtuvo crecimiento de ninguna de las tres cepas. Martel-Valles et al. (2013) reportaron un alto contenido de hidrocarburos de fracción media en el agua producida de la estación Buena Suerte (103.2 mg ml-1). Se han reportado efectos tóxicos del diésel en microalgas marinas en concentraciones de 1 a 5 ppm (Mahoney y Haskin, 1980), por lo que la presencia de hidrocarburos de fracción media así como la presencia de agentes floculantes en el agua producida de la estación Buena Suerte, pudieran ser los principales factores que limiten su aprovechamiento para el cultivo de microalgas.
Por otro lado al preparar los tratamientos al 5% de agua producida de la estación Monclova 1 se registró una CE de 54 mS cm-1 y un pH de 7.9. La CE de estos tratamientos estuvo por encima de los 46.2 mS cm-1 registrados en el medio para los testigos, siendo este un medio hiperosmótico que pudo ser un factor más de estrés aunado a la presencia de otros componentes como metales e hidrocarburos en las aguas producidas. En los tratamientos con I. galbana y Nannochloropsis sp. el pH presentó una ligera disminución al inicio del experimento y aumento ligeramente por encima de 8 hacia el final de este, esta variación en el pH pudiera ser consecuencia del intercambio de iones de la células con el medio hiperosmótico.
La alta salinidad provoca un desbalance iónico a las células por la pérdida de agua, lo que origina una sobreproducción de especies reactivas de oxigeno que originan estrés oxidativo. La capacidad de recuperación frente al estrés es variable de una especie de microalga a otra, e involucra la inducción de antiporters como los de H+/Na+ y la protección de los sistemas fotosintéticos con antioxidantes (Martínez-Roldán et al., 2014).
Al resembrar los tratamientos con agua de la estación Monclova 1 con 10 ml de inoculo se lograron crecimientos poblacionales de I. galbana y Nannochloropsis sp. (Cuadro 3), este crecimiento pudo deberse una disminución en la carga toxica por el efecto de bioremediación por las microalgas al inicio del experimento. Entre las características físicoquímicas del agua producida de la Estación Monclova 1 reportadas por Martel-Valles et al., (2013) que pudieran limitar el crecimiento de las microalgas está la gran cantidad de sólidos disueltos totales (153,000 mg L-1) y la presencia de metales pesados (Pb, 1.77; Ni, 1.22; Cd, 0.37; Cu, 0.148 y Cr, 0.39 mg L-1). La bioremediación con microalgas de aguas contaminadas con metales pesados se da en dos fases, la primera es la adsorción, un proceso biofísico que puede completarse en segundos a pocos minutos y puede llevarse a cabo aún en células no viables, después se da la absorción que es la internalización de los iones metálicos al citoplasma celular y es dependiente del metabolismo (Dwivedi, 2012).

*D tertiolecta no mostró crecimiento en esta etapa. TEC= tasa especifica de crecimiento.
Cuadro 3 Tasas de crecimiento en las exposiciones al agua producida de la estación Monclova 1 al 5% (Etapa 1), los tratamientos presentaron crecimiento poblacional hasta después de resembrar el tratamiento.
Considerando los resultados obtenidos se decidió continuar la experimentación con el agua producida de la estación Monclova 1 y descartar el agua producida de la estación Buena Suerte, ya que con esta última se requerirían estrategias diferentes para buscar su aprovechamiento como medio de cultivo.
A pesar de no haber obtenido crecimientos de D. tertiolecta aun en los testigos al seleccionar el agua producida, se consideró la cepa para la siguiente etapa ya que los resultados obtenidos para esta cepa no pueden ser explicados totalmente por los tratamientos con las aguas producidas. Es probable que D. tertiolecta aún no se adaptara a la baja iluminación.
Se manejó esta iluminación ya que podría aumentar las posibilidades de adaptación a estas aguas tomando en cuenta que el incremento de esta al igual que la temperatura podrían aumentar la toxicidad provocada por hidrocarburos en algunas algas (Lewis y Pryor, 2013). Acerca de esto Martel-Valles et al. (2013) reportaron para las aguas producidas de las estaciones Buena Suerte y Monclova un contenido de hidrocarburos de fracción media de 103.2 y 1.8 mg L-1 y de grasas y aceites de 18.1 y 10.4 mg L-1 respectivamente.
Experimento 2: viabilidad de las microalgas en presencia de agua producida de la estación Monclova 1
La interacción de las microalgas con el medio se evidenció en las variaciones de pH y CE de los tratamientos. Los cambios más marcados ocurrieron en los primeros cuatro días de exposición (Figura 2), en donde el pH disminuyó después de la siembra y aumentó hacia el cuarto día con una baja más pronunciada en la concentración del 7% de agua producida, siendo en este caso más lento el aumento del pH. Esta variación en el pH es similar a la encontrada en la etapa 1, solo que en esta ocasión se detectó en las tres cepas.

Figura 2 Variaciones del pH y la CE, registrados durante el experimento 2 en las exposiciones al 3, 5 y 7% de agua producida de la estación Monclova 1.
Por otra parte la CE presentó fluctuaciones en los primeros cuatro días con una tendencia a disminuir y con las fluctuaciones más marcadas en la concentración al 7% de agua producida. Estas variaciones no reflejan directamente la tasa de crecimiento poblacional de las cepas estudiadas (Cuadro 4), sino que son el resultado de la interacción fisicoquímica y metabólica de las células con el tratamiento.
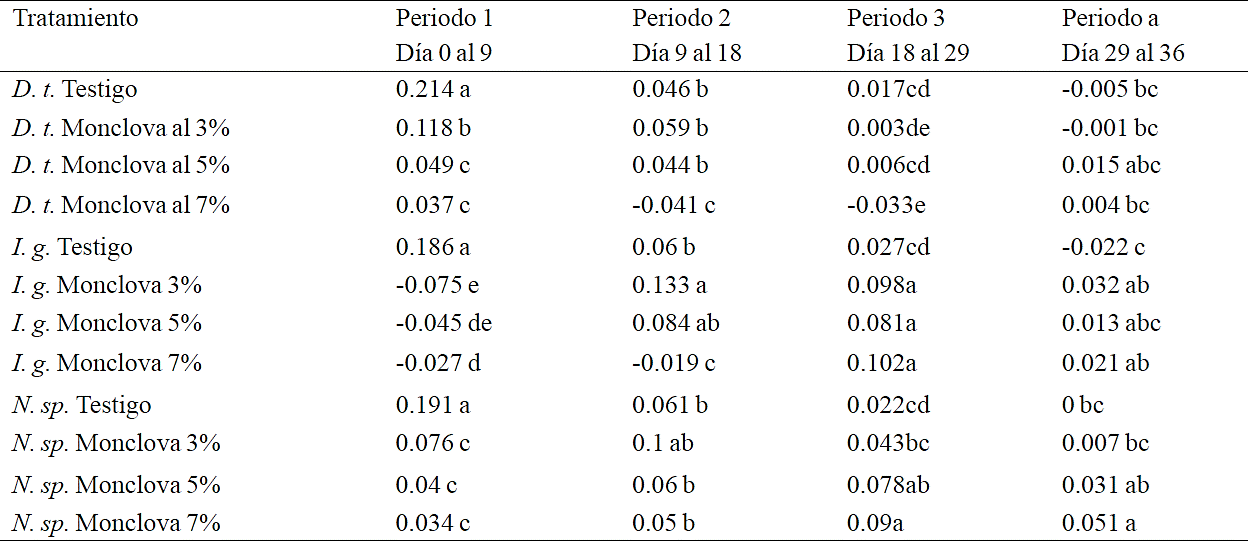
Cuadro 4 Comparación de la tasa específica de crecimiento de las tres cepas expuestas al 3, 5 y 7% de agua producida de la estación Monclova 1 en cuatro periodos de tiempo dentro del experimento 2. D. t: (Dunaliella tertiolecta), I. g: (Isochrysis galbana) N. sp= (Nannochloropsis sp). Letras iguales sin diferencias significativas dentro del periodo de tiempo (Duncan p> 0.05).
La primer respuesta de las microalgas al exponerlas al medio es la interacción de la pared celular con los iones disueltos, así como una tendencia a la deshidratación y contracción celular en caso de que el medio sea hiperosmótico, dentro de este proceso de estabilización de las células en relación al medio se pudieron originar los cambios registrados en cuanto al pH y la CE. Entre mayor fue la concentración de agua producida, mayor fue la exigencia metabólica para que las microalgas mantuvieran su homeostasis, esto se vio reflejado en la tasa de crecimiento alcanzada a los nueve días en D. tertiolecta y Nannochloropsis sp., en donde la mejor tasa de crecimiento se registró en los testigos seguidos del tratamiento de D. tertiolecta al 3%. Las tasas de crecimiento más bajas y sin diferencias significativas se detectaron dentro de este periodo en Nannochloropsis sp al 3, 5 y 7% y D. tertiolecta al 5 y 7%. Por otra parte I. galbana no presento crecimiento en ninguno de los tratamientos a excepción del testigo en los primeros 9 días de experimentación (Cuadro 4).
Después de resembrar los tratamientos hubo una buena respuesta de I. galbana, en los tratamientos con 3 y 5% de agua producida, mientras que al 7% de agua producida esta cepa solo mostró crecimiento hasta el tercer período de tiempo (18 a 29 días), habiendo logrado crecimientos en los tres tratamientos aunque con una densidad celular final con diferencias significativas entre cada tratamiento y menor conforme aumentó la concentración de aguas producidas (Cuadro 5). Este mismo efecto en la reducción de la concentración celular en respuesta al aumento en la concentración de agua producida fue detectado con D. tertiolecta, solo que el crecimiento se registró durante el primer periodo de tiempo (0 a 9 días).
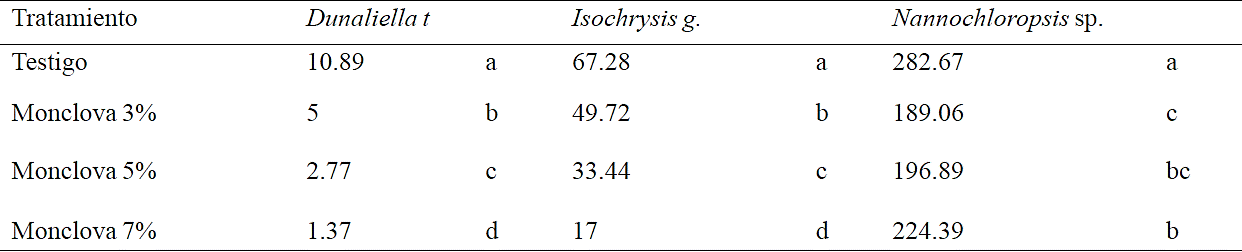
Cuadro 5 Máxima concentración celular obtenida al final del experimento 2 en las exposiciones al 3, 5 y 7% de agua producida de Monclova 1. Letras iguales sin diferencias significativas (Duncan p> 0.05).
En el caso de D. tertiolecta después de resembrar los tratamientos no se detectó una mejora sustancial en la tasa de crecimiento decayendo la población en la exposición al 7% de agua producida, lo que sugiere que en esta cepa se generó una deficiencia, posiblemente por la interacción del medio nutritivo con el agua producida más que un efecto de toxicidad. La mejor respuesta a la presencia de agua producida se detectó con Nannochloropsis sp. al presentar una tasa de crecimiento positiva en los tratamientos durante todo el experimento, aunque muy baja en comparación con la que se obtuvo con el testigo en el primer periodo, se mantuvo constante obteniendo una mayor densidad celular final en el testigo seguido de los tratamientos al 7 y 5%, (Cuadro 5).
La toxicidad producida por metales pesados disueltos en el medio está en función de la densidad celular. Debelius et al. (2009) utilizaron el termino de cuota toxica celular (toxic cellular quota) como la masa de metal por célula, en el caso del Cu++ al aumentar la densidad celular menos cobre es adsorbido por unidad de superficie de pared celular, por lo que hay menor transtorno en la división celular, esto explicaría un aumento en la toxicidad de un metal al disminuir la densidad celular. La densidad de siembra fue mucho menor en los tratamientos de Dunaliella t. (0.86 x105 cel ml-1) que con Isochrysis g (5.46 x105 cel ml-1) y que Nannochloropsis sp. (22.96 x105 cel ml-1), esto por la gran diferencia en el tamaño de las células que hay entre estas tres cepas, lo que podría representar una ventaja para las microalgas más pequeñas al momento de interactuar la superficie celular con el medio adverso al presentar una mayor superficie de adsorción por unidad de biomasa.
Aunque en el presente estudio no se identificaron los factores del agua producida que ocasionaron un efecto toxico en las microalgas, se evidenció la interacción de las microalgas y principalmente de Isochrysis g con este posible factor o factores de toxicidad que de alguna manera fue mitigado por la siembra inicial y permitió el crecimiento de la misma cepa al resembrar el medio.
En este estudio destacan los resultados obtenidos con Nannochloropsis sp. y sobre ello Roleda et al. (2013) destaca a Nannochloropsis oculata como la cepa más robusta entre seis especies de microalgas oleaginosas para crecer y acumular lípidos en un amplio rango de condiciones ambientales. En los resultados obtenidos por Arriada y Abreu (2014) con Nannochloropsis oculata expuesta a aguas producidas en Brasil al 50 y 100% reportan tasas de crecimiento del 0.12 y 0.06 respectivamente, mientras que para el testigo reportaron una tasa de crecimiento de 0.13, con una duración experimental de 18 días. En el presente estudio se obtuvo la máxima tasa de crecimiento de 0.19 en el primer periodo (Cuadro 4) para los testigos, mientras que los tratamientos presentaron su máxima tasa de crecimiento en los periodos de tiempo 2 y 3 siendo de 0.1, 0.078 y 0.089 para los tratamientos al 3, 5 y 7%, con una duración experimental de 36 días. La variabilidad de las características fisicoquímicas de las aguas producidas es un factor determinante para su posible aprovechamiento en la producción de microalgas, como se puede apreciar por los resultados obtenidos en este trabajo con el agua producida de la estación Buenas Suerte y Monclova 1 y su contraste con los resultados del trabajo con aguas producidas de Brasil.
Conclusiones
La opción del agua producida de la estación Monclova 1 tiene mayor potencial para su aprovechamiento que el agua producida de la estación Buena Suerte. La cepa de Isochrysis galbana presentó la mejor recuperación después de la resiembra en los tratamientos al 3, 5 y 7% de agua producida de la estación Monclova 1, por lo que su potencial podría ser para la bioremediación. Isochrysis galbana así como Dunaliella tertiolecta disminuyeron su tasa de crecimiento y densidad poblacional final en relación directa con el aumento en la concentración de aguas producidas a diferencia de Nannochloropsis sp, la cual presentó la menor concentración celular en el tratamiento con la menor concentración de agua producida, lo que la convierte en una buena candidata para estudios posteriores para el aprovechamiento de este recurso.











 text in
text in 


