Introducción
Una adecuada nutrición de las plantas cultivadas no necesariamente se logra con la aplicación de fertilizantes químicos, ya que existen otros que producen el mismo efecto pero tienen un menor impacto ambiental y pueden sostener una producción agrícola que satisfaga la creciente demanda de alimentos a nivel mundial. A raíz de esto surgen insumos agrícolas a base de microorganismos y materiales de origen orgánico, como los hongos micorrízicos y la lombricomposta, opciones que constituyen lo que se llama agricultura sostenible (Pretty, 2008), debido al amplio espectro de actividades que desarrollan, ya que ejercen una gran influencia sobre la fertilidad del mismo y sobre el desarrollo y protección contra microorganismos patógenos de las plantas.
La función principal de los hongos micorrízicos es facilitar a la planta la absorción de agua, fósforo (P) y nitrógeno (N), además de mejorar las propiedades físicoquímicas del suelo y la formación de agregados por medio de la adhesión de partículas debida a una proteína exudada por el micelio llamada glomalina, además mejora la estructura y estabilidad, aumentan la capacidad de retención de agua y reduce la erosión del suelo (Finlay, 2008). Además, también influyen de manera directa o indirecta en la absorción de otros iones minerales como el potasio (K), calcio (Ca), magnesio (Mg), hierro (Fe) y manganeso (Mn), promoviendo el crecimiento de las plantas, especialmente en aquellos suelos donde estos nutrientes son escasos (Koltai y Kapulnik, 2010). Provocan una mayor tolerancia al déficit hídrico, así como la protección de las raíces contra patógenos a través de diversos mecanismos de acción, entre los que se encuentran: micoparasitismo, lisis enzimática, antibiosis y la competencia por espacio o nutrientes (Finlay, 2008).
La lombricomposta es un abono orgánico que proporciona nutrientes a las plantas; su aplicación incrementa el crecimiento, desarrollo y productividad de una amplia gama de cultivos (leguminosas, cereales, hortalizas, plantas de ornato y flores), lo cual se atribuye a las características físicas y químicas del abono (Moreno et al., 2008); también aporta N, P, K, Ca, Mg y carbono (Duran y Henriquez, 2010). Debido a esto, la lombricomposta puede ser usada como medio de crecimiento de especies hortícolas cultivadas en condiciones de invernadero (Cruz et al., 2010). El conocimiento del impacto de los hongos micorrízicosarbusculares (HMA) en hortalizas cultivadas en campo abierto es amplio (Hernández y Chailloux, 2004); sin embargo, el efecto de estas en cultivos en invernadero no ha sido estudiado, menos aún en combinación con abonos orgánicos como la lombricomposta, una práctica que debe ser incorporada a los sistemas de producción hortícola (Nelson y Nelson, 2015; Oseniet al., 2010; Carpio et al., 2005).
Algunos reportes señalan que la inoculación de HMA en tomate, aumenta el estado nutrimental, el tamaño de fruto y permite un mayor rendimiento (Al-Karaki, 2006; Desganet al., 2008; Oseniet al., 2010). Sin embargo, el efecto en ambientes protegidos depende de la cepa del HMA, de la especie de planta cultivada y de las condiciones de crecimiento (Corkidiet al., 2004). Por otro lado, las especies de micorrizas comerciales pueden estar en desventaja por la competitividad con los microorganismos del suelo, por lo que es recomendable utilizar cepas nativas (Caldera et al., 2013). Por lo anterior, en el presente estudio se planteó el objetivo de evaluar el efecto de dos consorcios de hongos micorrizicos arbusculares y una especie comercial (Rhizophagusirregularis) combinadas con un sustrato a base de lombricomposta o turba ácida sobre el desarrollo de plantas de tomate (Solanumlycopersicum)cv. Rio Grande, bajo la hipótesis de que las esporas de HMA nativos pueden superar a la especie comercial en el crecimiento y estado nutrimental de las plantas.
Materiales y métodos
El experimento se llevó a cabo de marzo a junio de 2013 en un invernadero de la Universidad Autónoma Agraria Antonio Narro (UAAAN), en Saltillo, Coahuila, México, cuyas coordenadas geográficas son: latitud norte 25° 27’ y longitud oeste 101° 02’ a una altura de 1 610 msnm. La temperatura mínima y máxima promedio durante el periodo experimental fue de 12 y 34°C respectivamente, mientras que la humedad relativa osciló entre 25 y 72%.
Se utilizaron plántulas de tomate cv. Rio Grande de 15 cm de altura, las cuales se trasplantaron una en cada contenedor de polietileno negro de 5 L de volumen. Los contendores se llenaron con un sustrato a base de lombricomposta, turba ácida, arena y suelo (Cuadro 1); el suelo fue previamente esterilizado a 120°C durante 15 min en autoclave por tres ocasiones. Antes del trasplante se inoculó1 g de producto con 500 esporas del hongo micorrízico comercial Endovit, (Rhizophagusirregularis) (Ri).

CN1 =Consorcio nativo 1, CN2=Consorcio nativo 2,Testigo 1 y Testigo 2 sin inocular y nutridos con la solución de Steiner.
Cuadro 1 Tratamientos establecidos con diferente composición del sustrato y tipo de inoculó aplicados en tomate (Solanum lycopersicum L.) Var. Rio Grande en condiciones de invernadero.
Sin embargo, para los hongos micorrízicos nativos se inocularon 100 g de suelo que contiene la misma cantidad de esporas. Los hongos micorrízicos nativos fueron obtenidos en dos tipos de suelo: uno bajo en materia orgánica (1%) (consorcio nativo 1, CN1) y el otro con alto contenido de materia orgánica (5%) (consorcio nativo 2, CN2). Se recolectaron 3 kg de suelo con raíces de plantas para la extracción de esporas de estos hongos por el método de tamizado húmedo y decantación (Guerderman y Nicolson, 1963). El CN1 estuvo conformado por esporas de diferente diámetro polar y meridional 209.31 y 189.89, 110.56 y 105.49, 129.13 y 142.63, 194.11 y 174.70 µm, mientras que en el CN2 estas fueron 93.27 y 186.52, 229.56 y 275.98, 124.06 y 124.91, 222.72 y 179.04 µm. El diámetro de las esporas se midió mediante un software para Windows Dino Capture 2.0. Versión 1.3.8 y con la ayuda de un microscopio óptico.
Los tipos de esporas de HMA se evaluaron en combinación con dos tipos de sustrato (lombricomposta y turba ácida) que contenían la misma proporción de suelo (10%) y arena (30%), mejorados con la adición de lombricomposta o turba acida (60%), los tratamientos avaluados se presentan en la Cuadro 1. La lombricomposta utilizada tiene un pH= 8.4, CE= 2.6 dS cm-1, materia organica= 5%, densidad aparente= 0.67 g cm3, N= 0.62 meq L-1, P= 0.6 meq L-1 y K= 1.3 meq L-1 y el agua de riego Ca= 4.2, Mg= 3.9, Na= 0.54, Cl= 1.38, SO4= 5.9 y HCO3= 5.9 meq L-1 respectivamente. Por lo que el contenido de ambas fueron consideradas para la formulación de las soluciones nutritivas (SN), utilizando en los testigos la SN de Steiner (1961) al 100%, y en los tratamientos inoculados la solución contenía el 50% de fósforo.
Los riegos se efectuaron manualmente aplicando 1 L de SN por planta, logrando mantener una fracción de lixiviado de 25%; los riegos se efectuaron cada cuatro días.
El experimento finalizó a los 80 días después del trasplante (DDT). Para determinar el porcentaje de micorrización se realizaron dos evaluaciones (50 y 80 DDT), utilizando cuatro plantas por cada tratamiento, de las cuáles se separó la parte aérea y la raíz; a ésta última se le eliminó el exceso de sustrato con agua potable, para posteriormente determinar el porcentaje de micorrización. Los órganos de la planta separados fueron secados en un estufa a 65 °C por 72 h para obtener el peso seco utilizando una balanza digital marca VE-1000. Otras variables evaluadas fueron altura de planta y diámetro de tallo.
Antes de determinar el porcentaje de micorrización las raíces se colocaron en tubos de ensayo adicionando una solución de KOH al 10% por 10 min a 60 °C, posteriormente se agregó H2O2 al 10% para eliminar los residuos de KOH, se dejaron en reposo por 5 min y finalmente se adicionó Lactoglicerol con azul de tripano para la tinción de las raíces (Phillips y Hayman, 1970). El porcentaje de micorrización se obtuvo a partir de las raíces teñidas; se segmentaron las raíces por 1 cm de longitud, colocando 10 seg en un portaobjetos, con tres repeticiones, para su posterior observación en microscopioóptico (10 y 40 x) (Sieverding, 1983).
En raíz y parte aérea se determinó la concentración de N, P y K; para el N se utilizó el método de micro-Kjeldahl (Bremner, 1996), el P por el método de molibdato de amonio y el K por absorción atómica (AOAC, 1980). Los tratamientos se establecieron bajo un diseño experimental de bloques completos al azar con un arreglo factorial de 2 x 4 (2= lombricomposta y turba ácida; 4= CN1, CN2, Ri y Test) con 8 tratamientos y 6 repeticiones. La unidad experimental consistió de un contendor por planta, separado a cada 25 cm. Los datos obtenidos se sometieron a un análisis de varianza (ANOVA) y la prueba de comparación de medias de Tukey (p≤ 0.05) utilizado el programa SAS (Statistical Analysis Systems) versión 9.2.
Resultados y discusión
El porcentaje de micorrización en plantas desarrolladas en lombricomposta y turba ácida fue mayor con la inoculación del CN1 en el muestreo a los 50 días (Figura 1A) y en plantas testigo con lombricomposta. En el segundo muestreo la tendencia fue similar, a excepción de las plantas crecidas con turba acida, pues lacolonización fue mayor con el CN1 y CN2 (Figura 1B).Un mayor porcentaje de micorrización se registró con la inoculación delas esporas del CN1 tanto en etapas tempranas como en las etapas más avanzadas del desarrollo de las plantas coincidiendo con Velasco et al. (2001), quienes señalan que la mayor colonización micorrízica en tomate de cáscara (Physalisixocarpa Brot.) se observó a los 60 días después del trasplante.
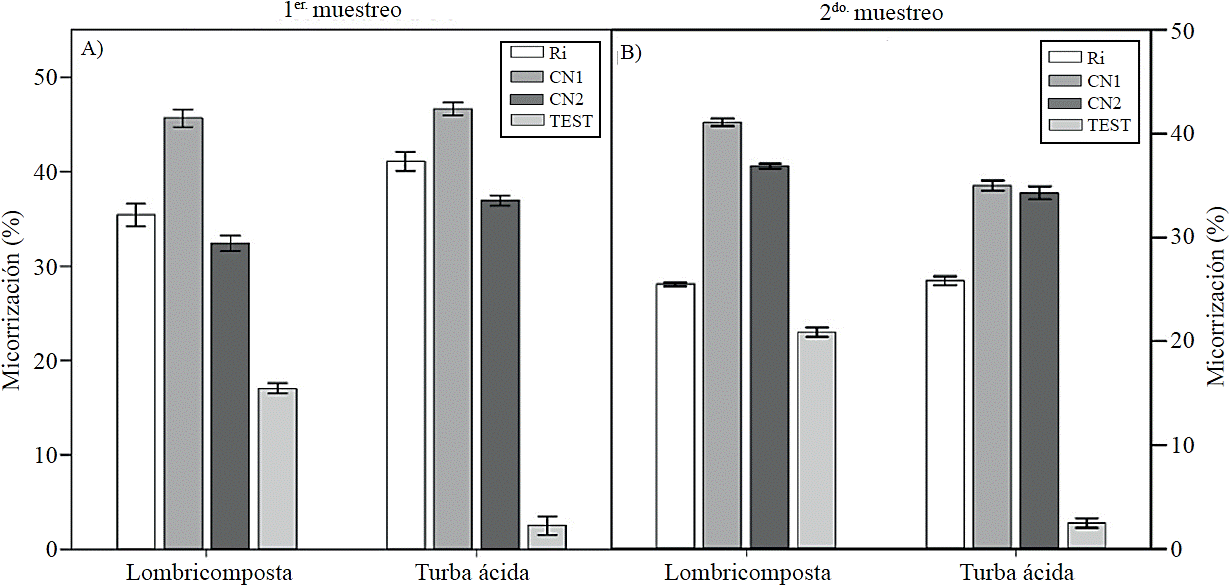
Figura 1 Efecto de los sustratos orgánicos y de las esporas de hongos micorrizicos inoculados en el porcentaje de micorrízación en plantas de tomate (Solanum lycopersicum L.) cv. Rio Grande. Ri= Rhizophagus irregularis, CN1= consorcio nativo 1, CN2= consorcio nativo 2, TEST= Testigo. Las barras indican el error estándar de la media. (micorrización1 y 2; ANOVA sustratos =ns, ANOVA hongos= p≤ 0.001, ANOVA sustratos x hongos= p≤ 0.001) coeficiente de variación; micorrización1= 8.93 y micorrización2= 6.3).
En las plantas testigo crecidas en un sustrato a base de lombricomposta, a pesar de no haber sido inoculadas, registraron una mayor colonización que aquellas crecidas con turba ácida, lo que indica que este sustrato facilita la colonización, probablemente debido a la presencia de sustancias húmicas en el mismo debido a que el establecimiento de los hongos micorrízicosarbusculares y la funcionalidad de la simbiosis son favorecidas por la aplicación de ciertas cantidades de sustancias húmicas (Gryndleret al., 2005; Pinheiro et al., 2014). Se ha reportado que la lombricomposta está compuesta por bacterias y hongos con capacidad para degradar compuestos como lignina y hemicelulosa (Aira et al., 2007).
Sin embargo, no se ha señalado que la lombricomposta contenga esporas de hongos micorrízicos, por lo que la micorrización puede ser debido a una contaminación por el agua de riego; por otra parte, la turba ácida puede contener hongos micorrízicos como ya fue señalado por Callejas-Ruíz et al. (2009). La menor colonización en plantas crecidas en el sustrato a base de turba ácida puede ser debido a que este sustrato tiene alta capacidad de retención de agua, la cual puede ser de hasta 90% (Adams, 2004), implicando una menor aireación en la zona de raíces y por lo tanto una menor oxigenación; algunos reportes señalan que las concentraciones de oxígeno idóneas están entre 12 y 16% para la micorrización y expresión benéfica de la simbiosis en el crecimiento de la planta (Callejas-Ruíz et al., 2009).
El aumento del porcentaje de micorrización en plantas inoculadas con el CN1 comparando con el Ri puede ser debido a que los consorcios de hongos nativos tienen la habilidad de establecer relaciones simbióticas con los microbios del medio y de las condiciones edafoclimáticas, mientras que las micorrizas comerciales (Ri) han pasado por un proceso de selección, lo anterior concuerda con lo reportado por Jargeatet al. (2005), quienes señalan que los hongos micorrízicos están relacionados con bacterias endosimbióticas con forma de bacillos y no pueden desarrollar una fase de vida independiente, por lo tanto la eliminación de estas bacterias compromete seriamente el desarrollo y crecimiento presimbiótico del hongo (Lumini et al., 2007). Lo anterior sugiere la importancia de seleccionar cepas de hongos micorrízicos nativos para dirigir a una condición especifica con el fin de tener resultados satisfactorios (Trejo et al., 2011).
En la Figura 2 A, B, y C se muestra que las plantas desarrolladas en turba ácida mostraron una disminución en la altura de planta, diámetro de tallo y longitud de la raíz cuando se inocularon con las micorrizas nativas o con Ri.a disminución de la longitud de raíz puede ser debido a una mayor síntesis de hormonas provocada por la misma planta y por el hongo, ya que son importantes en las primeras etapas de la colonización, como fue reportando por Foo et al. (2013) y Bucher et al. (2014), quienes señalan que las fitohormonas interactúan para regular el establecimiento y funcionamiento de la simbiosis.
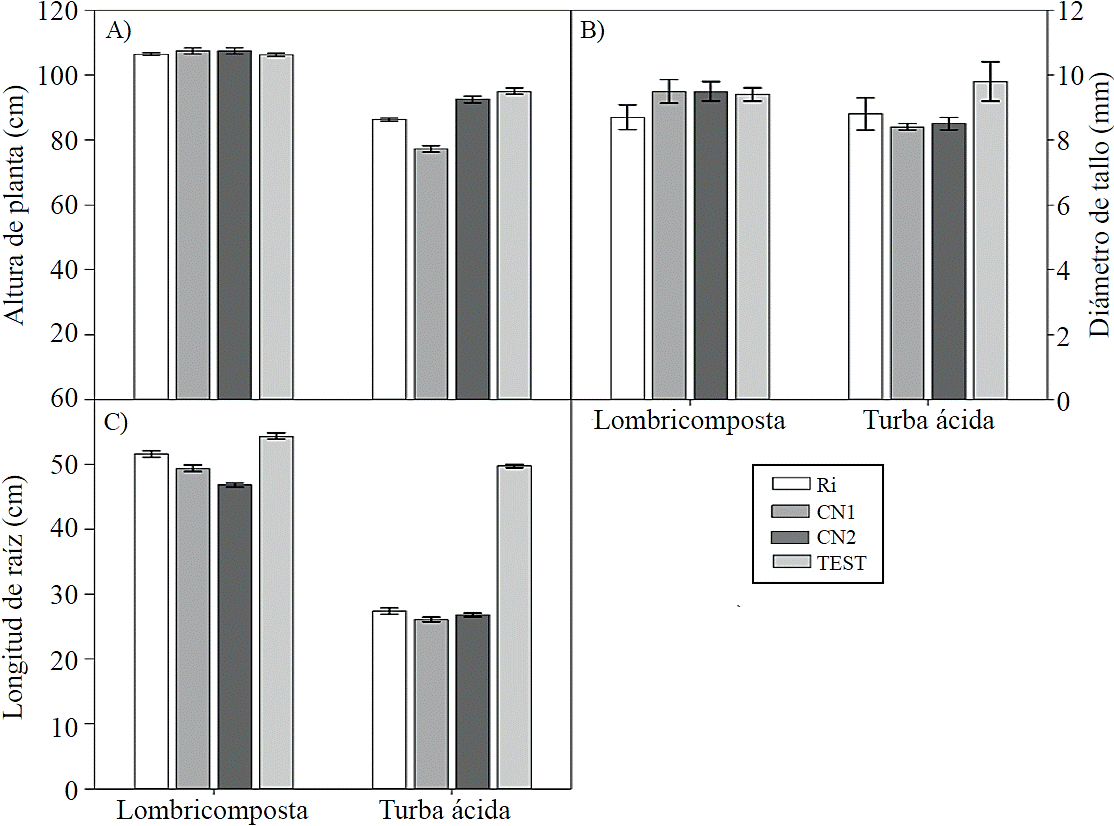
Figura 2 Efecto de los sustratos orgánicosy la inoculación de esporas de hongos micorrízicos en la altura, diámetro de tallo y longitud de raíz en plantas de tomate (Solanum lycopersicum L.)cv.Rio Grande. Ri= Rhizophagus irregularis, CN1= consorcio nativo 1, CN2= consorcio nativo 2, TEST= testigo. Las barras indican el error estándar de la media. (altura, diámetro de tallo, longitud de raíz; ANOVA sustratos= p≤ 0.001, ANOVA hongos=p≤ 0.001, ANOVA sustratos x hongos= p≤ 0.001 coeficiente de variación; altura= 3.23, diámetro de tallo= 4.6 y longitud de raíz= 2.39).
Por su parte Pozo et al. (2015) reportan que algunas hormonas controlan los primeros pasos de la etapa pre-simbiótica, mientras que otras regulan las adaptaciones morfológicas de la raíz para que el hongo se adapte y controle la colonización y funcionalidad, estos resultados se contraponen con los reportados por Velasco et al. (2001), quienes señalan que en las plantas de tomate de cáscara fue mayor la altura en aquellas crecidas con lombricomposta e inoculadas con Glomusintraradices, y por Alvarado et al. (2014) en plantas de tomate cv. Cid inoculadas con Rhizophagus irregularis. Por otra parte los salicilatos, etileno y citoquininas tienen efectos negativos en los primeros pasos de la penetración o colonización de la raíz por el hongo (Foo et al., 2013).En general, el crecimiento de las plantas y la micorrización fueron incrementadas cuando se utilizó un sustrato a base de lombricomposta, aunque tal respuesta estuvo afectada por la interacción con el tipo de esporas de HMA inoculadas.
Las plantas crecidas en lombricomposta obtuvieron mayor peso seco de raíz con la inoculación del CN1, CN2 y en las plantas testigo (Figura 3A), mientras que en la parte aérea (Figura 3B) y total (Figura 3C) solo fue mayor en plantas inoculadas con el CN1. El CN1 y el CN2 aumentaron la biomasa total en las plantas desarrolladas con lombricomposta, debido principalmente al aumento en la biomasa aérea, lo cual puede ser debido a que los hongos micorrízicos en combinación con la lombricomposta aumentan la actividad fotosintética, comofue reportado por Velasco et al. (2001).
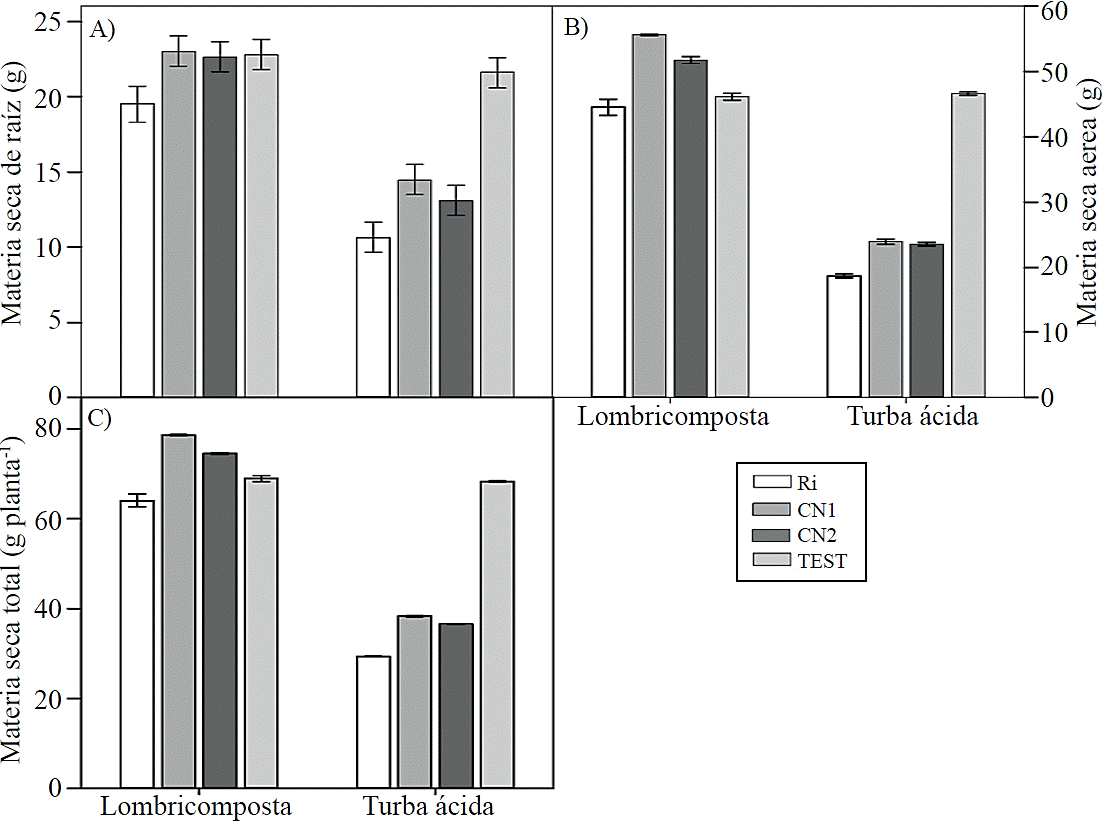
Figura 3 Efecto de los sustratos orgánicos y de las esporas de hongos micorrizicos inoculados en la materia seca de raíz y parte aérea de plantas de tomate (Solanum lycopersicum L.) cv. Rio Grande. Ri= Rhizophagus irregularis, CN1= consorcio nativo 1, CN2= consorcio nativo 2, TEST= testigo. Las barras indican el error estándar de la media. (materia seca de raíz, aérea y total ANOVA sustratos= p≤ 0.01, ANOVA hongos= p≤ 0.01, ANOVA sustratos x hongos= p≤ 0.01, coeficiente de variación; materia seca de raíz= 2.21, materia seca aérea=6 y materia seca total= 4.02).
Similares resultados fueron descritos en plátano (Musa paradisiaca) clon Hórton (Barrera et al., 2012) y en maíz (Zea mays L.) (Zhu et al., 2012) ya que se obtuvo mayor materia seca total con las micorrizas nativas y micorriza comercial, respectivamente. La disminución de la acumulación de biomasa en las plantas inoculadas con los consorcios nativos y desarrollados en turba ácida puede ser debido a que estas recibieron fertilización química, afectando la actividad de los hongos micorrízicos; esto coincide con lo señalado por Ortega-Larocea et al. (2008), quienes reportan que los hongos micorrízicos son afectados significativamente cuando son empleados en condiciones de alta fertilidad, como es el caso de los cultivos hidropónicos.
La concentración de N en la raíz no mostró cambios por efecto de las esporas de HMA inoculadas en plantas crecidas con lombricomposta, mientras que en las crecidas en turba ácida se registró una mayor concentración, al ser inoculadas con Ri (Figura 4A). La concentración de N en la parte aérea fue mayor en las plantas no inoculadas, ya sea en las desarrolladas en lombricomposta o turba ácida, aunque el efecto fue más marcado en las desarrolladas en este último (Figura 4B). La concentración de P en la raíz y parte aérea fue mayor en aquellas plantas no inoculadas, mientras que en plantas inoculadas disminuyó, independientemente del tipo de sustrato, pero este efecto fue más marcado en las plantas crecidas en turba ácida (Figura 4C-D).
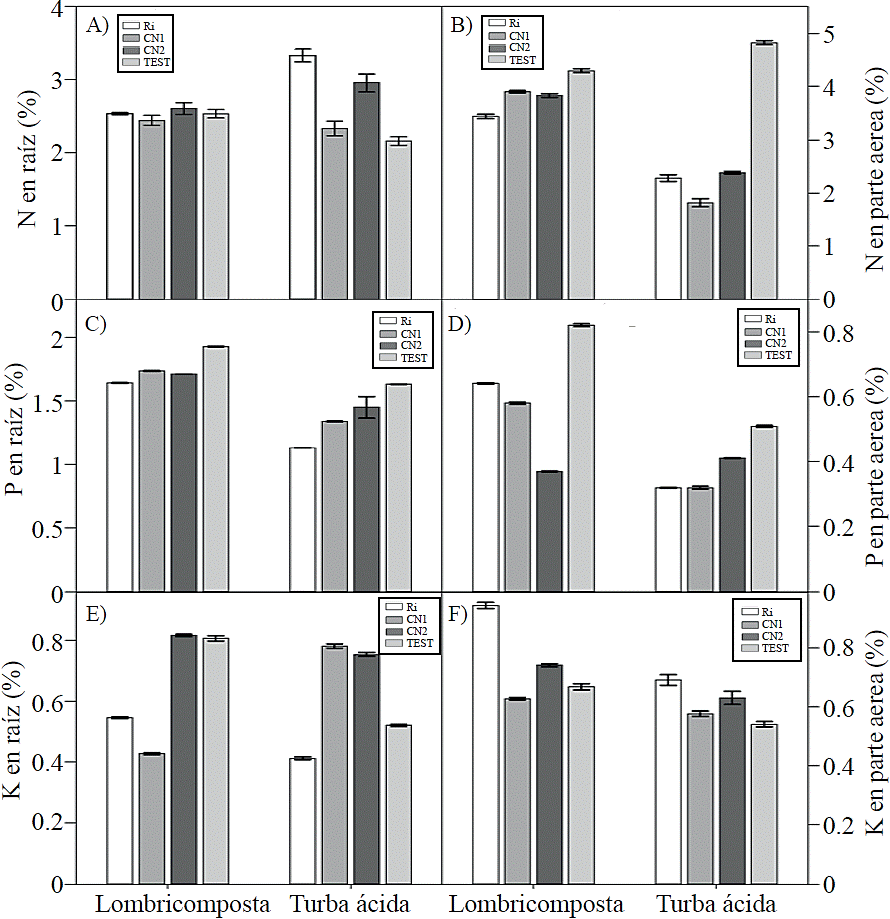
Figura 4 Efecto de los sustratos orgánicos y de las esporasde hongos micorrizicos inoculados en la concentración de N, P y K en la raíz y parte aérea de plantas de tomate (Solanum lycopersicum L.) cv. Rio Grande. Ri= Rhizophagus irregularis, CN1= consorcio nativo 1, CN2= consorcio nativo 2, TEST= testigo. Las barras indican el error estándar de la media. N en raíz; ANOVA sustratos = P ns, ANOVA hongos=p≤ 0.003, ANOVA sustratos x hongos=p≤ 0.01, N en parte aérea, P en raíz y K en raíz y parte aérea; ANOVA sustratos=p≤ 0.001, ANOVA hongos=p≤ 0.001, ANOVA sustratos x hongos=p≤ 0.001 (ANOVA sustratos=p≤ 0.001) y P en parte aérea (p≤ 0.01) (ANOVA hongos=p≤ 0.001, ANOVA sustratos x hongos= p≤ 0.001. Coeficiente de variación; N en raíz=12.48, N en parte aérea= 5.65. P en raíz=1.05, P en parte aérea= 2.24, K en raíz= 3.57 y K en parte aérea= 5.37).
La simbiosis micorrízica favorece la absorción de P y N, provocando un mayor crecimiento de las plantas (Veresoglou et al., 2012; Velazco et al., 2001), lo cual fue corroborado en el presente estudio cuando las plantas de tomate se inocularon con los hongos micorrízicos en combinación con un sustrato cuya composición estuvo a base de lombricomposta.
La disminución en el crecimiento de raíz de las plantas desarrolladas en el sustrato a base de lombricomposta pudo ser debido a una menor concentración de P y K en este órgano, nutrimentos esenciales para su desarrollo (Ferrol y Perez-Tienda, 2009), en tanto que la mayor acumulación de biomasa en la parte aérea puede explicar la disminución en la concentración de N y P debido a un efecto de dilución. Sin embargo, estos resultados también pueden deberse a que la lombricomposta tuvo un aporte medio de P, pues se ha reportado que la aplicación de altas dosis de este elemento, así como de N, tienen efectos negativos en la absorción de N, P, K, Fe, Mn y Zn en las plantas micorrizadas (Castro et al., 2009). En contraste a los resultados obtenidos, Wang et al. (2008) señalan que en plántulas de pepino inoculadas con tres hongos micorrízicosarbusculares se aumentó la concentración de N y P en las raíces y de magnesio (Mg), cobre y zinc en los brotes.
Una micorrización entre el 20% y 35% afectó negativamente la altura y la concentración de P y N en la parte aérea, probablemente debido a que las plantas micorrizadas tienen un efecto negativo por la síntesis de estrigolactonas, la cual es sintetizada en la etapa presimbiotica y es capaz de inhibir la ramificación del tallo (Gómez-Roldan et al., 2008) y afectar al crecimiento de la raíz mediante la inducción de la elongación y disminución en el número y longitud de los pelos radicales (Ruyter-Spira et al., 2011).
La disminución en la concentración de P pudo ser por efecto de la fertilización química, hongos micorrizicos son afectados por los materiales de síntesis (Millaleo et al., 2006), además el fosfato como fertilizante sintético debe ser previamente hidrolizado antes de ser absorbido por la planta (Mäder et al., 2000); bajo este contexto es posible sugerir que los hongos micorrizicos podrían actuar en forma más eficiente sobre las formas de P de menor labilidad (Borie y Rubio, 2003), así como también al P asociado de tipo orgánico sin presencia de sustancias sintéticas. La disminución de la concentración de N por efecto de la micorrización resulta extremadamente interesante destacar pues el efecto de los hongos micorrizicos no siempre será benéfico, ya que la respuesta de la planta puede variar en función del grado de dependencia entre los endófitos y la planta hospedante, así como al grado de colonización (Ferrera-Cerrato y Alarcon, 2008). Por otra parte se ha indicado que la variación de las condiciones ambientales influye en la fisiología de las plantas y por lo tanto en la efectividad micorrízica, por lo que es probable que aunque se observe micorrízación, no todas las estructuras fúngicas estén activas, afectando la traslocación de nutrimentos (Varela y Estrada-Torres, 1997).
En plantas crecidas con lombricomposta aumentó la concentración de K en las raíces inoculadas con el CN2 y las no inoculadas (Figura 4E), mientras que en plantas desarrolladas en turba ácida fue mayor la concentración de este nutriente con la inoculación de las esporas del CN1 y CN2 (Figura 4E). En la parte aérea se incrementó la concentración de K en plantas inoculadas con Ri en ambos tipos de sustrato (Figura 4F).
La mayor altura de la planta se presentó entre 30 y 32% de micorrización (Figura 5A) y la mayor concentración de P en la parte aérea se obtuvo con el 15% de micorrización(Figura 5B); sin embargo, cuando el porcentaje de este fue superior a 35% y 20%, respectivamente, ambos tendieron a disminuir. Asimismo, el aumento en la micorrización estuvo asociado con una disminución en la concentración de N (Figura 5C), mientras que la concentración de K es mayor con el aumento del porcentaje de micorrización (Figura 5D).Por lo que nuestros resultados concuerdan con Kalyanne-Fernandez (2010) y George et al. (1995).
Conclusiones
El mejor sustrato para el desarrollo de las plantas de tomate fue con lombricomposta, pues en la turba ácida se disminuyó el crecimiento y la concentración de N, P y K. El consorcio nativo 1 en comparación con el consorcio nativo 2 y Ri aumentaron la micorrización, la biomasa total y la concentración de K en la raíz.











 texto en
texto en 



