Introducción
El maíz (Zea mays L.) se cultiva mundialmente en más de 168 mil millones de hectáreas con una producción anual de más de 876 mil millones de toneladas, por lo que actualmente éste es el segundo cultivo de importancia en el mundo después del trigo (Cotrisa, 2012). Su importancia económica a nivel mundial se debe al hecho anterior y a que es un grano fundamental para la alimentación animal y, en muchos países, humana (Zarkadas et al., 1995). Recientemente este grano se ha empleado para producir etanol, compitiendo con las funciones tradicionales (Bothast y Schlierher, 2005; Vermis et al., 2007), por lo que se requiere incrementar su productividad. La aplicación de fertilizantes biológicos ha sido una alternativa que permite mejorar la productividad de cultivos por área cultivada y se reduce la contaminación del suelo y el agua (Carvajal-Muñoz y Mera-Benavides, 2010; Chesti et al., 2013).
La práctica de fertilización biológica con base en algas marinas de especies con valor agrícola ha demostrado incrementos en rendimiento y buena calidad de las cosechas a partir de la aplicación directa o de sus derivados. (Painter, 1995; Canales-López, 2001). Las respuestas de las plantas a la aplicación de algas marinas son mayor rendimiento, mejor absorción de nutrientes, mejoran la germinación de la semilla, incrementa el contenido de clorofila y el tamaño de las hojas (Metting et al., 1990; Crouch y van Staden, 1992).
El contenido de clorofila en la hoja está estrecha y directamente relacionado con el estado nutrimental del cultivo (Moran et al., 2000; Chang y Robinson, 2003; Berg y Perkins, 2004). Estudios previos muestran que los extractos de algas marinas contienen citoquininas, auxinas y betaínas que incrementan significativamente la concentración de clorofila en las hojas de las plantas (Whapham et al., 1993; Blunden et al., 1996; Schwab y Raab, 2004; Thirumaran et al., 2009).
La fluorescencia de la clorofila es en un indicador importante para determinar el nivel de estrés en los procesos fotosintéticos de las plantas (Krause y Weis, 1991; Schreiber y Bilger, 1993), y para comparar el rendimiento fotosintético entre especies de plantas (Brodribb y Feild, 2000; Jones et al., 2010). Con base en la medición de la fluorescencia de la clorofila, se obtiene la tasa de transporte de electrones (ETR, por sus siglas en inglés) en saturación de luz, que también se denomina capacidad fotosintética, y se utiliza para expresar la tasa de fotosíntesis y los rasgos fisiológicos de las hojas (Genty et al., 1989). La ETR representa el flujo de electrones a través de la cadena de transporte fotosintético, por lo que niveles bajos de ETR pueden indicar que la planta está bajo condiciones de estrés que limita la tasa de fotosíntesis. Las comparaciones de los valores relativos de ETR entre plantas, deben realizarse bajo las mismas condiciones de luz. Las características de absorción de la luz por la hoja pueden variar según la especie y el grado de estrés hídrico (Eichelman et al., 2004).
El objetivo de este estudio fue evaluar el efecto de la aplicación de fertilizantes biológicos derivados de algas marinas aplicados al suelo y al follaje en el cultivo de maíz forrajero (Zea mays L.), el contenido relativo de clorofila, tasa de transporte de electrones y su relación con la altura de planta, diámetro del tallo y el peso seco de planta.
Materiales y métodos
Ubicación y características del área de estudio
La investigación se realizó durante el ciclo verano-otoño de 2011, en la localidad “Ampuero” ubicada en el municipio de Torreón, Coahuila, México (25° 27' latitud norte y 103° 22' longitud oeste), a una altitud de 1 137 m. Los análisis físicos y químicos del suelo realizados en el estrato de 0 a 0.3 m de profundidad, indicaron una textura franco arcillo-arenosa, moderadamente alcalino (pH=8.5), sin problemas de sales (CE del extracto de saturación 1.48 dS m-1), porcentaje de materia orgánica 1.59% y densidad aparente de 1.31 g cm-3.
Manejo agronómico del cultivo
Se estableció el hibrido amarillo de alto rendimiento (HT7887), que corresponde a un maíz cuya área de adaptación es el norte y centro de México, la altura de plantas es de 2.5 a 2.7 m, de ciclo intermedio, con buen rendimiento y calidad de follaje. La siembra se realizó el 30 de junio de 2011. Las semillas se depositaron en surcos separados 0.75 y 0.13 m entre semillas, para una densidad de siembra de 102 564 plantas ha-1. Se establecieron dos melgas de 10 m de ancho por 250 m de largo (2 500 m2). El riego de pre siembra se aplicó el 15 de mayo. Posteriormente se aplicaron tres riegos de una lámina promedio de 17 cm y un intervalo entre riegos de aproximadamente 30 días, utilizando sifones para la derivación del agua del canal a las parcelas. El gusano cogollero (Spodoptera frugiperda) se controló con dos aplicaciones de Palgus (Spinoteram) (125 mL ha-1). Para el control de plagas, se aplicó Latigo (ClorpirifosCipermetrina) (1.25 L ha-1). El control de malezas se realizó aplicando Primagram (Atrazina-S-Metolacloro) (1.25 L ha-1) a los 15 y 28 días después de siembra.
Tratamientos evaluados y diseño experimental utilizado
En una de las melgas descritas anteriormente se aplicó el producto AlgaenzimsMR, que es un producto biológico a base de macro y micro algas marinas con Ph alcalino (8.2). La aplicación se realizó en el riego de pre siembra a una dosis de 1 L ha-1. Posteriormente, a las plantas de la misma melga se les aplicó (vía foliar) 0.5 L ha-1 del producto AlZincBMR que contiene reguladores de crecimiento como auxinas, giberelinas y citoquininas como parte inherente de los extractos de algas marinas (Sargasuum spp) además de elementos menores como zinc (10%, p/p) y boro (0.5%, p/p). Las aplicaciones se realizaron a los 41 días después de la siembra. La otra melga se manejó como testigo (sin aplicaciones de fertilización biológica). Ambas melgas recibieron la fertilización mineral que regularmente aplica el productor, que consistió en 25 kg de sulfato de amonio y 100 kg de fosfato monoamonico, aplicados al suelo un día antes de siembra.
Se utilizó un diseño estadístico completamente al azar con dos tratamientos (con y sin aplicación de fertilizantes orgánicos) y 10 repeticiones, donde una planta representó la unidad experimental. Las 10 plantas en cada melga se seleccionaron al azar en la parte central de las mismas. La comparación de medias se realizó con la prueba de Duncan (p≤ 0.05).
Contenido relativo de clorofila
El efecto de las aplicaciones de los biofertilizantes, en el contenido relativo de clorofila de las hojas de las plantas, se realizó espectrofotométricamente utilizando el sensor SPAD 502 (Minolta Inc.), que mide la concentración relativa de clorofila por medio de la luz transmitida a través de la hoja a una longitud de onda de 650 y 940 nm (Sainz-Rozas y Echeverría, 1998). Este sensor, estima en forma instantánea el contenido relativo de clorofila (en un rango de 0 a 199) en las hojas de forma no destructiva con la siguiente relación:
Donde: SPAD es el valor del nivel de clorofila; K es el coeficiente de extinción del medio (clorofila de la hoja) a la radiación aplicada (650 nm); IRt es la intensidad de la radiación que transmite la hoja a 940 nm; IRo es la intensidad de la luz emitida por el sensor a 940 nm; Rr es la intensidad de la radiación que transmite la hoja a 650 nm; Ro es la intensidad de la luz emitida por el sensor a 650 nm.
Las mediciones se realizaron en 10 plantas de la parte central de cada melga. Se realizaron ocho mediciones distribuidas a lo largo de la tercera hoja de cada planta (en cuatro puntos de cada lado). Los datos se obtuvieron de la parte media entre la base y el ápice. Los registros se efectuaron a los 36 y 71 días después de la siembra.
Tasa de transporte de electrones (ETR)
La tasa de transporte de electrones se determinó realizando ocho mediciones por hoja en cada una de las 10 plantas de cada melga (con y sin aplicación de biofertilizantes), a 71 días después de siembra (dds). Para esto se utilizó un fluorómetro de pulso modulado modelo FMS-2 (Hansatech Instruments), el cual obtiene la ETR con la siguiente ecuación:
Donde: ETR es la tasa de transporte de electrones (µmol m-2 s-1), ΦPSII es la eficiencia cuántica del fotosistema II, α es la proporción de absorción de luz por el tejido fotosintético (0.84), f es la proporción de luz transferida a cada uno de los fotosistemas (PSII y PSI), que corresponde a 0.54, y PAR es la radiación fotosintéticamente activa incidente (µmol m-2 s-1).
La eficiencia cuántica del fotosistema II se obtiene con la siguiente ecuación:
Donde: FM’ es la fluorescencia máxima real o efectiva y F es la fluorescencia inicial.
Componentes del crecimiento de las plantas evaluados
La altura de la planta se midió desde la superficie del suelo hasta el último nudo del tallo de la planta. La primera evaluación se realizó a los 71 y la segunda a los 99 dds. Se tomaron 10 plantas al azar por cada tratamiento. El diámetro del tallo de las plantas se midió a 5 cm de la superficie del suelo con un Vernier digital surtek (Electronic digital caliper 122200). Las mediciones se realizaron en 10 plantas por cada tratamiento, escogidas al azar a los 99 dds. Las plantas de cada melga se cosecharon al ras del suelo a los 100 dds, estas se colocaron en un horno de secado a 70 oC por 24 h para obtener el peso seco plantas.
Resultados y discusión
Contenido relativo de clorofila
La aplicación de fertilizantes biológicos a base de algas marinas, tuvieron un efecto significativo (p≤ 0.05) en el contenido relativo de clorofila de las hojas de las plantas (Figura 1). En la primera evaluación (36 dds), el contenido de clorofila fue 8.1% mayor en las plantas tratadas con fertilizantes biológicos comparado con el tratamiento sin fertilización biológica. En la segunda evaluación (71 dds) la diferencia entre tratamientos se incrementó a 32.4% (Figura 1).
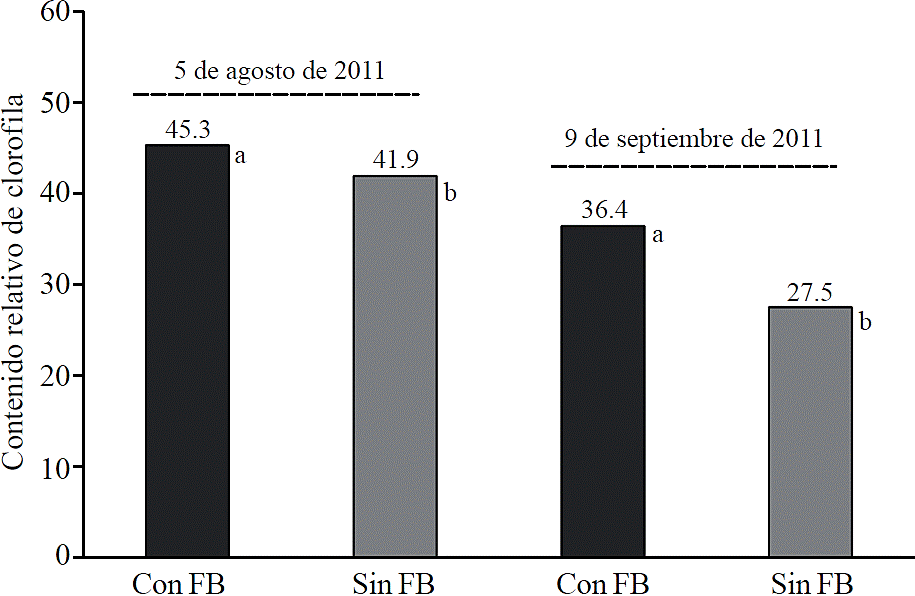
Figura 1 Contenido relativo de clorofila en hojas de plantas de maíz con fertilización biológica (con FB) (AlgaenzimsMR y ALZincBMR) y en plantas sin fertilización biológica (sin FB), observada el 5 de agosto (36 días después de siembra) y el 9 de septiembre (71 días después de siembra) de 2011, Torreón, Coahuila, México.
Estudios previos han mostrado que los extractos de algas marinas contienen cantidades significativas de citoquininas, auxinas y betaínas, que al aplicarse al suelo o al cultivo aumentan la concentración de clorofila en las hojas (Whapham et al., 1993; Blunden et al., 1996; Schwab y Raab, 2004).
Tasa de transporte de electrones (ETR)
La aplicación de biofertilizantes tuvo un efecto significativo (p≤ 0.05) en la tasa de trasferencia de electrones (ETR) en las hojas de las plantas (Figura 2). A los 71 días después de siembra, la ETR en las hojas de las plantas tratadas fue 17.8% mayor que en las plantas sin aplicación de biofertilizantes (Figura 2). Este resultado también indicó que el grado de estrés en las plantas tratadas fue menor, ya que la tasa de transporte de electrones es un indicador del grado de estrés de las plantas (Krause y Weis, 1991; Wajahatullah et al., 2009).

Figura 2 Tasa de transporte de electrones (ETR) en hojas de plantas de maíz con fertilización biológica (con FB) (AlgaenzimsMR y ALZincBMR) y en plantas sin fertilización biológica, (sin FB) observada el 9 de septiembre (71 días después de siembra) de 2011, Torreón, Coahuila, México.
Al respecto, Nabati et al. (1994) reportaron una mayor tolerancia al estrés por salinidad del pasto grama azul de Kentucky (Poa pratensis L.) en respuesta a la aplicación de extracto de algas marinas. Similarmente, Nahed et al. (2011) reportaron que la aplicación de extracto de algas marinas (Ascophyllum nodosum) en plantas de amaranto (Amaranthus tricolor L.) reduce el estrés por salinidad y aumenta la longitud, diámetro del tallo, longitud de la raíz y el número de hojas. Mientras que Spann y Little (2011) encontraron que la aplicación de extractos de algas marinas (Ascophyllum nodosum) al suelo o en forma foliar a plantas de naranjo (Citrus sinensis L.) mejora la tolerancia al estrés hídrico.
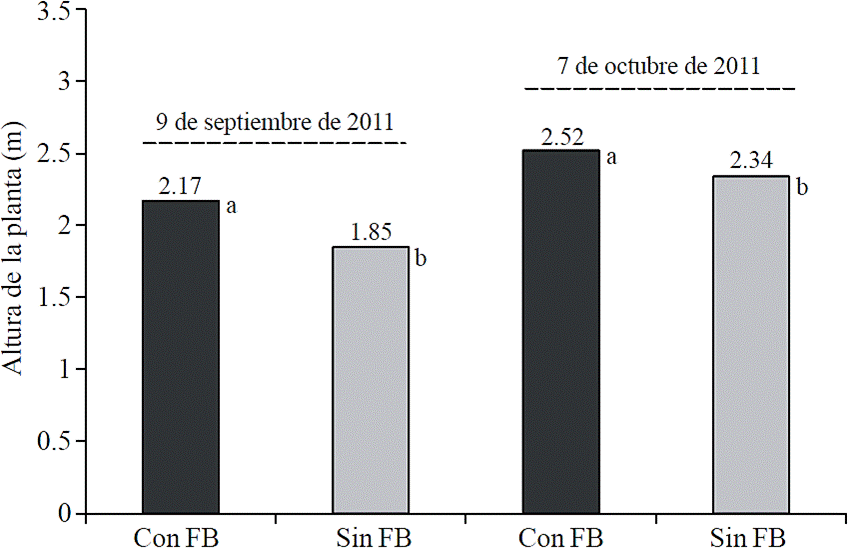
Altura de la planta
En la Figura 3 se muestra que la aplicación de fertilizantes biológicos incrementó la altura de la plantas (p≤ 0.05). En la primera evaluación (71 dds), las plantas con fertilización biológica fueron 17.3% más altas que las plantas sin aplicaciones. En la segunda evaluación (99 dds) la diferencia de altura fue 7.7% en las plantas con fertilización biológica. Estos resultados pueden atribuirse a que las algas marinas son una fuente natural de auxinas y citoquininas, que son un grupo de biorreguladores de crecimiento (Crouch y van Staden, 1993). Resultados similares fueron reportados por Zodape et al. (2011) al encontrar que la aplicación de la savia de algas marinas (Kappaphycus alvarezii) vía foliar (al 5%), incrementó 34% la altura de planta y 45% la longitud de raíz en plantas de tomate. De igual forma Sivasankari et al. (2006), reportaron que la aplicación de algas marinas (Sargassum wightii y Caulerpa chemnitzia) aumentaron el crecimiento de plantas de un cultivo de frijol (Phaselous vulgaris L.).
Diámetro del tallo
El diámetro del tallo también presentó incrementos (p≤ 0.05) por la aplicación de fertilizantes biológicos, ya que a los 99 dds, el diámetro del tallo fue 10.5% mayor que el observado en las plantas sin fertilización biológica (Figura 4). Esto se puede atribuir a que los extractos de algas marinas aportan a las plantas contenidos de elementos mayores y menores, además de enzimas y reguladores de crecimiento (Canales-López, 1997). Al respecto, otros estudios reportan que los extractos de algas marinas son fuente de macro y micro nutrimentos, aminoácidos, vitaminas, citoquininas, auxinas y ácido abscísico (ABA), los cuales afectan el metabolismo celular en las plantas que conducen a un mayor crecimiento y rendimiento de los cultivos (Durand et al., 2003; Stirk et al., 2003; Ordog et al., 2004).
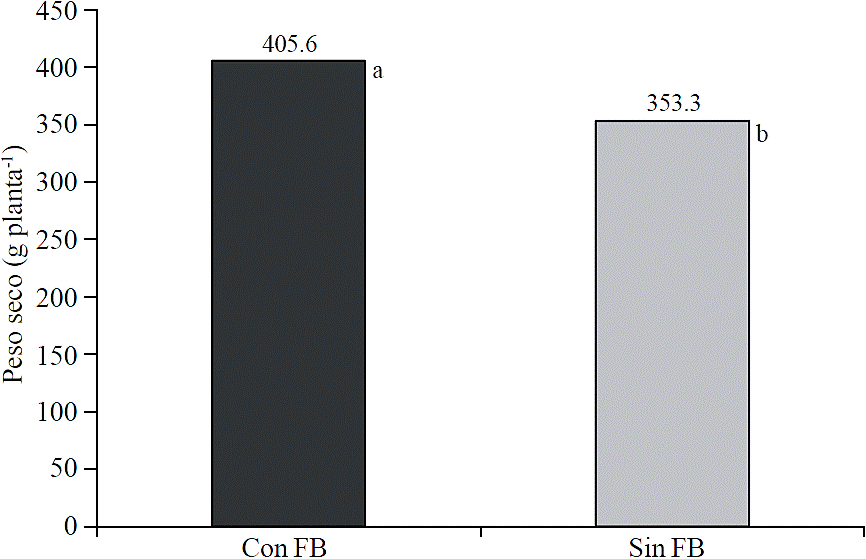
Peso seco de la planta
La aplicación de biofertilizantes derivados de algas marinas incrementó el peso seco de las plantas (p≤ 0.05) (Figura 5). A los 99 días después de trasplante el peso seco promedio de las plantas tratadas fue de 405.6 g planta-1, y el de las plantas sin aplicaciones fue 353.2 g planta-1, esto representó un incremento de 14.8%. Rathore et al. (2009) reportaron un mayor crecimiento y rendimiento de grano de plantas de soya (Glycine max L.) con la aplicación foliar de extractos de algas marinas. Similarmente, Jeannin et al. (1991) observaron un mayor peso freso de plántulas de maíz al ser tratadas con extractos de algas marinas.
Conclusiones
La aplicación de fertilizantes biológicos derivados de extractos de algas marinas al suelo y al follaje en un cultivo de maíz forrajero indujo un mayor contenido relativo de clorofila y mayor tasa de transporte de electrones, que resulto en mayor altura de plantas, de mayor diámetro de tallo y mayor peso seco de planta.











 texto em
texto em