Introducción
El tomate es uno de los cultivos más importantes desde el punto de vista económico y productivo. Se ha destacado en los últimos años por la incorporación constante de tecnologías para su producción (Rabie and Humiany, 2004). Dentro de las tecnologías de producción de esta hortaliza se encuentran el uso de productos químicos para el control de enfermedades, debido a que los rendimientos en gran parte son afectados por la incidencia de enfermedades causadas por hongos del suelo (Jiménez y Sanabria, 2008).
Una de las enfermedades más importantes que afectan a este cultivo es la marchitez vascular producida por Fusarium oxysporum f. sp. lycopersici (FOL), causante de la disminución de 60% del rendimiento y afectando la calidad del producto (Cai et al., 2003; Srivastava et al., 2010). Para esta enfermedad se reconocen tres razas del patógeno, que se distinguen por su virulencia en materiales diferenciales de tomate y que contienen diferentes genes de resistencia (Masato et al., 2005). Los cultivares resistentes son hasta el momento la mejor estrategia de control, ya que estos patógenos permanecen en el suelo por décadas (Reis et al., 2004).
En su necesidad por contrarrestar el ataque de plagas y maximizar la producción, la agricultura moderna es altamente dependiente de insumos y plaguicidas sintéticos. Esto ha traído enormes problemas para la salud animal y humana con un impacto ambiental creciente. Uno de los métodos potenciales de reducir la severidad de las enfermedades causadas por patógenos, es la inducción de resistencia en la planta (Baysal et al., 2003). Dicha actividad está asociada a numerosas respuestas de defensa activadas por el hospedero después del contacto con el patógeno (Flores et al., 2009) o con algún inductor biótico o abiótico (Valueva and Mosolov, 2004).
Dentro de la variedad de metabolitos inductores estudiados se encuentran las alcamidas que son ampliamente distribuidos en diferentes familias de plantas, encontrándose en mayor cantidad en raíces de Heliopsis longipes (nombre común Chilcuague), siendo la afinina (N-isobutyl-2E, 6Z, 8E-decatrienoamida) su principal constituyente bioactivo y la molécula responsable de los principales efectos biológicos (Molina y García, 2001; Morquecho y López, 2007).
En plantas se ha demostrado que estas moléculas juegan un papel importante en la regulación de la morfogénesis y procesos de adaptación (López et al., 2006), de igual manera se ha manifestado en ensayos in vitro que la afinina promueve el crecimiento de plántulas de Arabidopsis thaliana, así como su importancia en la señalización y proliferación celular, de igual manera se menciona su papel en la remodelación de la arquitectura de las raíces y la parte aérea a través de las proteínas DHM1 (Pelagio et al., 2013).
Por lo anterior, el objetivo de esta investigación fue observar el efecto de la aspersión del extracto etanólico de H. longipes sobre plántulas de tomate inoculadas con FOL, midiendo el grado de severidad de la enfermedad, variables relacionadas a vigor y los cambios histológicos de tallos y raíces asociados a la respuesta de tolerancia a FOL en la planta.
Materiales y métodos
Fusarium oxysporum f. sp. lycopersici. La cepa utilizada en este trabajo se aisló a partir de raíces de plantas de tomate enfermas obtenidas en el área de Silao, Guanajuato, México (González et al., 2011).
Extracto de H. longipes. El extracto de H. longipes se elaboró con las raíces secas y molidas de esta planta, colectadas en la Sierra Gorda de Guanajuato. Para obtenerlo, se usó una proporción de 1:10, esto es 1 g de raíz macerada por cada 9 ml de solvente, el cual fue etanol al 98%. El extracto se obtuvo al sumergir el tejido macerado en el solvente a temperatura ambiente, manteniéndolo así durante 30 días. El extracto crudo se filtró con papel filtro Whatman Núm. 1 y se concentró en un Rotavapor (IKA). La determinación de la concentración de afinina se llevó a cabo por medio de HPLC de acuerdo a Ramírez et al. (2000).
Prueba in vivo. Se llevó a cabo en plántulas de tomate de 5 a 6 hojas verdaderas de la variedad Río Grande, sembradas en charolas de plástico con turba: perlita a una proporción 1:1. La prueba se dividió en seis tratamientos: testigo absoluto (TA), testigo infestado con FOL (FOL), plantas asperjadas con el extracto de H. longipes (HL), plantas asperjadas con el extracto de H. longipes e inoculadas con FOL (HL+FOL), plantas asperjadas con un producto comercial recomendado para inducir resistencia sistémica en plantas a base de ácido salicílico, el cual se denominó control positivo (C+) y plantas asperjadas con el control positivo e inoculadas con FOL (C+ +FOL).
Para su aplicación el extracto etanólico de H. longipes fue estandarizado para aportar 300 mg L-1 de afinina, agregando 150 ml a cada planta. El control positivo comercial (el ingrediente activo es el ácido salicílico, y es un producto recomendado para inducir resistencia a estrés biótico en plantas) se aplicó a una concentración de 1.25 ml L-1 de agua, agregando 150 ml a cada planta, ambos tratamientos fueron aplicados por aspersión foliar.
Cuatro días después de la aplicación del extracto de H. longipes, se inocularon las plantas de los tratamientos FOL, HL+FOL y C++FOL, utilizando la técnica de inmersión de raíces en una solución de esporas de FOL de 106 esporas/ml, durante 15 minutos (Benhamou et al., 1998).
Veinte días después de la inoculación, se tomaron los datos de incidencia y severidad, para esta última variable se utilizó la escala reportado por Diener y Ausubel, 2005; así como las muestras para medir peso seco de raíz, tallo y hojas, altura de planta y longitud de raíz utilizando 20 repeticiones por tratamiento.
A continuación se define la escala de Diener: 0 Planta muerta (100%); 1 hojas viejas muertas y hojas jóvenes con crecimiento detenido (80%); 2 hojas viejas cloróticas y hojas jóvenes con crecimiento detenido (60%); 3 hojas viejas con clorosis vascular y hojas jóvenes con crecimiento detenido (40%); 4 peciolos de hojas con crecimiento detenido (20%); 5 sin síntomas visibles (0%).
Estudio histopatológico. Las muestras para los ensayos histopatológicos se colectaron en dos ocasiones, contando en cada ocasión con 10 repeticiones por tratamiento. El primer muestreo se llevó a cabo a los dos días después de la aplicación del extracto de H. longipes y el segundo a los tres días después de la inoculación con FOL que corresponde a seis días después de la aplicación del extracto. Para dicho análisis se realizó la deshidratación de las muestras seguido por la inclusión en parafina, seccionamiento en micrótomo y tinción safranina-verde rápido (Hernández, 1984; Fuentes et al., 2005; Rivero et al., 2007). Las muestras se analizaron en un microscopio óptico (Carl Zeiss) con cámara integrada y se observaron a 4 y 10 (x) utilizando el programa Pixera Wiewfinder Pro. Las mediciones de área total del lumen de xilema, área de córtex, médula y grosor de pared celular se realizaron con el programa AxioVision LE Rel. 4.5. El conteo de los vasos del xilema se realizaron tomando en cuenta un cuarto de la imagen por muestra.
Análisis estadístico. El diseño experimental utilizado fue un diseño completamente al azar, considerando una planta como unidad experimental y usando 20 repeticiones por tratamiento para la evaluación de incidencia, severidad, altura de planta, longitud de raíz y peso seco de raíz, tallo y hojas. Mientras que para el análisis de área relativa de córtex, grosor de pared celular, en raíz y tallo se consideraron 10 repeticiones por tratamiento, para la variable de número de vasos de xilema de la raíz se tomaron en cuenta 4 repeticiones por tratamiento. A los datos obtenidos se les realizó un ANOVA y una prueba de comparación de medias por medio del método de Tuckey (p> 0.05) mediante el programa estadístico de Minitab 16.
Para comprobar los supuestos del modelo estadístico se llevó a cabo un análisis de residuales de la variable área de lumen del xilema de raíz y tallo, resultando la no normalidad de los datos, es por ello que se realizó la transformación de Box -Cox, por lo cual las gráficas en la Figura 9 A y B son de los datos transformados (Y) de dichas variables.
Resultados
Incidencia y severidad. Los valores obtenidos para la incidencia (Figura 1) muestran que la aspersión de las plantas de tomate con el extracto de H. longipes tuvo un efecto positivo al reducir en 15% la incidencia de la marchitez en las plantas asperjadas con H. longipes (HL+FOL) con respecto a FOL. Esto también se observó al evaluar la severidad de los síntomas causados por FOL (Figura 1), donde se encontró una diferencia significativa, los cuales disminuyeron cerca de 80% con la aplicación del extracto (HL+FOL) y con el uso del control positivo (C+ +FOL) con respecto al testigo infestado (FOL).
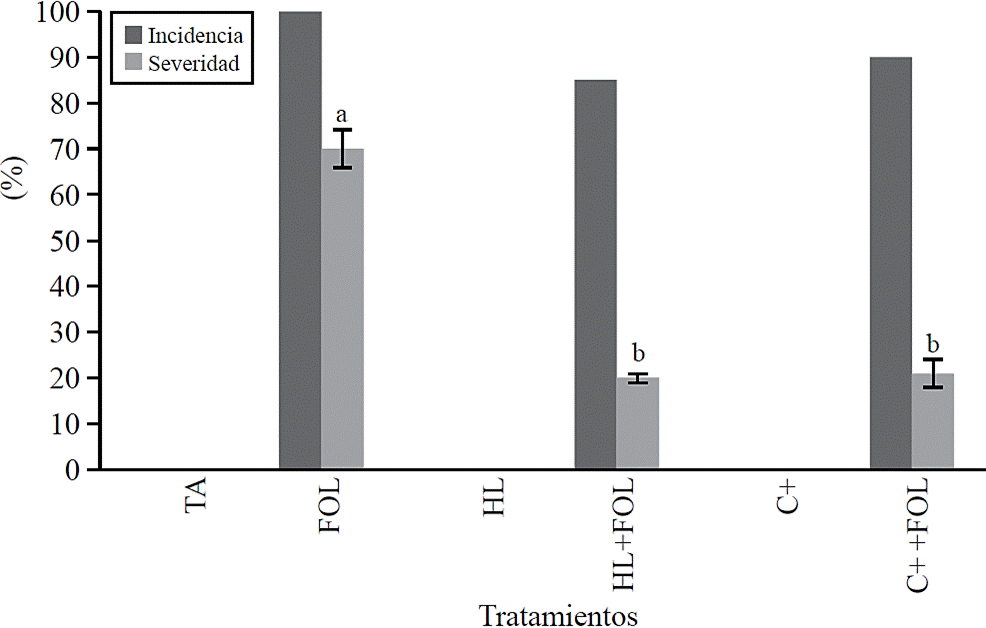
Figura 1 Efecto de la aplicación del extracto de H. longipes en la incidencia y severidad de plántulas de tomate. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
Los hongos patógenos del género Fusarium, son algunos de los agentes causales del deterioro de la raíz y el tallo basal, dando como resultado el marchitamiento de las plantas (Ignjatov et al., 2012). Para este estudio el uso del extracto de H. longipes no inhibió la marchitez por FOL; sin embargo, si disminuyó la severidad de sus síntomas; esto concuerda con Molina et al. (2004) que sugieren que la afinina funciona como un factor inductor de defensa potencial, ya que en hojas de A. thaliana estimuló la resistencia a B. cinerea por efecto de cambios fisiológicos, así como con la activación de genes de desarrollo y defensa relacionados con el estrés, por medio de la acumulación de ácido jasmónico (Méndez et al., 2011).
Variables de crecimiento. En las variables de altura de planta y longitud de raíz las plantas mostraron diferencias significativas entre los tratamientos estudiados (Figura. 2), observándose un incremento de 56% en la altura de planta con la aplicación del extracto de H. longipes y de 14.3% cuando el extracto se asperjó en las plantas de tomate inoculadas con FOL, para la longitud de raíz el incremento con el uso del extracto correspondió a 84% y cuando se aplicó a plantas infectadas con FOL se presentó una disminución de esta variable 41% con respecto al testigo absoluto.
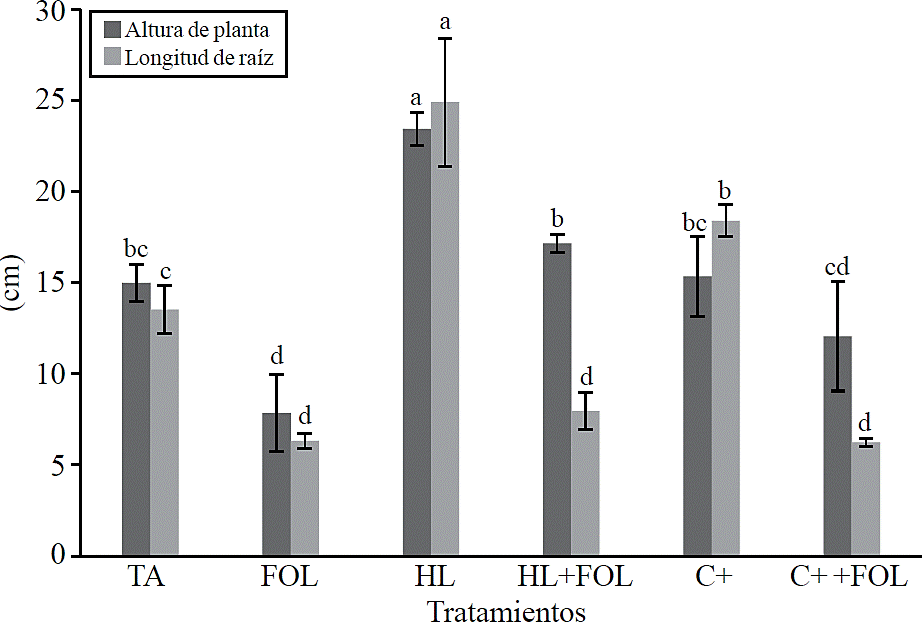
Figura 2 Efecto de la aplicación del extracto de H. longipes en la altura de planta y longitud de raíz en plántulas de tomate. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
También se encontraron diferencias significativas para el peso seco de hojas, tallo y raíz (Figura 3) observándose incrementos de hasta 185%, 177% y 503% respectivamente cuando las plantas fueron sometidas a la aplicación foliar de H. longipes, efecto contrario se encontró cuando el extracto se aplicó a plantas inoculadas con FOL, observándose un decremento de 27%, 18.5% y 17.6% en los valores de peso seco de hoja, tallo y raíz; sin embargo, esta disminución fue menor que la obtenida en las plantas inoculadas con FOL, las cuales tuvieron cerca de 60% en disminución en estas variables. El efecto del extracto de H. longipes sobre el desarrollo de la biomasa de hojas, tallo y raíz se atribuye a la acción biológica de las alcamidas presentes en el extracto, especialmente a la afinina. López (2007), indica que por sus efectos fisiológicos y celulares, las alcamidas son capaces de alterar diferentes aspectos de la vida de las plantas y se ha sugerido que se le considere como un regulador del crecimiento o fitohormona. Este efecto coincide con lo reportado por Campos et al. (2008) quienes encontraron que las alcamidas alteran el sistema y la arquitectura de la raíz y brotes, además de afectar la productividad de la biomasa de acuerdo a la dosis aplicada.
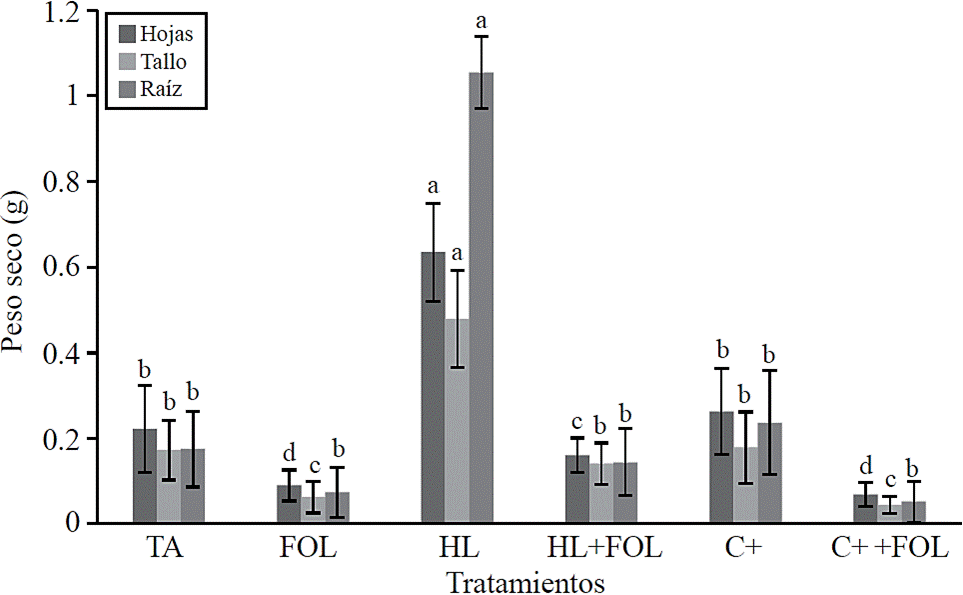
Figura 3 Efecto de la aplicación del extracto de H. longipes en el peso seco de hoja, tallo y raíz en plántulas de tomate. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
Cambios histológicos. En las microfotografías realizadas a la estructura de la raíz (Figura 4) del testigo absoluto (A), H. longipes (B) y el producto comercial (C), se observa una diferencia en la organización de la estela o cilindro vascular, en donde se aprecia una alteración en la distribución de los haces vasculares cuando se aplicó el extracto de H. longipes. Por otro lado, en las microfotografías del tratamiento inoculado con FOL (D), se puede observar una alteración en la estela, que presenta una diferencia en la distribución de haces vasculares, así como la presencia de un color más oscuro en la tinción de los haces vasculares; lo cual pudiera estar asociado al necrosamiento de estos tejidos provocado por FOL. En el tratamiento de la aplicación del extracto a plantas inoculadas con FOL (E) y la aplicación del producto comercial a plantas inoculadas con FOL (F) se aprecian cambios en la distribución dentro del cilindro vascular.
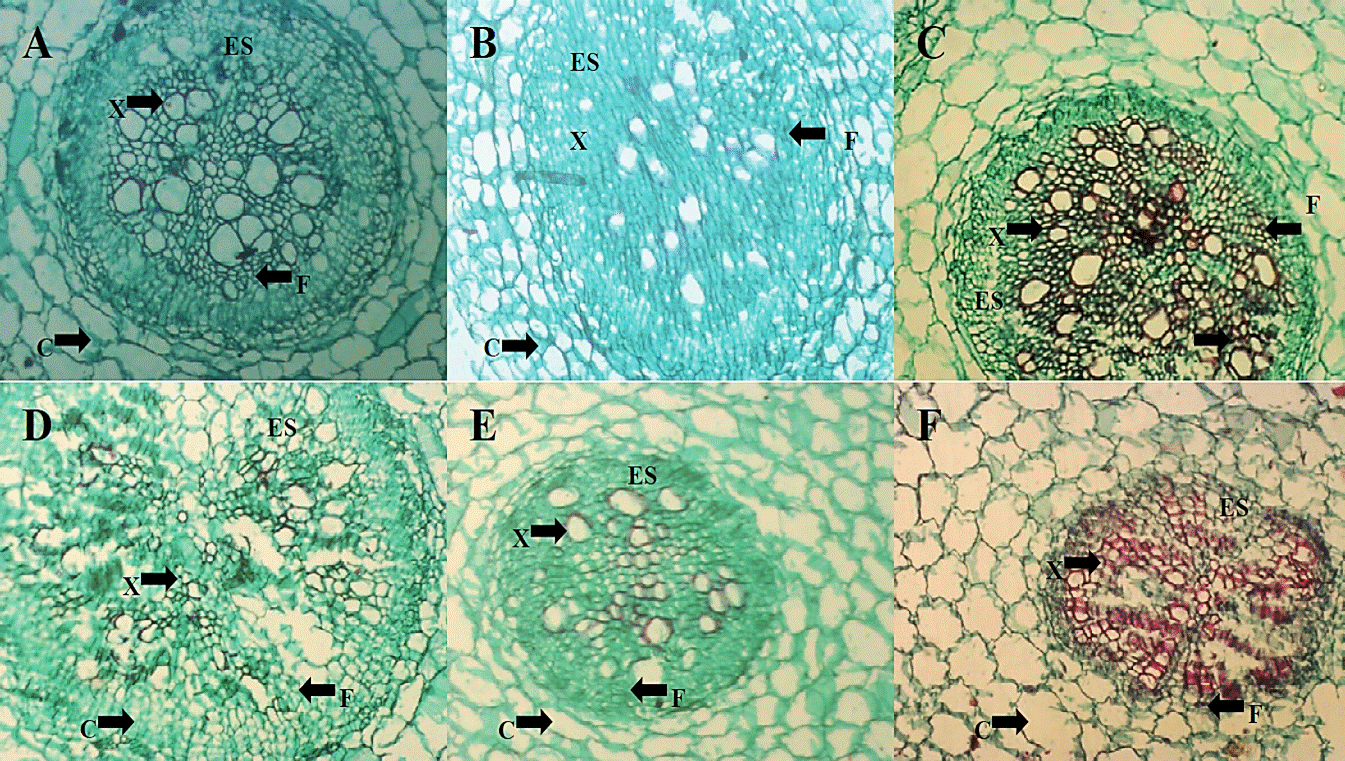
Figura 4 Microfotografías de cortes transversales de raíz de plántulas de tomate (4x) de los tratamientos TA (A), HL (B) y C+ (C) a los dos días de la aplicación del extracto, así como de los tratamientos FOL (D), HL+FOL (E) y C++FOL (F) a los seis días de la aplicación de los tratamientos, que muestran diferencias en la organización celular. C (córtex), ES (estela) X (xilema), F (floema).
En el caso del tallo (Figura 5) no se observaron cambios cualitativos con la aplicación de los tratamientos con respecto al testigo absoluto. Al comparar las microfotografías del testigo (A y D) en las dos fechas de evaluación no se aprecian cambios en la estructura debido quizá, a que a este intervalo de tiempo el hongo aun no colonizaba este tejido.
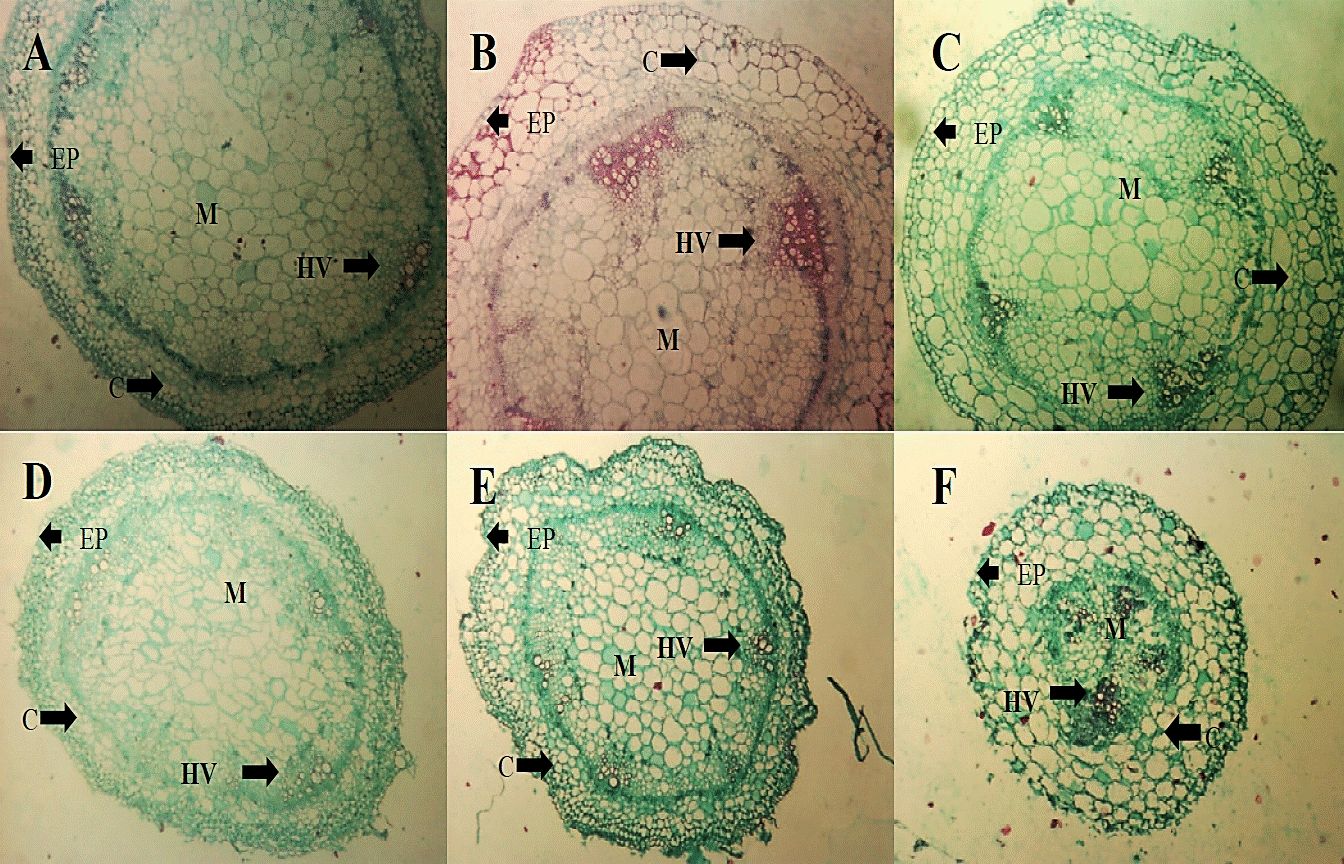
Figura 5 Microfotografías de cortes transversales de tallo de plántulas de tomate (2.5x) de los tratamientos TA (A) , HL (B) y C+ (C) a los dos días de la aplicación del extracto, así como de los tratamientos FOL (D), HL+FOL (E) y C++FOL (F) a 4X a los seis días de la aplicación de los tratamientos, que muestran diferencias en la organización celular. C (córtex), EP (epidermis), M (médula) y HV (haces vasculares).
Cuantificación de las variables histológicas. En consideración al área relativa ocupada por el córtex, se observó que en las muestras de raíz (Figura 6 A) evaluadas al segundo día de la aplicación del extracto de H. longipes se presentó una diferencia significativa, que se reflejó en el decremento de 7% cuando se asperjó el extracto y de 2% cuando las plantas se trataron con C+, en contraste durante la segunda evaluación los tratamientos estudiados mostraron incrementos en esta variable correspondientes a 174% con la aspersión de H. longipes, 217% con el uso del control positivo, 67% en las plantas inoculadas, 173% en aquellas asperjadas con el extracto e inoculadas y 178% en plantas asperjadas con el control positivo e inoculadas.
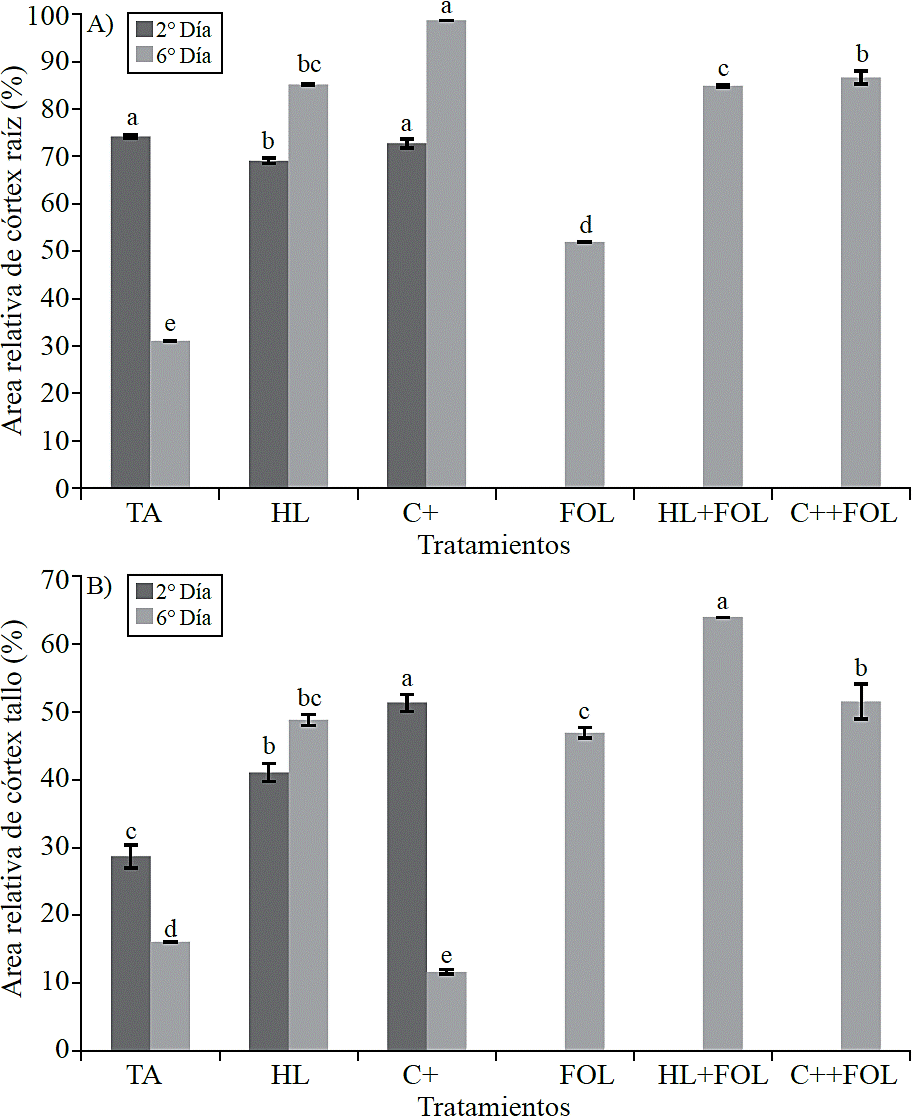
Figura 6 Efecto de la aplicación del extracto de H. longipes sobre el área relativa de córtex en muestras de raíz (A) y tallo (B) de plántulas de tomate para dos fechas de evaluación. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
Para el área relativa del córtex del tallo hubo diferencias significativas (Figura 6B), presentándose incrementos de 43% y 79% con la aplicación del extracto y el control positivo. Efecto similar se observó durante la segunda fecha de evaluación, donde los incrementos fueron 203% para las plantas asperjadas con el extracto, 192% en plantas inoculadas, 298% para aquellas plantas tratadas con H. longipes e infectadas con FOL y de 220% cuando se usó el producto comercial, mientras que cuando este se aplicó a plantas no inoculadas se observó una disminución de 27% en esta variable.
El efecto en el incremento del área relativa del córtex con la aplicación de H. longipes pudiera ser beneficioso para la planta, ya que este engrosamiento retrasaría la entrada del patógeno al cilindro vascular, evitando así la rápida proliferación de la enfermedad, ya que el sistema vascular es el que se ve afectado al ser obstruido por FOL, impidiendo la circulación de agua y nutrientes a través de él, lo cual trae como consecuencia la marchitez vascular de la planta. Pharand et al. (2002) estudiaron muestras de raíz de plantas de tomate tratadas con BTH (benzotiadiazol)y encontraron evidencia de que el crecimiento del hongo (F. oxysporum f. sp. radicis-lycopersici) ocurre principalmente en la epidermis y en la parte externa del córtex, por lo que este efecto podría ser similar a lo reportado en plantas de Silene vulgaris cuando son cultivadas en condiciones de sequía y estrés, ya que un mayor grosor del córtex es importante para mejorar la resistencia a la deshidratación, pues de esta manera, los tejidos internos a la endodermis están relativamente protegidos contra la deshidratación a expensas del córtex.
Al evaluar el número de vasos de xilema de la raíz se observaron diferencias significativas (Figura 7), donde en la primera evaluación se encontró que la aplicación del producto comercial incrementó el número de vasos del xilema en 47% con respecto al testigo absoluto, mientras que en las plantas asperjadas con el extracto de H. longipes se presentó un decremento en esta variable correspondiente a 41%. Para la segunda evaluación se observó un menor número de los vasos del xilema para todos los tratamientos con respecto al testigo, siendo el tratamiento con el producto comercial el que contó con un 24% menos.
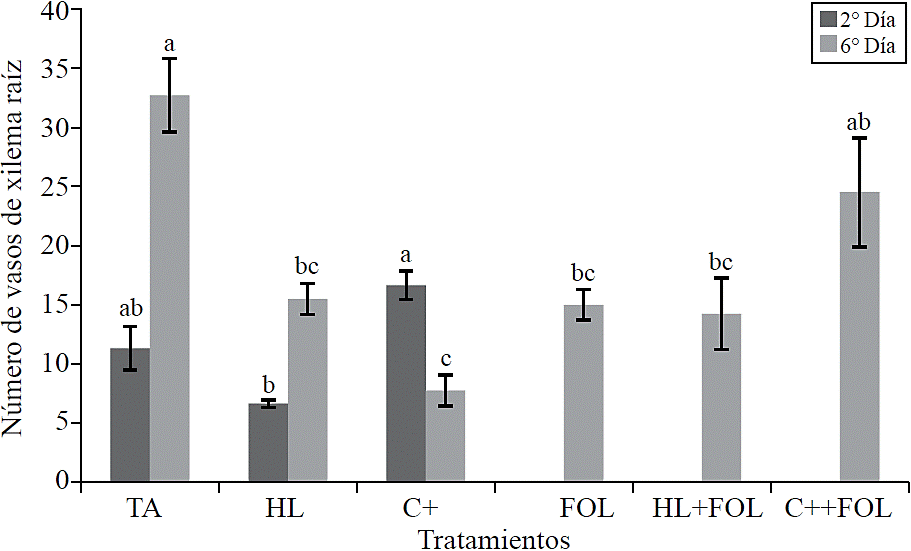
Figura 7 Efecto de la aplicación del extracto de H. longipes sobre el número de vasos de xilema en muestras de raíz de plántulas de tomate para dos fechas de evaluación. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
No se observaron diferencias estadísticas en el grosor de la pared celular de los vasos del xilema (Figura 8) así como en el área del lumen (Figura 9) correspondiente a las estructuras de raíz y tallo para ninguno de los tratamientos aplicados.

Figura 8 Efecto de la aplicación del extracto de H. longipes sobre el grosor de pared celular del xilema de muestras de raíz (A) y tallo (B) de plántulas de tomate analizadas para dos fechas de evaluación. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
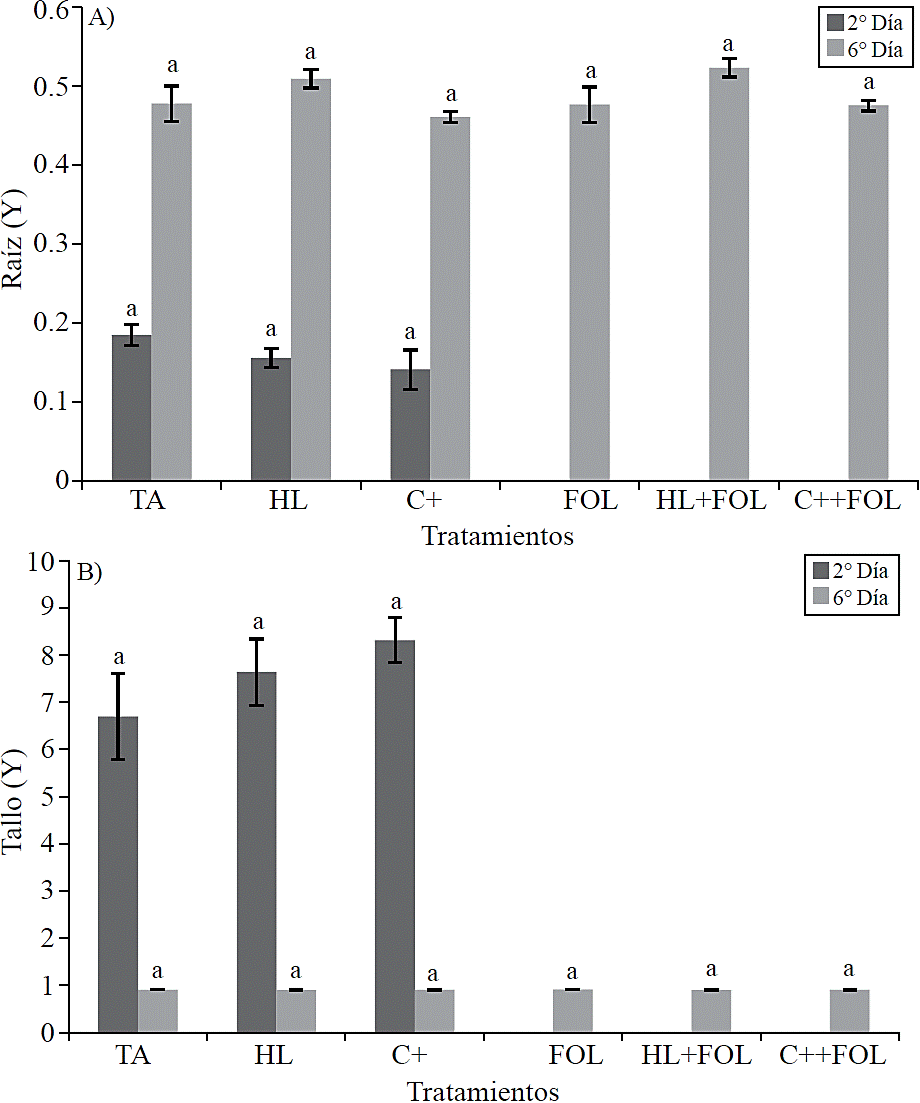
Figura 9 Datos transformados (Y) de los valores obtenidos del estudio de la aplicación del extracto de H. longipes sobre el área del lumen de muestras de raíz (A) y tallo (B) de plántulas de tomate para dos fechas de evaluación. Medias con literales iguales no difieren estadísticamente (Tukey, p> 0.05).
Las plantas infectadas con F. oxysporum mostraron necrosamiento en los vasos del xilema, los cuales pueden conducir a posibles alteraciones en la distribución de carbohidratos y ocasionar dificultad en el transporte de agua, lo que con lleva a la sintomatología de marchitez (Norueg, 1983). Se ha reportado que las especies de Fusarium causantes de marchitez siguen un patrón similar de infección; penetran por la raíz y colonizan en el tallo de las plantas el sistema vascular (Turlier et al., 1994). La colonización se restringe tanto en cultivares resistentes como susceptibles a la región de entrada inicial del patógeno, debido a la oclusión de los vasos por geles, deposiciones de calosa y tilosas (Takken y Rep, 2010); sin embargo, en este estudio no se observaron barreras estructurales asociadas a la respuesta pasiva de defensa de las plantas relacionada con la aplicación de moléculas elicitoras, esto coincide con lo descrito por Araujo et al. (2008), quienes evaluaron plantas de plátano inoculadas con F. oxysporum f. sp. cubense tratadas con fungicidas y extractos vegetales, quienes no encontraron alteraciones en los tejidos conductores de raíz y tallo, lo que se atribuyó a que los productos utilizados, no permitieron estas alteraciones o que el patógeno no estimuló su formación; o bien pudo ocurrir que la colonización continúa promovió que los geles y calosas fueran degradados por el efecto de enzimas pectolíticas del patógeno y el crecimiento de las tilosas fuera inhibido (González et al., 2012).
El efecto de H. longipes y el C+ sobre el número de vasos de xilema posiblemente tenga una función positiva para la planta disminuyendo la vulnerabilidad del xilema frente a la cavitación causada por el ataque de patógenos que afectan el sistema vascular (Sobrado, 2007; Pouzoulet et al., 2014).
Conclusiones
La aplicación del extracto de H. longipes reduce la severidad de síntomas de marchitez en las plántulas de tomate inoculadas con F. oxysporum f. sp. lycopersici. De igual manera, las plantas tratadas con el extracto presentan un efecto promotor de crecimiento, incrementando la altura, longitud de raíz y en biomasa total de la planta, además de cambios morfológicos en raíz y tallo sobre el área de la corteza y la médula. Por lo que el extracto de H. longipes pudiera actuar induciendo el sistema de defensa en las plantas de tomate, además de su favorable actividad como fitohormona, promoviendo el crecimiento vegetal.











 texto en
texto en 


