Introducción
La nochebuena es una especie nativa de México utilizada como planta ornamental durante las fiestas decembrinas en todo el mundo (Colinas et al., 2006), siendo el estado de Morelos la principal entidad productora en el país. Es posible obtener plantas de flor de nochebuena de buena calidad cuando se cultivan en condiciones propicias para la obtención de plantas sanas, fuertes y atractivas, por lo que es necesario enfatizar en el estudio de los factores que influyen en su producción. La nutrición es uno de los factores más determinantes en la producción de plantas ornamentales por el impacto en el crecimiento y la calidad al repercutir en el tamaño de las flores, así como en el área foliar, la obtención de colores más firmes y en el desarrollo del sistema radical (Pineda et al., 2008).
La nutrición de las plantas debe realizarse tomando en cuenta factores como: a) la calidad de agua; b) las propiedades del sustrato de cultivo; c) el estado fenológico de la planta; d) el clima; e) el tipo de fertilizante; f) la técnica de cultivo; y g) los objetivos de la nutrición. La nutrición mineral debe ser específica de acuerdo con la demanda según la etapa fenológica, destacando entre estas etapas las siguientes: 1) crecimiento radicular; 2) crecimiento vegetativo; y 3) floración (Vázquez y Salomé, 2004). El conocimiento de la cantidad de nutrimentos absorbidos por la planta en cada fase fenológica proporciona información que permite establecer programas de fertilización adecuados y fraccionados que permiten satisfacer las necesidades durante los periodos críticos de desarrollo determinados por la fenología del cultivo (Funnell et al., 1998; Fageria et al., 2006).
El nitrato (NO3-) es la principal fuente de nitrógeno (N) para la mayoría de las especies cultivadas. El N favorece el área foliar y el índice de área foliar (McCullough et al., 1994; Escalante, 1999), intensifica el color verde de las hojas, y es constituyente de componentes celulares esenciales como aminoácidos, proteínas y ácidos nucleicos; además, regula la absorción del fósforo (P), potasio (K+) y otros nutrimentos, mejorando el grado de suculencia de muchos cultivos y favoreciendo la fotosíntesis debido al aumento en la concentración de clorofila (Aroiee y Omidbaigi, 2004; Taiz y Zeiger, 2006; Sedano et al., 2011). Tanto el déficit como el exceso de N tienen un impacto negativo en las plantas, provocando una disminución en la producción (He et al., 1999; González et al., 2005), aumentando la susceptibilidad a los insectos plaga (Jauset et al., 2000; González et al., 2005) y a los patógenos (Duffy y Défago, 1999; González-Raya et al., 2005), así como la incidencia de enfermedades (Marschner, 2012).
El calcio (Ca2+) es un nutrimento básico para el correcto crecimiento de las plantas y es esencial en la división y expansión celular (White et al., 2000). En la nochebuena, una deficiencia de Ca2+ reduce el crecimiento de las hojas, causa acortamiento de los entrenudos cerca de la yema apical, induce tallos débiles así como necrosis en brácteas (Stromme et al., 1994; Ayala et al., 2008). El Ca2+ se encuentra involucrado en los mecanismos regulatorios que le permiten a la planta realizar ajustes bajo condiciones de estrés causado por altas y bajas temperaturas, y por estrés osmótico causado por sequía y salinidad (Liang et al., 2009).
La absorción del Ca2+, dependiendo de su concentración relativa en la solución nutritiva, puede ser disminuida sustancialmente debido al antagonismo con K+, magnesio (Mg2+) y amonio (NH4+); sin embargo, su absorción es estimulada por el NO3- (Jones et al., 1991; Villegas et al., 2005). En México se ha realizado poca investigación con respecto a la nutrición de nochebuena en función de las etapas fenológicas. En el contexto anterior, el presente estudio se estableció con el objetivo de comprender cómo el crecimiento y la calidad de nochebuena son influenciadas por la modificación de la relación NO3-:Ca2+ en la solución nutritiva, así como el determinar la relación óptima en las etapas fenológicas: 1) formación de raíces; 2) crecimiento vegetativo; y 3) floración.
Materiales y métodos
El experimento se llevó a cabo bajo in invernadero de cubierta plástica en el campo experimental de la Facultad de Ciencias Agropecuarias de la Universidad Autónoma del estado de Morelos, ubicado en el campus Chamilpa (18º 58’ 52.87” latitud norte y 99º 13’ 57.92” longitud oeste, 1 875 m de altitud) en Cuernavaca, Morelos. Las condiciones ambientales durante el experimento incluyeron una temperatura mínima y máxima promedio de 13.7 y 34.7 °C respectivamente, mientras que la humedad relativa osciló entre 55% y 73%. La radiación fotosintéticamente activa incidente diurna fue en promedio de 203 μmol m-2 s-1.
Esquejes enraizados de nochebuena cultivar Prestige se trasplantaron el 01 de julio de 2012 en contenedores de plástico negro de 15.2 cm de diámetro con un sustrato elaborado con una mezcla de tierra de hoja cernida, fibra de coco y tezontle rojo (con granulometría entre 0.1 a 0.5 cm de diámetro) en una proporción de 60:20:20 (%).
Se evaluaron tres concentraciones de NO3- (10, 12 y 14 mol(+) m-3) y tres de Ca2+ (7, 9 y 11 mol(+) m-3) diseñadas a partir de una modificación de la solución nutritiva universal de Steiner (1984) en la relación porcentual de iones, pero manteniendo las relaciones mutuas entre cationes y entre aniones y la cantidad total de iones. Tal modificación se realizó dentro de ciertos límites de concentración relativa de los iones involucrados ya que de otra manera la interacción entre los mismos puede influenciar fuertemente la absorción y la distribución o función de algún otro nutrimento por la planta, induciendo deficiencias o toxicidades (Schwarz, 1995; Villegas et al., 2005). Se modificó la concentración de NO3- con base en la relación NO3- + fosfato (H2PO4-) + sulfato (SO42-) de 12:1:7 (en mol(+) m-3), y Ca2+ con base en la relación K+ + Ca2+ + Mg2+ de 7:9:4 (en mol(+) m-3); se ajustó el potencial osmótico a -0.072 MPa con una conductividad eléctrica de 2 dS m-1 y el pH se ajustó a 5.5.
Considerando la interacción de ambos factores se obtuvieron nueve soluciones nutritivas (Cuadro 1), las cuales se suministraron en cada una de las etapas fenológicas de la nochebuena: crecimiento radicular, desarrollo vegetativo y pigmentación. La etapa de crecimiento radicular se consideró a partir del trasplante hasta la poda de las plantas, la cual se realizó cuando la raíz estaba visible en la parte externa del cepellón. La etapa de desarrollo vegetativo se consideró desde la poda hasta la aparición de las brácteas de transición, en tanto que la etapa de pigmentación se consideró desde la aparición de las brácteas de transición hasta la presencia de polen visible.
Previo a la etapa vegetativa y de pigmentación las plantas fueron irrigadas con la solución nutritiva de Steiner (1984), pero al alcanzar la etapa fenológica respectiva, las plantas se regaron con las soluciones nutritivas de los tratamientos. El riego se realizó manualmente con un volumen de 250 mL por planta cada tercer día o cuando la planta lo requería.
Las variables de crecimiento evaluadas incluyeron el área de brácteas (LI-3100C, LI-COR, Inc. Lincoln, Nebraska, E. U.) y el peso seco total y de cada órgano (brácteas, hojas, raíz y tallo), el cual fue registrado después de secar los tejidos en una estufa con circulación forzada de aire a una temperatura de 70 °C durante 72 h. Para definir la extracción de nutrimentos y relacionarlo con la etapa fenológica, al final de cada una de ellas se realizó un muestreo destructivo para extraer las plantas y separar los órganos, a los cuales se les analizó la concentración mineral en los tejidos vegetativos aéreos (hoja + tallo), raíz y brácteas (cuando estuvieron presentes) en tratamientos seleccionados (NO3-:Ca2+ en concentraciones de 10:7 y 14:11 mol(+) m-3 durante la etapa de crecimiento radical, 10:9 y 14:11 mol(+) m-3 durante la etapa de desarrollo vegetativo, y 10:9 y 12:7 mol(+) m-3 en la etapa de pigmentación) siendo estos los tratamientos con mayor y menor efecto en las variables evaluadas en cada una de las etapas. Se determinó la concentración de N total con base al método semimicroKjeldahl (Chapman y Pratt, 1973; Brearen y Mulvaney, 1982) y P, K, Ca y Mg vía digestión húmeda (Alcántar y Sandoval, 1999); posteriormente, los extractos obtenidos se leyeron en el equipo de espectrofotometría de inducción con plasma acoplado ICP-AES VarianTM, Liberty II. El azufre (S) se determinó por turbidimetría (Alcántar y Sandoval, 1999), con un espectrofotómetro (Thermo Spectronic-Genesys 10uv).
Los datos obtenidos se analizaron mediante análisis de varianza para los factores principales (NO3- y Ca2+) y la interacción en SAS 8.1 (SAS Inst., Cary, North Carolina, EU); el arreglo de tratamientos fue factorial completo 32 con cuatro repeticiones por tratamiento. En aquellos casos en que el análisis de varianza indicó que al menos un tratamiento fue distinto de los otros en cuanto a los resultados (p≤ 0.05), los promedios se separaron mediante una comparación de medias de acuerdo con la prueba de Tukey (p≤ 0.05).
Resultados
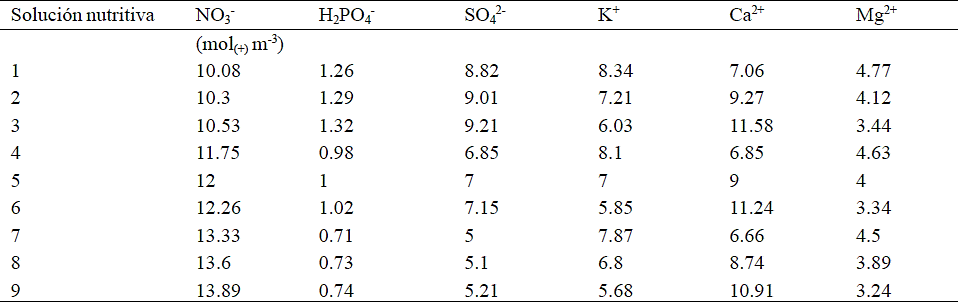
En la etapa de crecimiento radical, el NO3- tuvo un efecto adverso en el crecimiento de las plantas al elevarse la concentración a 14 mol(+) m-3 porque disminuyó significativamente la materia seca de tallo y hojas (Cuadro 2); asimismo, el aumento en la concentración de Ca2+ estuvo asociado con la disminución de la materia seca de las raíces (Cuadro 2).
Medias con la misma literal en la columna son iguales estadísticamente de acuerdo con la prueba Tukey (p ≤ 0.05), ns = no significativo.
Cuadro 2 Producción de materia seca y área de brácteas en flor de nochebuena por efecto de la concentración de nitrato (NO3-) y calcio (Ca2+) en la solución nutritiva en tres etapas fenológicas.
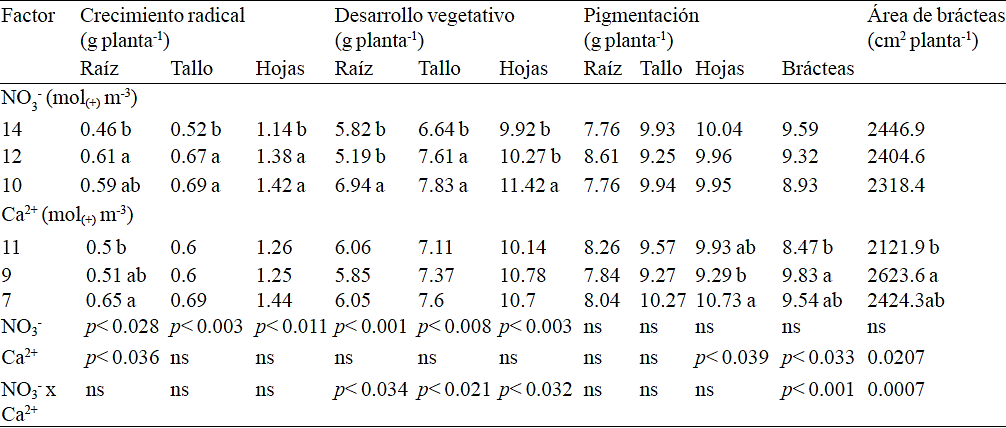
En la etapa de desarrollo vegetativo, el aumento en la concentración del NO3- causó una disminución en el crecimiento de las plantas; mientras que, el efecto principal del Ca2+ no fue estadísticamente significativo en el peso de materia seca de los órganos evaluados (Cuadro 2). La interacción de los factores en estudio mostró que, independientemente de la concentración de Ca2+, el aumento en la concentración de NO3- de 10 a 12 mol(+) m-3 se presentó una disminución en la materia seca de raíz, misma que incrementó nuevamente con la concentración más alta de NO3- tanto con 9 como con 11 mol(+) m-3 (Figura 1A). En cuanto al tallo (Figura 1B) y las hojas (Figura 1C), la interacción indicó que al incrementarse la concentración de NO3- hubo una reducción en el peso de la materia seca cuando la concentración de Ca2+ fue de 9 y 11 mol(+) m-3, pero con 7 mol(+) m-3 de Ca2+ la materia seca se incrementa sólo cuando se utiliza la solución con 12 mol(+) m-3 de NO3-.
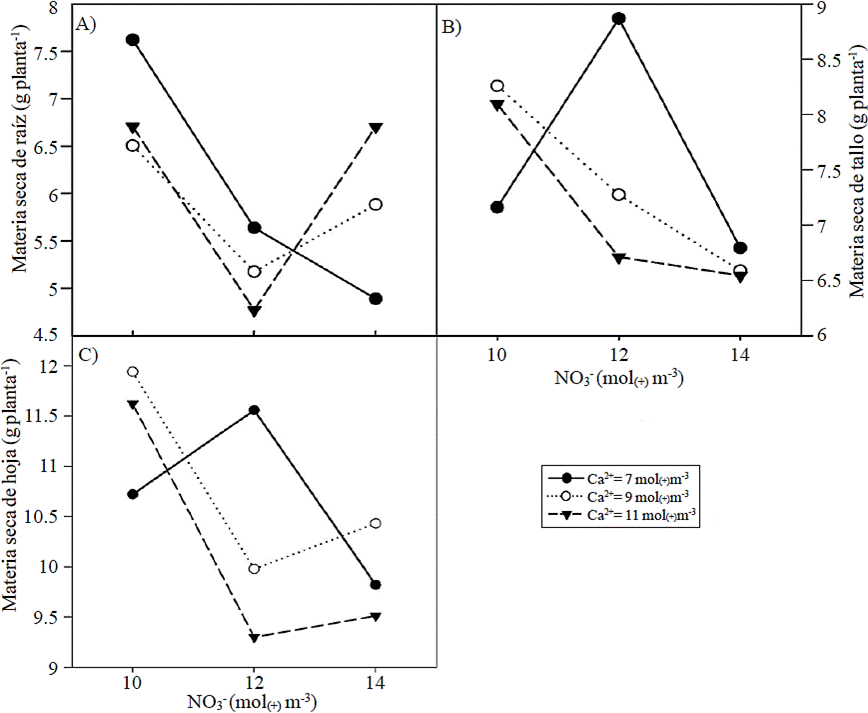
Figura 1 Efecto de la concentración de nitrato (NO3) y calcio (Ca2+) en la solución nutritiva aplicada durante la etapa de desarrollo vegetativo en la acumulación de materia seca de raíz (A), tallo (B) y hoja (C) de nochebuena.
Durante la pigmentación no fue significativo el efecto principal del NO3- en el peso de materia seca de los órganos analizados y en el área de brácteas. Se tuvo un efecto positivo de dosis decreciente de Ca2+ en la materia seca de hojas y brácteas, así como en el área de las brácteas (Cuadro 2). La interacción de los factores en estudio en el área de bráctea muestra que con una concentración de Ca2+ de 7 mol(+) m-3 se tuvo un aumento tanto en el área como en la materia seca de brácteas al elevarse la concentración de NO3-, respuesta que es detectada con la concentración de Ca2+ de 11 mol(+) m-3 y con 14 mol(+) m-3 de NO3- (Figuras 2A y 2B). En contraste, con 7 mol(+) m-3 de Ca2+ se presentó mayor área y materia seca de brácteas con niveles de NO3- de10 y 12 mol(+) m-3.
Figura 2 Efecto de la concentración de nitrato (NO3-) y calcio (Ca2+) en la solución nutritiva aplicada durante la etapa de pigmentación en el área (A) y materia seca de bráctea (B) en plantas de nochebuena.
La concentración de N, Ca, Mg, y S en parte aérea y raíz de plantas de nochebuena, no fueron afectadas en forma significativa por la relación NO3-:Ca2+ de la solución nutritiva en la etapa de crecimiento radical (Cuadro 3). Resultados similares se observan en la etapa de crecimiento vegetativo, donde no hay efecto de las relaciones evaluadas en las concentraciones de N, K, Mg y S en parte aérea, ni en las concentraciones de N, P, Ca, Mg y S en raíz (Cuadro 4).
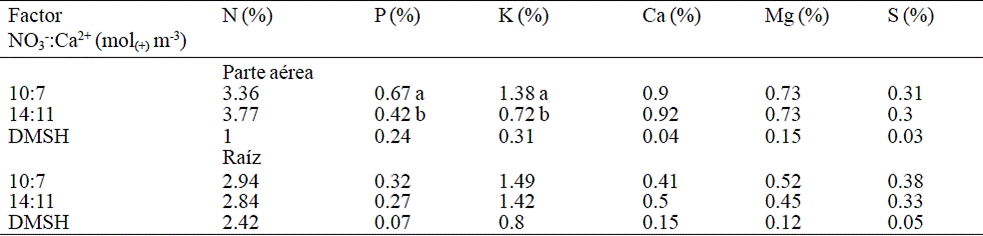
Medias con la misma literal en la columna, son iguales estadísticamente de acuerdo con la prueba Tukey (p≤ 0.05). DMSH, diferencia mínima significativa honesta.
Cuadro 3 Concentración de N, P, K+, Ca2+, Mg2+ y S en parte aérea y raíz de plantas de nochebuena durante la etapa de crecimiento radical, por efecto de la relación NO3-: Ca2+ en la solución nutritiva.
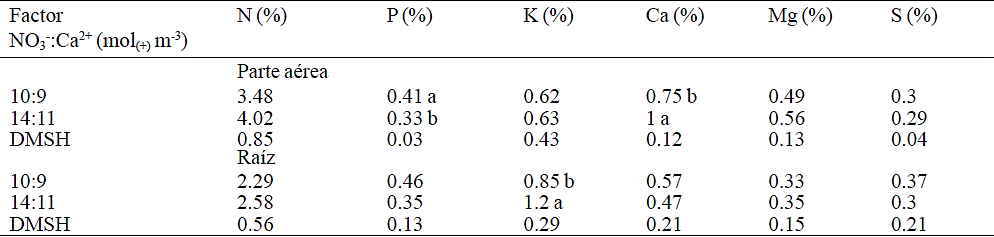
Medias con la misma literal en la columna, son iguales estadísticamente de acuerdo con la prueba Tukey (p≤ 0.05). DMSH, diferencia mínima significativa honesta.
Cuadro 4 Concentración de N, P, K+, Ca2+, Mg2+ y S en parte aérea y raíz de nochebuena durante la etapa de desarrollo vegetativo, por efecto de la relación NO3-:Ca2+ en la solución nutritiva.
En la etapa de crecimiento radical (Cuadro 3), la concentración de P en la parte aérea de la planta, fue estadísticamente superior con la relación NO3-:Ca2+ de 10:7 mol(+) m-3. De manera similar, durante el desarrollo vegetativo, con la relación 10:9 mol(+) m-3 de NO3-:Ca2+, se tuvo la concentración más alta de P en parte aérea (Cuadro 4).
De la misma manera, la concentración de K+ en la parte aérea de las plantas aumentó al reducirse la concentración de NO3- y Ca2+ en la solución nutritiva durante la etapa de crecimiento radical (Cuadro 3); la concentración de K+ en raíces en la etapa vegetativa, por el contario, se incrementa con el aumento en las concentraciones de NO3- y Ca2+ en la solución nutritiva (Cuadro 4).
Durante la etapa de pigmentación, las concentraciones de N, P, Ca y Mg en parte aérea y en brácteas no fueron influenciadas por las relaciones NO3-:Ca2+ evaluadas en la solución nutritiva. Así también en raíces, la concentración de P, Ca y Mg en raíces no fueron estadísticamente diferentes (Cuadro 5).
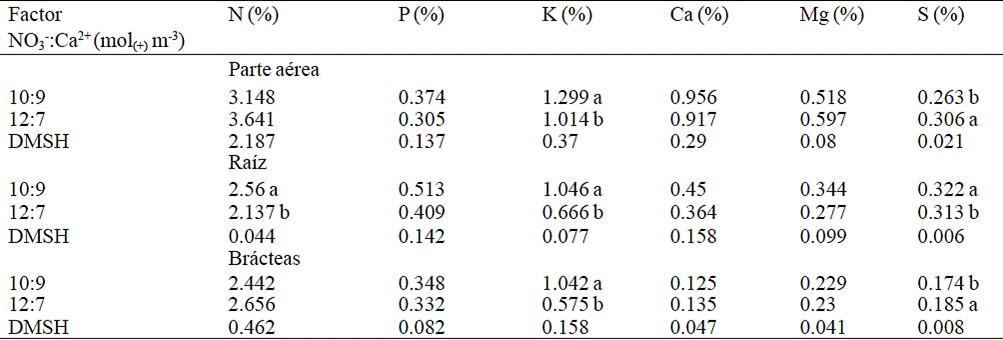
Medias con la misma literal en la columna, son iguales estadísticamente de acuerdo con la prueba Tukey (p≤ 0.05). DMSH, diferencia mínima significativa honesta.
Cuadro 5 Concentración de N, P, K+, Ca2+, Mg2+ y S en la parte aérea, raíz y bráctea de nochebuena durante la etapa de pigmentación por efecto de la relación NO3-:Ca2+ en la solución nutritiva.
En la etapa de pigmentación, la concentración de K+ fue más alta en todos los órganos de la planta cuando la solución nutritiva contenía 10 mol(+) m-3 de NO3- y 9 mol(+) m-3 de Ca2+; por el contrario, con esta relación la concentración de S disminuyó en la parte aérea y las brácteas (Cuadro 5). En las raíces, la concentración de S aumentó significativamente con esta solución nutritiva.
Discusión
Se han realizado pocos estudios sobre el efecto del NO3- y el Ca2+ en el crecimiento de las plantas; sin embargo, la importancia de realizar evaluaciones de la interacción entre estos nutrimentos es evidenciada en la presente investigación ya que los resultados sugieren que existe una respuesta de las plantas de nochebuena a las relaciones entre el NO3- y el Ca2+, la cual además estuvo en función de la etapa fenológica.
Durante la etapa inicial del crecimiento, la concentración de Ca2+ no tuvo efecto sobre el crecimiento de las plantas, en tanto que el NO3- tuvo un papel importante en la etapa de desarrollo de las raíces, ya que se acumuló mayor biomasa en la parte aérea y radical cuando se emplearon concentraciones de bajas a moderadas de NO3- (Cuadro 2).
En la fase de desarrollo vegetativo, la respuesta a la concentración de NO3- estuvo influenciada por la concentración de Ca2+; en general, se obtuvo una mayor biomasa del tallo y las hojas cuando se emplearon bajos niveles de NO3- (10 mol(+) m-3) en combinación con niveles altos de Ca2+ (9 a 11 mol(+) m-3). Igualmente, es posible obtener el mayor crecimiento de las plantas al incrementar el NO3- a 12 mol(+) m-3 si esto se combina con una disminución en la concentración de Ca2+ a 7 mol(+) m-3 (Figura 1). Por lo anterior, se concluye que en la fase de desarrollo vegetativo, así como en la de crecimiento radical, no se recomiendan altos niveles de NO3- para esta especie, lo cual puede ser debido a que en bajas concentraciones el NO3- es un activador del desarrollo radical pero tiene un efecto inhibitorio cuando las concentraciones son altas (Zhang et al., 1999; Crawford y Forde, 2002; Antolinez-Delgado y Rodríguez-López, 2008). El desarrollo radical implica una mayor asignación de reservas a la raíz, generando de esta manera un incremento en la superficie para la captación de agua y nutrimentos (Agreen y Franklin, 2003), lo que finalmente se refleja en un mejor desarrollo de la planta.
Los resultados del presente estudio contrastan con los reportados por Conley et al. (2002), quienes indicaron que se obtienen plantas de nochebuena con mayor tamaño y con mejor color y forma con niveles altos de N, entre 14.3 a 19.6 mol(+) m-3. Se ha demostrado que la mayor absorción de N en nochebuena ocurre en las primeras fases de crecimiento, antes de la inducción floral, pero desde la inducción floral hasta la formación de flores se incrementa la absorción de P, K+, y Mg2+, mientras que la absorción de Ca2+ permanece sin cambios entre la fase inicial y la de inducción (Scoggins y Mills, 1998); lo anterior también está en contraste con los resultados obtenidos en el presente estudio ya que se detectó que en la fase de floración el crecimiento de las brácteas estuvo influenciado más marcadamente por la concentración de Ca2+, aunque esta respuesta dependió de la concentración de NO3-.
Los resultados del presente estudio sugieren que durante la etapa de pigmentación, niveles de NO3- entre 10 y 12 mol(+) m-3 permiten el mayor crecimiento de las brácteas si se combinan con 9 mol(+) m-3 de Ca2+ (Figura 2). Lo anterior concuerda con la información presentada por Rose y White (1994), quienes indican que durante la inducción floral, se realiza un ajuste en la acumulación de materia seca hacia las brácteas y ciatios, ocasionando una disminución en los requerimientos de N. Similarmente, Paparozzi et al. (1994) señalan que en plantas ornamentales en maceta se requiere menos fertilizante una vez que se alcanza la antesis, lo cual fue confirmado por Kuehny et al. (2000) en varios cultivares de nochebuena, indicando que es necesario realizar ajustes en las dosis de fertilización.
El P tiene una gran influencia en el crecimiento de las raíces de las plantas, y específicamente en nochebuena donde la calidad óptima se obtuvo con la tasa de aplicación de P de 1.13 mol(+) m-3 (Khandan-Mirkohi et al., 2015), lo cual pudiera explicar la reducción en el crecimiento de las raíces observado cuando se aumentó la concentración de NO3- y Ca2+ puesto que para mantener un potencial osmótico homogéneo entre las soluciones nutritivas en evaluación, se tuvo que disminuir la concentración de H2PO4- y SO42- en aquellas soluciones con mayor concentración de NO3-. En el mismo sentido, la mayor concentración de P en la parte aérea de las plantas que se presentó durante la fase de crecimiento radical y vegetativa (Cuadro 3 y 4) en plantas tratadas con bajos niveles de NO3- y Ca2+, podría deberse al aumento en la concentración de H2PO4- en la solución nutritiva, por lo que la planta tuvo mayor disponibilidad de este nutrimento. Debido al impacto negativo de una deficiencia de P en el crecimiento de las raíces, el crecimiento de la parte aérea también puede ser afectado (Olivera et al., 2007), ya que ésta depende del transporte de nutrimentos y otras sustancias desde las raíces, lo que podría explicar también la reducción de la masa seca observada en el presente estudio en cada uno de los órganos al aumentar la concentración de NO3-.
Un hecho destacable fue de que a pesar de disminuir la concentración de K+ en la solución nutritiva para ajustar el potencial osmótico, las plantas lograron acumular una mayor concentración en los diferentes órganos durante las tres fases fenológicas, lo cual sugiere que el K+ es un nutrimento absorbido en mayor cantidad por nochebuena (Oliveira et al., 2004) y que existió un ajuste por parte de las plantas para aumentar su absorción a pesar de la disminución en la concentración externa.
La mayor concentración de S observada durante la pigmentación en parte aérea y raíz se registró con 12 mol(+) m-3 de NO3- (Cuadro 5), lo que puede ser debido a la relación entre los procesos de absorción y de metabolismo del N y S en plantas superiores (Koprivova et al., 2000). La mayor concentración de N en las plantas a pesar de la menor concentración de NO3- en la solución nutritiva que se observó en la fase de pigmentación puede ser explicado por el hecho de que durante la inducción floral se realiza un ajuste en la translocación de materia seca hacia las brácteas y ciatios, ocasionando una disminución en los requerimientos de N (Rose y White, 1994); además, el Ca2+ interviene en la absorción de NO3- (Tuna et al., 2007) y la concentración de Ca2+ en las brácteas de flor de nochebuena aumenta al disminuir la concentración de N y K+ en la solución nutritiva (Starkey y Nielsen, 2001). Se ha reportado incluso que las concentraciones de Ca2+ y el Mg2+ son más altas en plantas de nochebuena cuando se proporciona el N en forma de NO3- en lugar de NH4+ y que esta especie prefiere el N en forma de NO3- pues se obtiene la mayor biomasa (Scoggins y Mills, 1998). Por los datos anteriores se sugiere un cambio de relación por etapa fenológica entre el NO3- y el Ca2+ en la solución nutritiva para un óptimo crecimiento de plantas de nochebuena.
Conclusiones
La relación óptima entre la concentración de NO3- y Ca2+ estuvo en función de la etapa fenológica en flor de nochebuena. Durante la etapa de crecimiento radical se acumuló mayor biomasa cuando se emplearon concentraciones bajas de NO3- (10 a 12 mol(+) m-3), sin efecto de la concentración de Ca2+; mientras que, en la etapa de desarrollo vegetativo estos bajos niveles de NO3- (10 mol(+) m-3) deben combinarse con niveles altos de Ca2+ (9 a 11 mol(+) m-3). En la etapa de pigmentación, los niveles de NO3- entre 10 y 12 mol(+) m-3 permiten el mayor crecimiento de las brácteas si se combinan con concentraciones de Ca2+ de 9 mol(+) m-3.











 texto en
texto en