Introducción
Las plantas son organismos que continuamente producen compuestos químicos, volátiles y no volátiles que usan como señales para adaptarse y responder a los cambios del medio ambiente (Avanci et al., 2010). Entre estos, las fitohormonas tienen un papel importante, ya que están involucradas en actividades que promueven el crecimiento y desarrollo, al inducir un despliegue de procesos celulares, fisiológicos y morfológicos (Ashraf et al., 2010). Además, están implicadas en procesos cruciales relacionados al desarrollo y supervivencia de la planta, incluyendo mecanismos de defensa contra condiciones de estrés biótico (Zhang et al., 2009) y abiótico (Ashraf et al., 2010), metabolismo secundario, proceso reproductivo, desarrollo del fruto y senescencia (Wasternack, 2007). Dentro de estos compuestos se encuentra el ácido benzoico (AB) y derivados tales como el ácido salicílico (AS), metabolitos originados en la vía metabólica de los fenilpropanoides (Qualley et al., 2012).
El AB es un ácido carboxílico aromático que se encuentra de forma natural en las plantas, desempeñando importantes funciones en el metabolismo y crecimiento; sus sales y ésteres son conocidos como benzoatos. El AB y sus derivados son elementos estructurales en un gran número de metabolitos y productos naturales que realizan funciones críticas en las plantas, como reguladores de crecimiento, compuestos defensivos y atrayentes de polinizadores (Qualley et al., 2012). En los procesos industriales se utilizan como conservadores y potenciadores del sabor, analgésicos, antisépticos y quimioterapéuticos (Chipley, 2005). Los reportes indican que la aplicación exógena de esta sustancia, modifica la anatomía y morfología de especies comestibles y ornamentales, induce tolerancia al estrés y mejora la germinación en medios salinos (Benavides-Mendoza et al., 2004; Ortega-Ortiz et al., 2007). Asimismo, se ha documentado que el AB ejerce efectos positivos en las plantas bajo condiciones de crecimiento alejadas del óptimo, ya que modifica el perfil de nutrientes minerales acumulados en los tejidos. Por otro lado, se ha reportado que las plantas acumulan AB en el suelo, en donde funciona como un aleloquímico (Kaur et al., 2005); es decir, como un compuesto emitido al medio por las plantas que interfiere con el crecimiento de organismos competidores.
Por su parte, el AS es un compuesto fenólico que se identificó inicialmente en la corteza del sauce (Salix sp.) (Raskin, 1992), posteriormente fue aislado del metabolismo de la salicina, donde se le denominó salicil alcohol glucósido (Hayat et al., 2007). El AS actúa como antioxidante noenzimático, así como regulador del crecimiento vegetal, desempeñando un papel importante en la regulación de una serie de procesos fisiológicos de la planta incluyendo la fotosíntesis (Waseem et al., 2006; Arfan et al., 2007) y en general la actividad de los cloroplastos, la absorción y trasporte de nutrientes, provoca asimismo cambios en la anatomía de las plantas e incrementa el rendimiento (Khan et al., 2010; Purcărea and Cachita-Cosma, 2010).
Las aplicaciones exógenas de AS en plantas han mostrado inducir mayor tolerancia a las condiciones de estrés, como sequía (Horváth et al., 2007; Xu and Tian, 2008), fitotoxicidad (Metwally et al., 2003) y bajas temperaturas (López-Delgado et al., 1998; Janda et al., 1999; Farooq et al., 2008; Mora-Herrera y López-Delgado, 2006). Entre otros reportes, se menciona que las aplicaciones foliares de este compuesto, aumentan la biomasa de plantas de soya (Gutiérrez-Coronado et al., 1998) y el rendimiento de trigo (López-Tejeda et al., 1998). Además de aumentar la actividad enzimática (catalasa y peroxidasa) en tomate (Ortega-Ortiz et al., 2007) extiende la vida de anaquel de plátano (Srivastava and Dwivedi, 2000).
Cabe resaltar que en comparación con el AS el AB es un compuesto que ha sido poco estudiado en cuanto a sus aplicaciones agrícolas (Valdez-Sepúlveda et al., 2015). Si su aplicación ejerciera efectos positivos sobre las plantas sometidas a estrés biótico o abiótico, entonces pudiera constituirse en una alternativa más en el arsenal de compuestos naturales disponibles para la práctica agrícola. Sin embargo previo a ello son necesarios estudios acerca del efecto de este compuesto sobre el crecimiento de plantas de uso agrícola. Por lo anterior el presente estudio se realizó con el objetivo de evaluar el efecto de la aplicación exógena de los ácidos benzoico y salicílico sobre el crecimiento de plántulas de tomate, tomatillo y pimiento. El AS fue incluido en el estudio como una referencia bien conocida ya que se ha publicado mucho acerca de sus efectos benéficos en plantas.
Materiales y métodos
El experimento se llevó a cabo en condiciones de invernadero en la Universidad Autónoma Agraria Antonio Narro, ubicada en Saltillo, Coahuila, México, lugar con clima semiárido cálido según la clasificación de Köppen (BSh). Se utilizaron semillas de tomate tipo saladette (Solanum lycopersicum L.) var. “Rio Grande”, semillas de tomatillo (Physalis ixocarpa Brot) var. “Gran Esmeralda” y semillas de pimiento (Capsicum annuum) var. “Sven RZ”. Estas fueron germinadas en una mezcla de peat moss y perlita (80:20) en contenedores de poliestireno. El riego se realizó mediante goteo utilizando solución Steiner (Steiner, 1961) con una conductividad eléctrica de 1 500 μS cm-1 tres veces por semana en cada tratamiento.
Los tratamientos consistieron en aplicaciones foliares de AB y AS en concentraciones 10-4, 10-5, 10-6 M y un testigo con agua. Las aplicaciones se iniciaron a los 13 días después de la emergencia con periodicidad semanal; realizándose seis aplicaciones. Siete días después de la última aspersión, las plántulas fueron cosechadas para determinar el efecto de los tratamientos. El diseño experimental utilizado fue completamente al azar con 25 repeticiones por tratamiento, siendo la unidad experimental una plántula. Durante el desarrollo del experimento se realizaron tres muestreos de cuatro plántulas cada 14 días.
Las variables evaluadas fueron: altura, medida con una regla desde la base del tallo hasta el ápice terminal de la plántula; diámetro de tallo, para lo cual se tomaron lecturas en la parte media del tallo utilizando un vernier digital (Autotec Caliper 150mm) y área foliar, determinada con un medidor de área foliar (L1-3100, LI-COR). Posteriormente, las cuatro plántulas fueron seccionadas en hojas, tallos y raíces. El peso fresco de hojas (PFH), tallo (PFT) y raíz (PFR) se obtuvo con una balanza analítica (Ohaus Pioneer) y para el peso seco de hojas (PSH), tallos (PST) y raíces (PSR) estas se deshidrataron en un horno de secado con circulación forzada de aire (Lindberg Blue) a una temperatura de 70 °C durante 72 h. El contenido de minerales (K, Ca, Mg, Na, Fe, Zn, Cu y Mn) se analizó en cuatro plántulas por espectrofotometría de absorción atómica (Varian AA-1275) (Fick et al., 1976); el P se determinó mediante espectrofotometría visible (AOAC, 1980b) y el N se cuantificó por el método de micro Kjeldahl (AOAC, 1980a). Los resultados fueron analizados mediante análisis de varianza y la comparación de medias por el método LSD (p≤0.05) con el paquete estadístico SAS (2001).
Resultados y discusión
Los resultados señalan que la aplicación exógena del AB y AS en plántulas de tomate, tomatillo y pimiento causó cambios específicos significativos para la altura de plántula, área foliar y diámetro del tallo con algunas de las concentraciones pero no para las tres variables mencionadas al mismo tiempo; es decir, una respuesta positiva en una de las variables no se acompañó necesariamente de la misma respuesta en las dos restantes (Cuadro 1). Se sabe que dependiendo de la concentración el AB y AS inducen ciertas respuestas que no ocurren de forma sistemática ni predecible. Por ello es posible encontrar una respuesta en cierta concentración, por ejemplo 10-6 M, pero no observarla en 10-5 M, ya que los componentes celulares que responden con un umbral de 10-6 M no necesariamente son los mismos activados en 10-5 M.
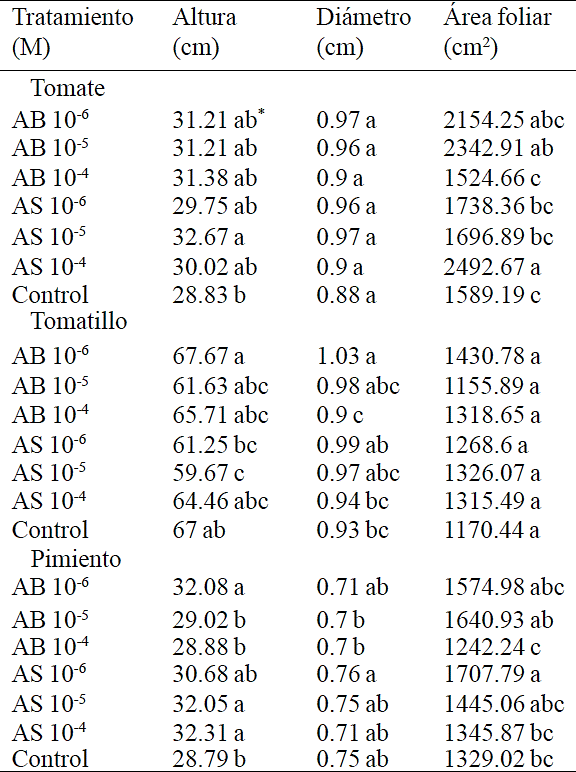
*Valores con la misma literal dentro de columnas para cada especie son iguales de acuerdo a la prueba LSD (p≤0.05). Cada valor es la media de 4 repeticiones.
Cuadro 1 Efecto de diferentes concentraciones de AB y AS asperjados en plántulas de tomate, tomatillo y pimiento en variables de altura de plántula, diámetro de tallo y área foliar.
Del mismo modo, la aplicación 10-4 M probablemente desencadene respuestas distintas a las observadas en 10-6 M, porque los componentes celulares activados o desactivados son diferentes. Actualmente se dispone de gran cantidad de estudios fisiológicos y bioquímicos acerca del efecto del AS en las plantas, pero se carece de modelos completos de la respuesta genómica o transcriptómica frente a estos compuestos (Rivas-San Vicente y Plasencia, 2011). Por lo tanto, las respuestas morfológicas o en la composición son complejas y difíciles de encuadrar en un modelo sencillo.
El efecto de la aplicación exógena del AS en el crecimiento de las plantas, depende de la especie, la etapa de desarrollo y la concentración aplicada (Rivas-San Vicente and Plasencia, 2011). La altura de las plántulas de tomate, incrementó 13.32% respecto al control aplicando AS 10-5 M; estos resultados son similares a los conseguidos por Larqué-Saavedra et al. (2010) quienes reportan un aumento de altura del 14.8% aplicando 1µM de AS. Entre los efectos benéficos de las aplicaciones de AS, se tienen los reportados en crisantemos, en donde se favoreció el crecimiento de la planta en diámetro y altura (Villanueva-Couoh et al., 2009).
Los efectos estimulantes del AS en el crecimiento de las plantas también se han reportado en soya (Zhao et al. 1995; Gutiérrez-Coronado et al. ., 1998), trigo (Shakirova et al., 2003), maíz (Gunes et al., 2007) y manzanilla (Kovácik et al., 2009). Del mismo modo, el área foliar de las plántulas de tomate aumentó por los tratamientos llegando hasta 56.85 y 47.43% respecto al control con los tratamientos AS 10-4 M y AB 10-5 M respectivamente. Estos resultados son superiores a los obtenidos por Larqué-Saavedra et al. (2010), quienes consiguieron un incremento del área foliar de 38.6% respecto al control, aplicando AS 1 µM. Es importante resaltar el número de aplicaciones necesarias para producir efectos positivos en las plantas, ya que en el presente estudio el AB y AS se aplicaron en seis ocasiones, en tanto que en el estudio de Larqué-Saavedra et al. (2010) se realizaron dos aplicaciones.
En cambio, en las plántulas de tomatillo la aplicación de AS 10-5 M redujo la altura 7.33 cm respecto al control. No obstante, en esta hortaliza la aplicación de AB 10-6 M, incrementó 10.75% el diámetro del tallo. El patrón de respuesta de esta variable, indica que las bajas concentraciones de AB, afectan positivamente el crecimiento de esta hortaliza, de manera que se confirma que la aplicación exógena de esta sustancia, modifica la anatomía y morfología de especies comestibles (Ortega-Ortiz et al., 2007).
Finalmente, las plántulas de pimiento se vieron afectadas positivamente al aumentar su altura en un rango del 11 al 12% respecto al control por los tratamientos AB 10-6, AS 10-5 y AS 10-4 M. Estudios realizados por Sánchez-Chávez et al. (2011) reportan un incremento significativo de la biomasa foliar de chile jalapeño aplicando AS 0.1 y 0.2 mM. Del mismo modo, el área foliar de las plántulas aumentó 28.50% respecto al control con el tratamiento AS 10-6 M. Cabe mencionar, que no se tenía información de patrones de respuesta de AB aplicados a Capsicum annuum y la presente información resalta que es una especie sensible a estos reguladores de crecimiento.
El AS tiene variaciones de concentración naturales derivadas de eventos de desarrollo como diferentes etapas fenológicas y de floración (Abreu and Munne, 2009). Por lo tanto, se espera que la concentración de AB también varié en el tejido de la planta. Además se sabe que los constantes ajustes tienen lugar en la concentración de AS en función de las condiciones de temperatura e irradiación (Mateo et al., 2006). En el Cuadro 2, se observa el efecto de las aplicaciones foliares del AB y AS en plántulas de tomate, tomatillo y pimiento sobre la biomasa aérea y de raíz. De nuevo, en función de la cantidad de AB y AS aplicada se promueven ciertas respuestas que no se ajustan a un patrón lineal. Actualmente se carece de modelos de la respuesta genómica o transcriptómica frente a estos compuestos, lo que lleva a que los estudios y aplicaciones se realicen bajo un esquema de ensayo y error. Por lo tanto las respuestas morfológicas o en la composición son complejas y difíciles de enmarcar en un modelo sencillo.
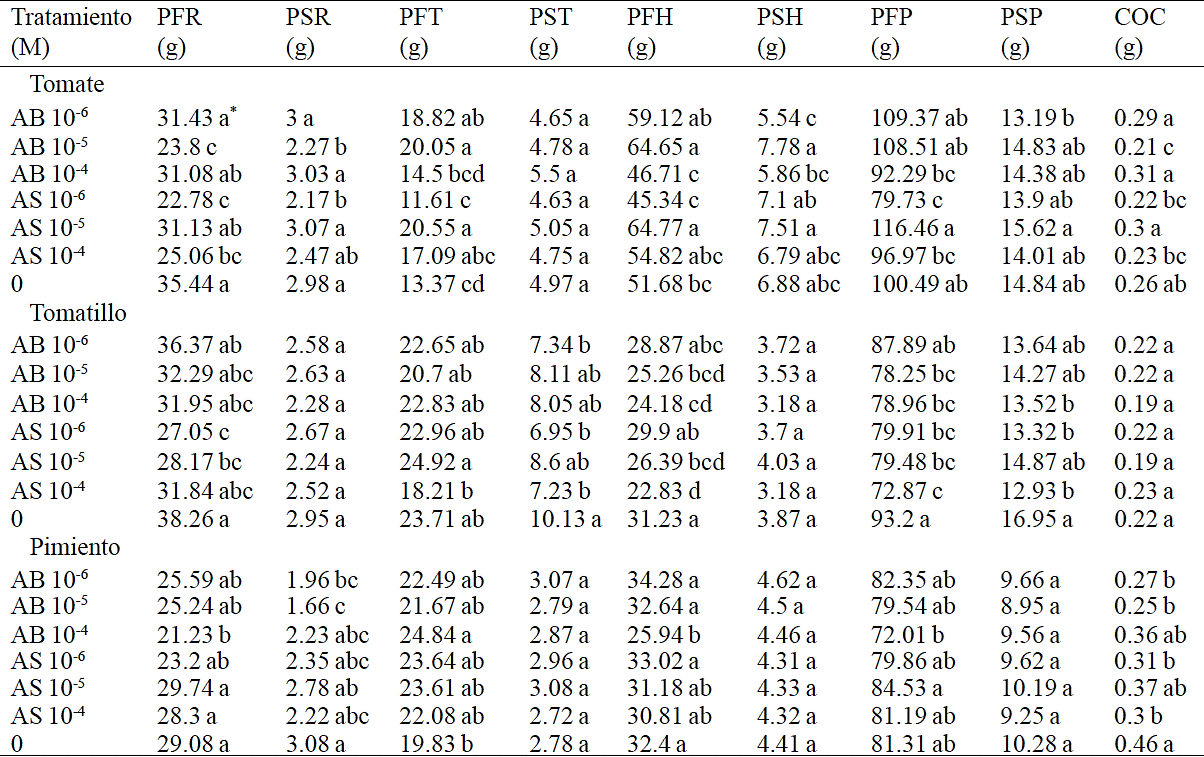
*Valores con la misma literal dentro de columnas para cada especie son iguales de acuerdo a la prueba LSD (p≤0.05). Cada valor representa la media de cuatro plantas. PFR: Peso fresco raíz; PSR: Peso seco raíz; PFT: Peso fresco tallo; PST: Peso seco tallo; PFH: Peso fresco hojas; PSH: Peso seco hojas; PFP: Peso fresco planta; PSP: Peso seco planta; COC: Cociente de la biomasa de la raíz y biomasa aérea.
Cuadro 2 Efecto de aplicaciones foliares de AB y AS sobre biomasa aérea y de raíz de plántulas de tomate, tomatillo y pimiento.
En las plántulas de tomate, el tratamiento AB 10-6 M disminuyó 5.45 g el PFT y aumentó 0.03 g el COC; el tratamiento AB 10-5 M redujo 11.64 g el PFR y 0.71 g el PSR; en cambio aumentó 6.68 g el PFT y 12.97 g el PFH; por su parte el tratamiento AB 10-4 M incrementó 0.05 g el COC. En cuanto a las aplicaciones de AS, la concentración 10-6 M redujo 12.66 g el PFR y 0.81 g el PSR y aumentó 20.76 g el PFP; por el contrario el tratamiento AS 10-5 M incrementó significativamente 7.18 g el PFT, 13.09 g el PFH y 0.04 g el COC; finalmente el tratamiento AS 10-4 M redujo 10.38 g el PFR. Se puede observar que no hay una tendencia sistemática y se aprecia que cierta concentración aumenta o disminuye alguna de las variables. La mayor parte de la literatura indica que el efecto del AS en el crecimiento de las raíces es positivo (Gemes et al., 2008; Umebese et al., 2009; Ahmad et al., 2013). Los reportes indican que el AS incrementa significativamente el crecimiento radical de soya (Gutiérrez-Coronado et al., 1998) y pino (Pinus patula) Schiede ex Schltdl & Cham (San Miguel et al., 2003). Por otro lado, se ha reportado (Ramírez et al., 2006) que las aplicaciones de AB 10-6 M aumentan significativamente el PFR de repollo (Brassica oleracea).
De acuerdo a Salisbury y Ross (1994), las modificaciones conseguidas en el crecimiento, se deben a que el AS fomenta la producción de ácido indolacético y de ácido naftalenacético que son reportados como los principales reguladores de crecimiento vegetal. Se ha documentado que los niveles de AS son inversamente proporcionales a los niveles de lignina y al crecimiento en algunas plantas (Gallego et al., 2011).
Asimismo, las plántulas de tomatillo fueron afectadas por las aplicaciones exógenas de AS y AB. Para el caso de las aplicaciones de AB, la concentración 10-6 M disminuyó 2.79 g el PST; la concentración 10-5 M redujo 5.97 g el PFH y 14.95 g el PFP; un comportamiento similar ocurrió al aplicar AB 10-4 M donde se disminuyó 7.05 g el PFH, 14.24 g el PFP y 3.42 g el PSP. Por su parte, los tratamientos con AS presentaron un patrón de respuesta similar al descrito anteriormente. El tratamiento AS 10-6 M redujo 11.21 g el PFR, 3.18 g el PST, 13.29 g el PFP y 3.63 g el PSP; la concentración 10-5 M disminuyó 10.09 g el PFR, 4.84 g el PFH y 13.72 g el PFP y por último, el tratamiento AS 10-4 M redujo 2.9 g el PST, 8.4 g el PFH, 20.33 g el PFP y 4.02 g el PSP. Estos resultados sugieren la importancia de realizar experimentos para despejar interrogantes como la concentración de AB y AS, y el número de aplicaciones necesarias para producir efectos positivos en esta hortaliza. Entre otros reportes se han documentado los efectos positivos al aplicar AS en otras especies vegetales; por ejemplo, en pino y crisantemo estudios realizados sobre el uso de diferentes dosis de AS mostraron incrementos en la producción de raíz (San Miguel et al., 2003; Echeverría-Machado et al., 2007; Villanueva-Couoh et al., 2009).
En las plántulas de pimiento, las aplicaciones de AB causaron cambios específicos significativos en algunas de las variables. El tratamiento AB 10-6 M disminuyó 1.12 g respecto al control el PSR; un comportamiento similar se observó al aplicar AB 10-5 M en donde se redujo 1.42 g respecto al control el PSR; por su parte, la aplicación de AB 10-4 M redujo 7.85 g respecto al control el PFR y aumentó el PFT y PFH 5.01 y 6.46 g respectivamente. Estos resultados sugieren que la aplicación exógena de AB (10-4, 10-5 y 10-6 M) en esta hortaliza, no incrementa el sistema radical de las plántulas. En cambio, Ramírez et al. (2006) afirman que la aplicación de AB 10-6 M incrementa el peso fresco total de plántulas de repollo.
En el Cuadro 3 se muestran los resultados del contenido de minerales de las plántulas de tomate, tomatillo y pimento asperjadas con AB y AS en donde se encontraron diferencias significativas entre algunos de los minerales. En general los resultados mostraron difer encias (p≤ 0.05) entre los minerales analizados (K, Ca, Mg, Na, Fe, Zn, Mn, Cu) y las especies estudiadas. En tomate, las plántulas tuvieron un incremento significativo en el contenido de Ca por los tratamientos AB 10-5 y AB 10-4 M; el Mg aumentó por el tratamiento AS 10-5 M; el Na incrementó por los tratamientos AB 10-6 y AS 10-5 M; el contenido de Zn fue mayor en todos los tratamientos respecto al control; el Mn incrementó por los tratamientos AB 10-5 y las tres concentraciones de AS; por último el Cu aumentó por los tratamientos AB 10-5 M, AS 10-6 y AS 10-5 M.
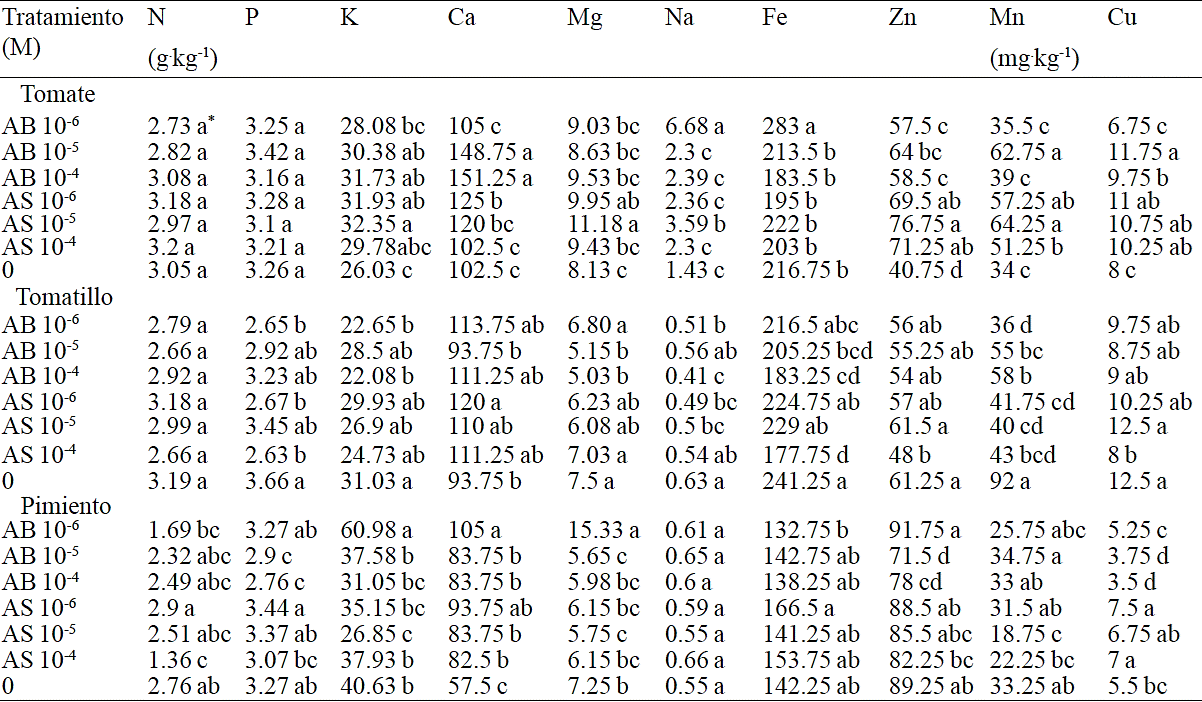
*Valores con la misma literal dentro de columnas para cada especie son iguales de acuerdo a la prueba LSD (p≤0.05). Cada valor representa la media de cuatro plantas.
Cuadro 3 Efecto de diferentes concentraciones de AB y AS en el contenido de minerales en plántulas de tomate, tomatillo y pimiento.
Es importante señalar que cada especie demanda requerimientos particulares de nutrimentos que permiten un crecimiento y un vigor óptimo, estos requerimientos no son constantes y cambian según las plantas y el medio donde crecen y se desarrollan (Timmer and Armstrong, 1987). En términos generales el uso de AS asperjado de forma foliar muestra un beneficio en el crecimiento de las partes aéreas de las plantas en situaciones en donde algunos factores de estrés están presentes (Khodary, 2004; Najafian et al., 2009; Azooz and Youseef, 2010; Wang et al., 2010); sin embargo, en el presente estudio las plántulas no se sometieron a algún tipo de estrés.
En contraste, en las plántulas de tomatillo se puede apreciar un efecto negativo por efecto de los tratamientos. El contenido de Na redujo significativamente con el tratamiento AB 10-4 M; este mismo tratamiento disminuyó significativamente el contenido de Fe. Igualmente, el contenido de Mn fue afectado negativamente por todos los tratamientos. La aplicación de los tratamientos modificó el perfil de los nutrientes minerales acumulados en los tejidos. Posiblemente a través de efectos interactivos entre los propios elementos minerales en la planta esto se tradujo en una disminución general en la concentración de aquellos.
Para el caso de las plántulas de pimiento, estas incrementaron el contenido de K y Mg con el tratamiento AB 10-6 M; el contenido de Ca aumentó significativamente por efecto de todos los tratamientos; finalmente el contenido de Zn fue menor al aplicar AB 10-5 M. Los reportes señalan que la aplicación de AS 10-8 M en chile habanero (Capsicum chinense Jacq) incrementa el contenido de K, Fe, Zn y Cu (Guzmán-Antonio et al., 2012). Del mismo modo, en plántulas de chile jalapeño (Capsicum annuum L.), Preciado et al. (2007) reportaron contenidos entre 12.6 y 28.7 mg por planta de N; entre 0.93 y 1.11 mg de P y entre 9.9 y 14 mg de K, cabe destacar que estas diferencias se atribuyen a la biomasa producida. En el presente estudio, las aplicaciones de AB y AS no mostraron una tendencia clara en cuanto al contenido de minerales en las hortalizas evaluadas, por lo que a futuro se deberá explorar un rango de varias concentraciones y aumentar el número de aplicaciones.
Conclusiones
La aplicación de AS y AB en plántulas de tomate y pimiento dio lugar a respuestas positivas en algunas variables de crecimiento y de composición mineral. En el tomatillo casi todas las variables respondieron de forma negativa frente al AS y AB.
Las plántulas de tomate incrementaron la altura al ser asperjadas con AS 10-5 M; además el área foliar fue mayor al aplicar AB 10-5 y AS 10-4 M. Las plántulas de tomatillo redujeron la altura con el tratamiento AS 10-5 M, por el contrario el AB 10-6 M incrementó el diámetro de tallo de esta hortaliza. Por otro lado, las plántulas de pimiento fueron mayores con los tratamientos AB 10-6, AS 10-5 y AS 10-4 M; asimismo, el área foliar fue mayor en el tratamiento AS 10-6 M. El patrón de respuesta de la biomasa aérea y de raíz de las tres especies no fue sistemático ni predecible, de manera que si una variable aumentaba otra podía disminuir.
El contenido de Zn en las plántulas de tomate fue significativamente mayor respecto al control en todos los tratamientos. La aplicación de AS y AB disminuyó el contenido de los minerales en las plántulas de tomatillo. Por último el contenido de Ca en las plántulas de pimiento fue significativamente mayor respecto al control en todos los tratamientos.











 texto en
texto en 


