Introducción
El fruto de la especie Physalis ixocarpa (Brot, ex Hornem.) es conocido como tomatilllo, tomate de cáscara, miltomate, tomate de fresadilla, tomate de hoja, tomate milpero, es una solanácea originaria de México. A México se le reconoce como centro de origen, diversidad y domesticación del género Physalis ya que está representado por 50 especies (D’Arcy, 1991; Menzel, 1951; Peña y Márquez, 1990; Santiaguillo et al., 1994). La especie P. ixocarpa ha sido fuente alimenticia desde épocas prehispánicas, su distribución es desde Estados Unidos hasta Nicaragua (Sánchez et al., 2006). En 2014 la superficie cultivada fue de 46 524 ha y el rendimiento fue de 14.94 t ha-1 (SIAP-SAGARPA, 2014), lo que la ubica dentro de las 10 especies hortícolas más importantes a nivel nacional.
A pesar de la amplia variabilidad genética, tanto en el tomate silvestre como en el domesticado, el rendimiento medio nacional se considera bajo, de acuerdo al rendimiento potencial de la especie 40 t ha-1 esto debido a una actividad agronómica limitada por el uso de variedades nativas de bajo rendimiento y sistemas de producción ineficientes, escasez de agua de insumos agrícolas y de semilla de baja calidad (Peña y Santiaguillo, 1999). Se han realizado numerosos esfuerzos para mejorar el rendimiento y la calidad funcional y nutrimental de este fruto como cruzas dialélicas, selección masal visual estratificada, cruzas planta x planta y más recientemente inducción de poliploídia entre otros (Peña et al., 1998; Peña-Lomelí et al., 2002; Santiaguillo et al., 2004; Robledo et al., 2011; Ramírez et al., 2012).
El mejoramiento genético por duplicación de cromosomas ha logrado poblaciones tetraploides en las que se observa un incremento en el ciclo de vida, altura de planta, peso de fruto y diámetro ecuatorial de fruto, frutos por planta y sólidos solubles y vitamina C, (Robledo-Torres et al., 2011; Jiménez-Santana et al., 2012). En los poliploides la semilla se observa con mayor tamaño y cantidad de masa, lo que puede afectar el vigor o la capacidad de dispersión, presentan además menor viabilidad, germinación y emergencia de la plántula (Bretagnolle et al., 1995; Al et al., 1998; Beaulieu et al., 2007; Zhang et al., 2010).
Las semillas son el método convencional para su propagación; sin embargo, la gran variabilidad genética no garantiza un rendimiento constante. Por otro lado, la propagación por semilla es limitada por su baja viabilidad (Ramírez et al., 2013) y baja tasa de germinación. Al respecto se hace necesario, incrementar la emergencia de las semillas de tetraploides para lo cual existen diferentes técnicas que favorecen e incrementan la sincronización de la emergencia, la velocidad y porciento de germinación en las semillas, además generan resistencia a factores bióticos y abióticos. Estas técnicas incluyen la imbibicion de la semilla en osmoreguladores, soluciones salinas y reguladores de crecimiento (Dahal et al., 1990). Arroyo-Medina et al. (2008) mencionan que la aplicación en ácidos orgánicos en semillas de interés hortícola tuvo efecto positivo en la germinación, peso seco y longitud de tallo y radícula.
Sin embargo, para mantener y multiplicar materiales tetraploides seleccionados, se requieren métodos de reproducción vegetativa, lo cual permite perpetuar el genotipo a través de generaciones (Van y Kroon, 1990), que no es posible a través de semilla, por lo que una buena alternativa alternativa para conserva las cualidades en la mejora de producción de biomasa, propiedades funcionales en tetraploides sería la micropropagación la cual ha sido ampliamente reportada en Physalis ixocarpa, el primer fue hecho por Bapat y Schieder (1981) por cultivo de protoplastos, posteriormente otros investigadores han reportado a partir de organogénesis directa, embriogénesis somática y cultivo de anteras (Ramírez-Malagón y OchoaAlejo, 1991; Ortuño et al., 1998; Manzo-González et al., 1998; Contreras y Almeida, 2003; Yousry 2013; Yoursdy, 2014) las técnicas de propagaciones utilizadas fue a través de embriogénesis somática, tallos adventicios, sin embargo no existe información sobre la propagación masiva de variedades tetraploides.
El objetivo del presente trabajo fue evaluar la respuesta de las semillas tetraploides de tomatillo en el porciento de germinación e índice de velocidad de germinación con la aplicación de reguladores y ácidos orgánicos y además micropropagar la variedad tetraploides con la combinación de diferentes reguladores de crecimiento.
Materiales y métodos
Germinación
El trabajo se realizó en la Universidad Autónoma Agraria Antonio Narro en el Laboratorio de Cultivo de Tejidos Vegetales del Departamento de Fitomejoramiento.
Etapa de hidratación
Se evaluó el tiempo de hidratación pesando la semilla cada 4 h hasta que el peso de la semilla fue constante.
Viabilidad
Esta variable se evaluó determinando la viabilidad inicial de la semilla en la prueba de capacidad de germinación. Donde la metodología para evaluar la viabilidad se realizó conforme a las reglas internacionales ISTA (2009), determinando las semillas viables y no viables, en tres repeticiones de 20 semillas, sometidas a imbibición en agua corriente durante 24 horas en una tubo de ensaye de vidrio de 15 X100 mm. Las semillas se disectaron a la mitad, se sumergieron en tetrazolio en obscuridad y se incubaron a 30º C por 2 h; posteriormente se observaron en el microscopio estéreo y se evaluó el porcentaje de viabilidad.
Índice de velocidad de emergencia
El IVE se obtuvo contando a diario las semillas emergidas durante 21 días después de la siembra. Considerando la ruptura de la testa como semilla emergida. Para calcular su valor se utilizó la siguiente fórmula de acuerdo con Maguirre (1962).
Donde: IVE= índice de velocidad de emergencia; Núm. P= número de plantas emergidas; D= días después de la siembra.
Pretratamientos
Se conformaron los siguientes pretratamientos: ácido giberélico: G1= a 10-2 M, G2=10-4 M, G3=10-6M; ácido sulfosalicílico: ASS1= 10-2 M, ASS2= 10-4 M, ASS3= 10-6 M ácido salicílico: AS1= 10-2 M, AS2=10-4 M, AS3=10-6 M; ácido benzoico: AB1= 10-2 M, AB2= 10-4 M, AB3=10-6 M y un testigo (T). Cada tratamiento consistió en tres repeticiones con 10 semillas por frasco. Se determinó en un estudio preliminar el tiempo en el cual las semillas llegaban a la máxima absorción de agua que fue de 4 h. Con este dato las semillas se imbibieron en las diferentes soluciones de reguladores y ácidos orgánicos.
Una vez transcurrido el tiempo de saturación hídrica, las semillas pretratadas se desinfectaron en una solución alcohol al 70% por un minuto y se enjuagaron en agua destilada estéril, posteriormente se colocaron en hipoclorito de sodio al 20% y se enguajaron con agua destilada estéril tres ocasiones bajo la campana de flujo laminar, se sembraron en medio Murashige y Skoog (MS) a mitad de su concentración suplementados con 100 mg L-1 de mio-inositol(SIGMA®, I-3011), 1 mg L-1 de tiamina-HCl(SIGMA®,T-3 906), 1 mg L-1 de piridoxina-HCL (SIGMA®,P-8 666), 1 mg L-1 Kinetina, 30 g L-1(SIGMA®,K-0753) de sacarosa, 8 g L-1de agar(SIGMA®, A-1 296) ajustando a un pH de 5.7 y se esterilizó a 120 °C durante 15 min y se transfirieron al cuarto de incubación a una temperatura de 25±1° C, con 16 h luz y 8 de oscuridad a 2 500 lux.
Establecimiento
Para esta etapa se utilizó plántulas germinadas in vitro en medio basal MS a mitad de la concentración adicionada con 100 mg L-1 de mio-inositol (SIGMA®,I-3011), 1 mg L-1 de tiamina-HCL(SIGMA®,T-3 906), 1 mg L-1 de piridoxina-HCL (SIGMA®, P-8 666), 80 mg L-1 de adenina, 30 g L-1 (SIGMA®, K-0753) de sacarosa, 4 g L-1de phytagel (SIGMA®, A-1 296), se ajustó a un pH de 5.7. Las plántulas generadas de 15 d se seccionaron para la obtención de explantes.
Micropropagación
Para la micropropagación se utilizaron medio MS y PCL2 adicionada con 100 mg L-1 de mio-inositol (SIGMA®,I-3011), 1 mg L-1 de tiamina-HCL(SIGMA®,T-3906), 1 mg L-1 de piridoxina-HCL (SIGMA®,P-8666), 40 mg L-1 de adenina, 30 g L-1 (SIGMA®,K-0753) de sacarosa, 4 g L-1de phytagel (SIGMA®, A-1296), se ajustó a un pH de 5.7 y se esterilizó a 121° C durante 15 min. La siembra se transfirió al cuarto de incubación a una temperatura de 25 + 1° C, con 16 horas luz y 8 de oscuridad a 2 500 lux. El medio se renovó cada quince días. Se utilizaron la combinación de los fitoreguladores: BAP (bencilaminopurina) y kinetina a 0, 0.5, 1, 2 y 3 mg L-1 con ácido naftalenácético (ANA) a 0 y 0.5 mg L-1.
Se utilizaron como explantes: hipocotilos, cotiledones y segmentos nodales. Las variables a evaluar fueron número de brotes por explante y longitud del explante., número y longitud de raíces.
Resultados y discusión
Viabilidad
Se obtuvo 75% de semillas de tomate de cáscara viables y 25% de no viables, indicando que la semilla está fuera del rango de calidad fisiológica para la comercialización de semillas o en estudios sobre la germinación, según el SNICS lo recomendado debe ser un mínimo de 85%. Estos datos son coincidentes con un estudio previo para determinar la viabilidad de polen en variedades tetraploides de tomatillo donde se observó una disminución de la viabilidad en comparación con polen de planta diploide (Ramírez et al., 2013), con estos datos se confirma lo mencionado por algunos autores sobre la disminución de la viabilidad y fertilidad de las semillas poliploides (Bretagnolle et al., 1995).
La comparación de los diversos tratamientos (Figura 1 y 2) indicó que el testigo presentó los valores más bajos de germinación con 13.33% y IVG de 0.19, iniciando la emergencia en el día 21. El tratamiento con AG observó un incremento significativo en la germinación en todas las concentraciones (X= 64.44). La emergencia inició en el cuarto día después de la siembra con un porciento de germinación para AG1, AG2 y AG3· de 73.33, 56.66, 63.33% y un IVG de 20.26, 10.44 y 11.59 respectivamente. Se ha reportado que el AG participa en los procesos de regulación del crecimiento y desarrollo de las plantas.
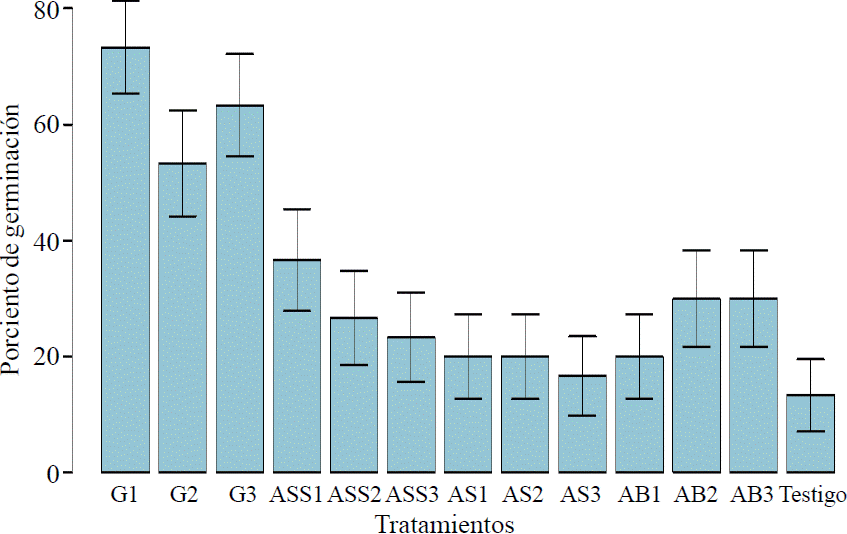
Figura 1 Porcentaje de germinación en la aplicación de soluciones en semillas tetraploides de tomatillo.

Figura 2 Comportamiento del índice de velocidad de emergencia en semillas tetraploide de tomatillo (Physalis ixocarpa), aplicando reguladores y ácidos orgánicos.
El tratamiento con ácido giberélico está asociado con la rápida utilización de la síntesis de aminoácidos y amidas, lo cual incrementa la tasa de germinación. (Gupta y Mukherjee 1982). Además está relacionada con el incremento de fenoles al modificar la ruta biosintética de los flavonoides (Gosch et al., 2003; Halbwirth et al., 2003). En la semilla los fenoles son producidos en la testa y están relacionados con los procesos morfogenéticos del embrión (Dixon et al., 2005; Zhao et al., 2010; Dean et al., 2011).
Con respecto a los ácidos orgánicos el tratamiento con ASS presentó el mayor promedio de germinación (X= 28.88), seguido por el AB (X= 26.66), y con el menor promedio el AS (X= 18.88). Cabe destacar que aunque los IVG (Figura 3) fueron menores, la germinación con los ácidos orgánicos inició el primer día de la siembra. Los ácidos orgánicos derivan de la vía metabólica de los fenilpropanoides, compuestos que participan como fitohormonas en la cascada de señalización intracelular y controlan la producción de compuestos secundarios que funcionan como defensas de las plantas (Álvarez y Espinosa, 2004).
Los pretratamientos de imbibición de la semilla y la siembra el mismo día aumentan la tasa de germinación y emergencia de las semillas.
Los resultados confirman que los pretratamientos germinativos son una herramienta que incrementa la tasa y porcentaje de germinación
Micropropagación
Esta etapa tuvo como objetivo establecer un protocolo para la propagación clonal del cultivar tetraploide de P. ixocarpa. Para ello se probó dos medios basales y diferentes combinaciones y concentraciones de reguladores. Todas los tratamientos resultaron en regeneración de brotes (Cuadro 1 y 2), pero la inducción fue mayor en el tratamiento con 3 mg L-1 de BAP con la combinación de ANA con 9.5 brotes por expalnte, a partir de los segmentos nodales. La mayor longitud de brote (8.93 cm) se obtuvo con 0.5 mg l-1 BAP con 0.5 ANA (8.02 cm) del medio PLC2, en este medio también se observó el mayor número de raíces (4.3) y la mayor longitud de las mismas (4.6 mm) se logró en el medio MS en el tratamiento con 1 mg L-1 de BAP. La menor respuesta (2.7 brotes/explante) se observó en el tratamiento de BAP (0.5 mg L-1) solo, en el medio PCL2.

Cuadro 1 Comparación de medias del efecto de diferentes concentraciones de BAP, kinetina y ANA en el número de brotes, longitud de brotes, número y longitud de raíces en medio basal MS. (H=Hipocotilos; C=Cotiledones).

Cuadro 2 Comparación de medias del efecto de diferentes concentraciones de BAP, kinetina y ANA en el número de brotes, longitud de brotes, número y longitud de raíces en medio basal PCL2 (H=Hipocotilo; C= Cotiledones).
Se observó una respuesta diferencial entre los diversos explantes tanto los cotiledones como el hipocotilo no generaron respuesta morfogenética contrario a lo observado por Contreras y Almeida (2003), quienes mencionan una mayor cantidad de yemas (66) con el hipocotilo en medio MS con BAP (2 mg L-1), mientras los cotiledones generaron una menor respuesta (54) con zeatina. También Ramírez-Malagón y Ochoa-Alejo (1991) mencionan una mayor proliferación de brotes a partir de hipocotilo con 2.5 mg L-1 de BAP con 1 mg L-1de ANA.
Una observación de interés fue la capacidad de formación de flores en el sistema in vitro. (Figura 3). Entre las dos citocininas, BAP fue la más efectiva al inducir mayor número de brotes por explante comparado con la kinetina. Al respecto, otros investigadores coinciden que BAP fue la citocinina que indujo mayor formación de brotes (29-32) en el género Physalis (Afroz et al., 2009).
Existen otros trabajos realizados en este mismo género donde la combinación de BAP y ANA (Alejo, 1991; Yousry, 2013) logró una respuesta morfogenética óptima.
Una observación de interés fue la capacidad de formación de flores en el sistema in vitro. (Figura 3). Además en este caso, el sistema radicular se desarrolló espontáneamente eliminando la necesidad de medio con auxinas antes de la aclimatización. De acuerdo con Zhao et al. (2008) una relación alta entre citocinina y auxina promueve la regeneración de raíz.
Andrade-Rodríguez et al. (2005) observaron una amplia variabilidad en la obtención de brotes en diferentes variedades de Physalis ixocarpa desde 1.9 en variedades silvestres hasta 21.3 en domesticados. Estos mismos autores mencionan que la capacidad organogénica está dada por el genotipo de la variedad utilzada. La capacidad organogénica de este cultivar se encuentra por debajo de lo reportado para los cultivares domesticados.
La respuesta de la planta depende en gran medida del genotipo y algunas modificaciones y ajustes deben ser realizadas cuando nuevas especies o cultivares son consideradas para esta técnica. El cultivar tetraploide demostró necesitar una alta concentración de citocinina exógena en la etapa de propagación.
Conclusiones
Los resultados obtenidos permiten establecer un protocolo de germinación y propagación masiva del cultivar tetraploide. El ácido giberélico y los ácidos orgánicos favorecen la emergencia de la plántula con un porcentaje alto de germinación en menor tiempo. El regulador bencialaminopurina solo, es el indicado para la micropropagación.











 texto en
texto en 



